重组海参溶菌酶基因工程菌的构建及原核表达
2012-09-25常艺海,丛丽娜,卢冬
常 艺 海, 丛 丽 娜, 卢 冬
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
溶菌酶通过切断细菌细胞壁中黏多糖N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键的联结,解体肽聚糖支架,导致细胞裂解, 从而起到杀死细菌的作用[1]。溶菌酶分布广泛,主要存在于动物、植物和微生物的各种组织、体液及分泌物中[2],同时也是生物体内重要的非特异性免疫因子之一[3]。已有文献报道水生动物重组溶菌酶抗菌谱与鸡蛋溶菌酶在功能上存在明显的差异,它不仅能溶解常见的革兰氏阳性菌,而且还能溶解革兰阴性菌,通常引起水产动物严重病害的病原菌主要是以副溶血性弧菌为主的革兰阴性菌[4]。因此,重组海参溶菌酶可以应用于水生动物的病害防治及提高其自身机体自身免疫能力等方面。作者以海参i-型溶菌酶cDNA的成熟肽基因为模板,设计一对特异性引物并扩增出目的基因SL,将其连接到表达载体pET32a(+)上,从而构建出重组质粒pET-32a(+)-SL,将其转化至大肠杆菌Rosetta(DE3)pLysS中诱导表达,最后对表达后的海参溶菌酶进行Western blotting鉴定。
1 材料与方法
1.1 材 料
1.1.1 菌种和质粒
大肠杆菌Rosetta(DE3)pLysS和表达载体pET-32a(+),Novagen(美国)公司;大肠杆菌DH5α和克隆载体pMD18-T,TaKaRa Biotechnology(大连)公司。
1.1.2 试剂与工具酶
限制性核酸内切酶、DNA ladder marker、蛋白低分子质量marker、TaKaRa one step RNA PCR Kit(AMV)试剂盒、RNAiso Plus试剂,TaKaRa Biotechnology(大连)公司;质粒提取和琼脂糖凝胶电泳DNA回收试剂盒,天根生化科技(北京)有限公司; HisTrap HP,GE Healthcare(美国)公司;Penta-His抗体,Qiagen(德国)公司;HRP标记的兔抗鼠IgG单抗,Zymed(美国)公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 海参溶菌酶(SL)成熟肽基因的扩增
(1)RNA模板制备:取新鲜海刺参肠,在含有液氮的研钵中搅碎,根据RNAiso Plus试剂说明抽提总RNA。提取后的样品放在-80 ℃保存。
(2)海参SL基因的PCR扩增:以海参溶菌酶cDNA序列为模板,设计上游引物HS-Q-1和下游引物HS-Q-2,并分别引NcoⅠ和EcoRⅠ限制性酶切位点(下划线表示)。
HS-Q-1:5′-GGCCATGGCTATGCAAGTT
CCTTCTGAT-3′
HS-Q-2:5′-GTCGAGGAATTCTCAGTTG
TTGCTCATGTC-3′
使用TaKaRa one step RNA PCR Kit(AMV)进行RT-PCR。50 μL反应体系:RNase Free dH2O 24 μL,10×One Step RNA PCR Buffer 5 μL,MgCl2(25 mmol/L)10 μL,dNTP Mixtrue(各10 mmol/L)5 μL,RNase Inhibitor(40 U/μL)1 μL,AMV RNase XL (5 U/μL)1 μL,Total RNA(1 μg/μL)1 μL,AMV-Optimized Taq(5 U/μL)1 μL,上游特异性引物(20 μmol/L)1 μL,下游特异性引物(20 μmol/L)1 μL。PCR循环参数:50 ℃ 30 min,94 ℃ 2 min;94 ℃ 30 s,61 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃延伸10 min。反应结束后,取出PCR产物5 μL,用1.0%的琼脂糖凝胶电泳检测目的基因是否正确。
1.2.2 重组表达质粒pET32a(+)-SL的构建
利用琼脂糖凝胶电泳DNA回收试剂盒将正确的目的基因SL片段回收并纯化。将其在16 ℃ 条件下,过夜连接至克隆载体pMD18-T上,构建pMD18-SL重组质粒,将其转化至大肠杆菌DH5α感受态细胞中,进行氨苄西林和蓝白斑筛选。选择菌落PCR和双酶切质粒鉴定为阳性的重组质粒pMD18-SL,测序验证其序列的正确性。用NcoⅠ和EcoRⅠ酶切重组质粒pMD18-SL后,回收目的基因片段SL,并于16 ℃过夜连接至经同样限制性内切酶处理pET32a(+)载体上,构建重组表达质粒pET32a(+)-SL。将pET32a(+)-SL和pET 32 a(+)同时转化至Rosetta(DE3)pLysS 感受态细胞中,并在含有100 μg/mL氨苄西林和34 μg/mL的氯霉素的LB琼脂平板培养基上37 ℃ 过夜培养。分别挑取单菌落接种于100 μg/mL 氨苄西林和34 μg/mL 氯霉素的LB液体培养基中,37 ℃振荡培养10~12 h,按照质粒提取试剂盒的说明提取质粒,进行PCR及双酶切检测鉴定。选择菌落PCR和双酶切鉴定都为阳性的重组质粒pET32a(+)-SL,测序验证其序列是否正确。
1.2.3 融合蛋白在大肠杆菌中的诱导表达及纯化
将测序验证正确的重组质粒pET32a(+)-SL和阴性对照空载体转化的阳性菌株,分别接种于含100 μg/mL氨苄西林、34 μg/mL氯霉素及终质量浓度为10 g/L葡萄糖的LB液体培养基,37 ℃,160 r/min过夜培养。按1%的接种量接种于含100 μg/mL氨苄西林、34 μg/mL氯霉素和质量浓度为5 g/L葡萄糖的LB液体培养基,37 ℃,160 r/min培养至OD600达0.6~0.7,加入诱导剂IPTG(终浓度为0.5 mmol/L),28 ℃,120 r/min 诱导培养15 h左右。按参照文献[5]的方法,离心收集诱导后的菌体,重悬于已预冷的1×PBS (pH 7.4)缓冲液中,再加入Triton X-100 至质量分数为1%。置冰浴中超声裂解至不再黏稠。将超声裂解后的液体悬液4 ℃,12 000 r/min离心15 min,收集上清液,-20 ℃保存备用。最后将诱导前、诱导后、上清液和沉淀4个样品,采用15%分离胶浓度的SDS-PAGE检测重组蛋白的表达。浓缩胶及分离胶的配置参照文献[6]。
参照GE Healthcare 的HisTrap HP使用说明,准备1 mL HisTrap HP affinity column(即Ni2+-NTA亲和层析柱),用约10倍柱体积蒸馏水冲洗柱子,用约10倍柱体积的结合缓冲液(40 mmol/L 咪唑、20 mmol/L磷酸钠溶液、500 mmol/L NaCl,pH 7.4)平衡。破碎离心后的上清液样品经0.22 μm过滤处理后,以约1.0 mL/min 上柱,再用约24倍柱体积的结合缓冲液冲洗柱子,最后用约10倍柱体积的洗脱液(500 mmol/L咪唑、20 mmol/L磷酸钠溶液、500 mmol/L NaCl,pH 7.4),洗脱目的蛋白SL,收集并取适量的样品进行SDS-PAGE检测。
1.2.4 Western blotting 检测重组蛋白SL
将提取的总蛋白进行15% SDS-PAGE电泳后,转至PVDF膜上,放置在含1.5% BSA封闭缓冲液中,4 ℃平放过夜。加入1∶1 000稀释的Penta-His抗体,进行一次抗体反应1 h。Tris-HCl 缓冲液(pH 7.4)含0.1% Tween 20,洗涤2次;洗涤Tris-HCl缓冲液(pH 7.4)冲洗3次后,再加1∶1 000的稀释的HRP标记的兔抗鼠IgG单抗,进行二次抗体反应1 h。再重复洗膜1次,再加入TrueBlue过氧化物酶底物,显色1 min后,观察结果。
2 结果与分析
2.1 SL成熟肽基因的扩增与重组表达质粒的构建
利用海刺参溶菌酶的cDNA 序列为模板,设计上游引物HS-Q-1和下游HS-Q-2,其中在引物HS-Q-1的5′端引入NcoⅠ和HS-Q-2的3′端引入EcoRⅠ限制性酶切位点,经RT-PCR 得到了长度约400 bp(图1)的特异性PCR产物,与理论大小基本一致。将提取后pMD18-SL质粒用限制性内切酶NcoⅠ和EcoRⅠ双酶切,并割胶回收目的基因SL,将其连接到经过同样处理的pET-32a(+) 载体上,转化至E.coliDH5α。经菌落PCR检测,在400 bp左右显示一条特异性亮带,再提取该菌的质粒进行双酶切鉴定,结果显示出(图2)与预计的目的片段和空白载体大小一致的条带,表明重组质粒构建成功。将该质粒进行测序验证,结果显示其与GenBank中海刺参cDNA的成熟肽完全一致。
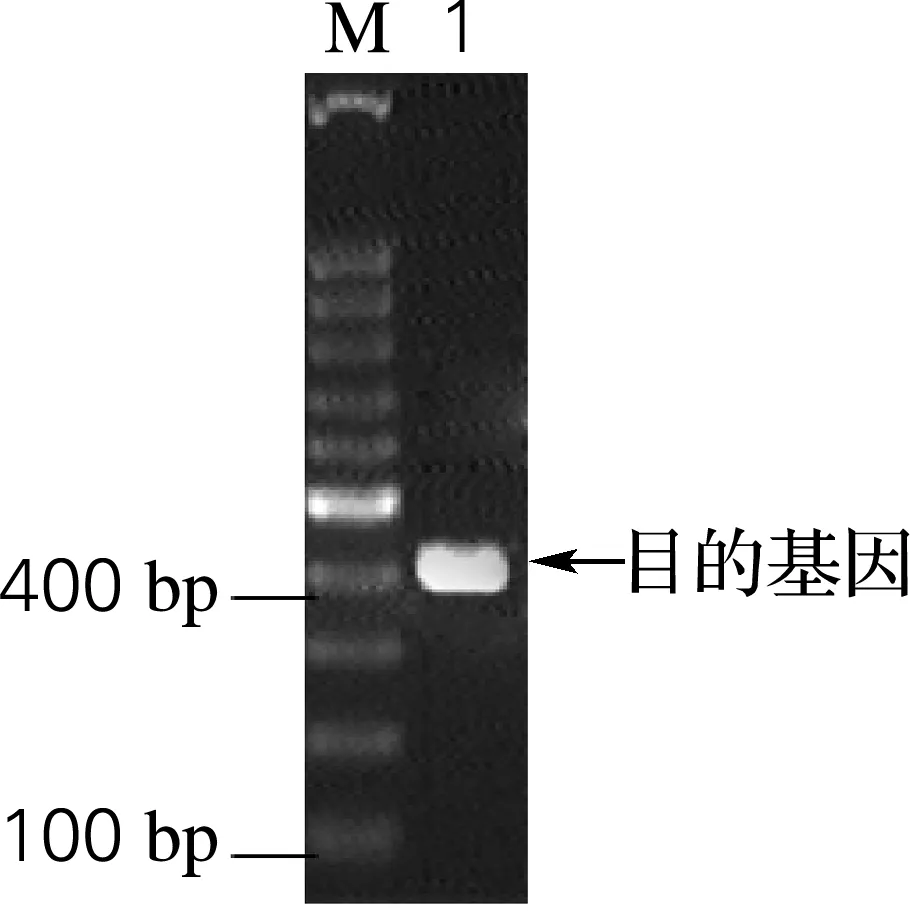
M, 100 bp DNA ladder marker; 1, amplification of SL
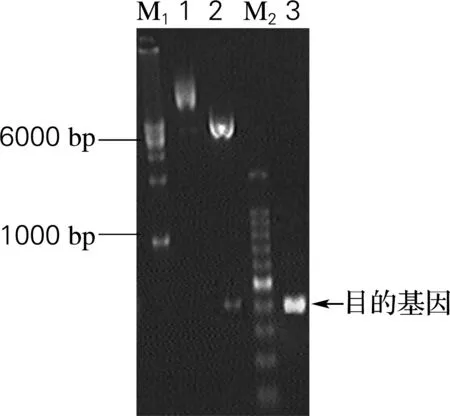
M1, 1 000 bp DNA ladder marker; 1, pET32a(+)-SL;2, digested product by NcoⅠand EcoRⅠ;M2, 100 bp DNA ladder marker; 3, colony PCR product
图2 重组质粒pET32a(+)-SL酶切及菌落PCR鉴定
Fig.2 Identification of recombinant plasmid pET32a(+)-SL
2.2 重组SL蛋白在大肠杆菌中的诱导表达和纯化
将重组表达质粒pET-32a(+)-SL,转化至E.coliRosetta(DE3)pLysS中,利用IPTG进行诱导表达。经15% SDS-PAGE分析结果(图3)显示,诱导后的样品比诱导前样品在约31 ku明显多出1条特异性条带,经过生物学软件分析,SL基因编码125个氨基酸,分子质量为14.14 ku,此外,载体上融合表达的His-Tag标签等序列的分子质量为17.42 ku左右,因此重组蛋白SL的分子质量应为31.56 ku,与实际值基本一致。经Bandscan 5.0的分析,重组蛋白SL表达量约占总菌体蛋白的48%,这说明海参溶菌酶SL在大肠杆菌中能够高效表达。再将该诱导表达后的发酵液离心收集菌体,用超声破碎细胞,破碎后的上清液和沉淀分别经SDS-PAGE检测,经分析SL在上清液中约占重组蛋白总量的10%,表明重组SL蛋白以部分可溶性蛋白的形式表达(图3)。
2.3 重组SL蛋白的Western blotting分析
经过Western blotting鉴定后发现,重组SL蛋白在31 ku左右可以与Penta-His Antibody发生特异性的结合(图4),证明该重组SL在大肠杆菌中得到正确表达。
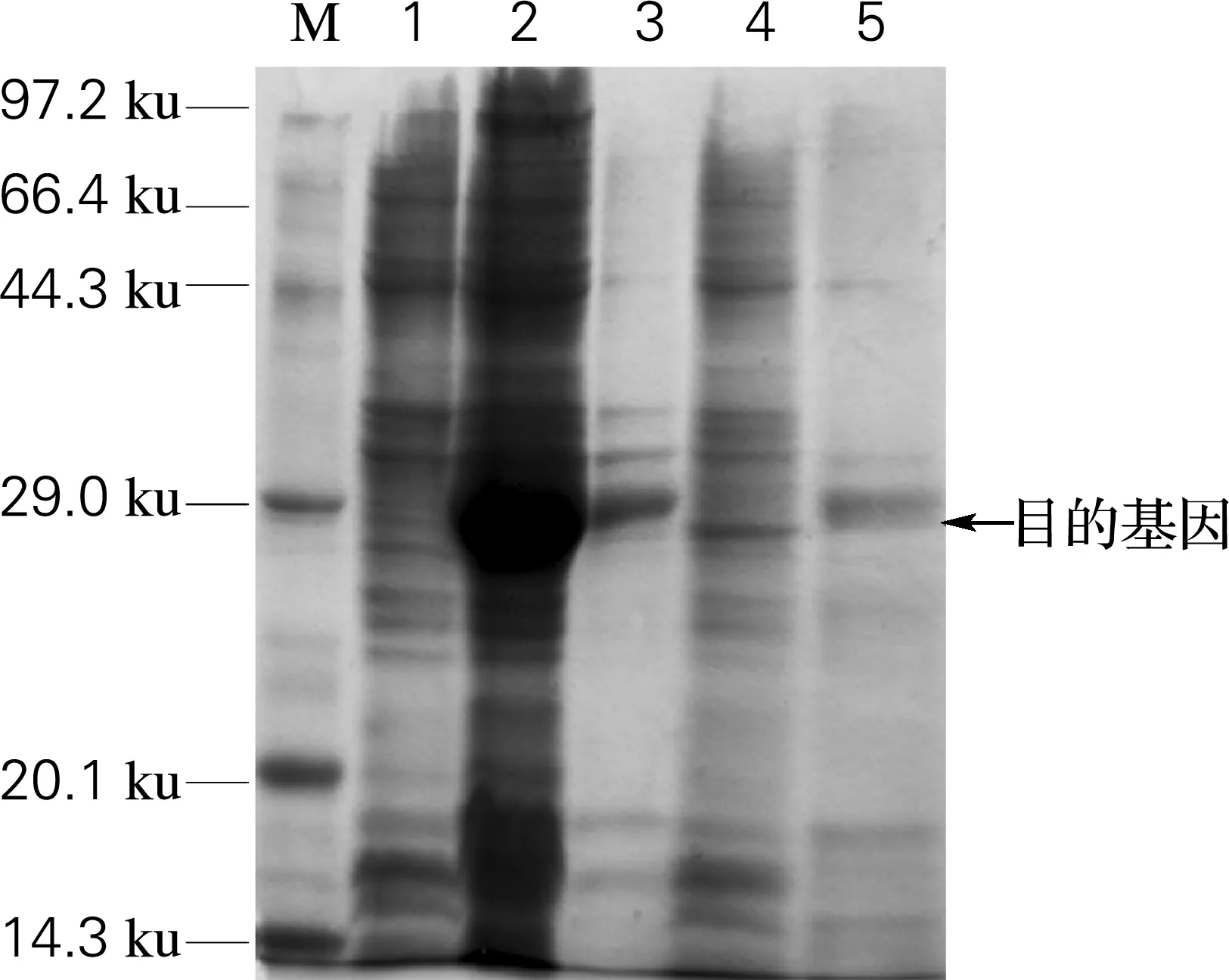
M, standard protein; 1, the non-induced strain;2, the same strain induced by IPTG for 15 h;3, the supernatant of the strain by ultrasonication;4, the precipitation of the strain by ultrasonication;5, purified SL by Ni2+-NTA affinity chromatography
图3 重组SL的表达与纯化的SDS-PAGE检测
Fig.3 SDS-PAGE analysis of pET-32a(+)-SL/E.coliRosetta(DE3)pLysS
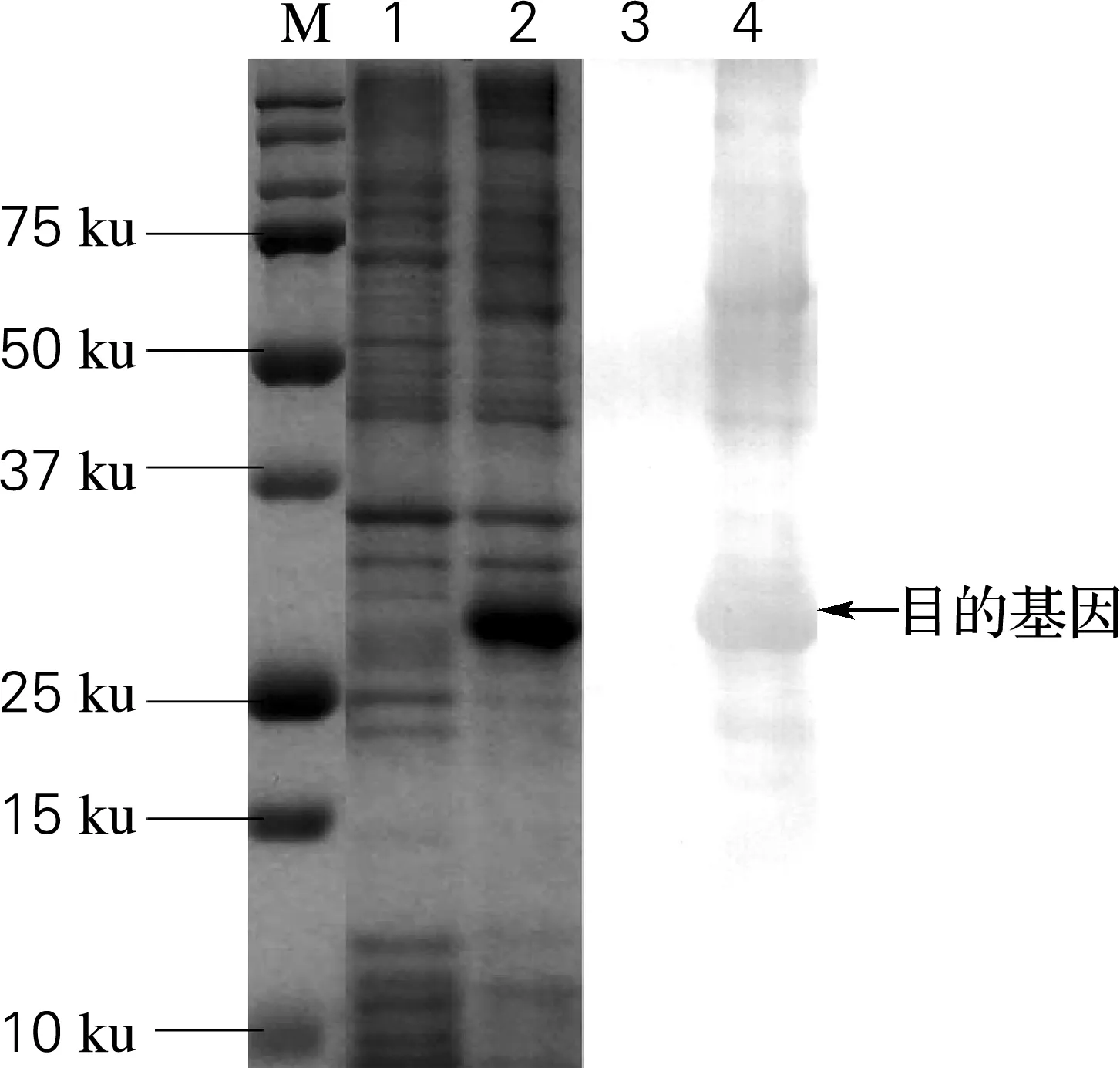
M, precision plus protein marker;1, the non-induced strain;2, the same strain induced by IPTG for 15 h;3, the non-induced strain detected by Western blotting;4, the same strain induced by IPTG for 15 h detected by Western blotting
图4 重组SL的Western blotting分析
Fig.4 The Western blotting analysis of the recombinant SL
3 讨 论
溶菌酶作为非特异性生物防御因子能对某些细菌发挥先天抵抗作用,可诱导其他免疫因子的合成和分泌[7]。溶菌酶这类先天性免疫中重要的生物防御效应器,在水产动物抵抗病原微生物感染中具有重要作用。因此,利用基因工程菌的方法生产溶菌酶可以有效地缓解病原微生物对水产养殖的危害。
本研究通过设计海参i-型溶菌酶的成熟肽基因SL,构建了基因工程菌pET32a(+)-SL/E.coliRosetta(DE3)pLysS。重组蛋白SL主要以包涵体的形式存在,只有约10%的可溶性蛋白。研究证明,蛋白质的可溶性与温度有关,适当的低温有利于蛋白质的正确折叠,从而生成可溶性蛋白[8]。唐金宝等[9]在培养基中加入质量分数至1%的Triton X-100及1%甘氨酸,可使ProZZ-EGFP基因在培养液中的可溶性表达量提高6倍。因此,可以调节培养基组成、诱导温度、时间以及通氧量等因素来增加重组蛋白的可溶性。
通过优化该工程菌的发酵培养条件,将有望实现海参溶菌酶的可溶性高效表达,可为对海参溶菌酶的空间结构及酶学性质的分析奠定基础。
[1] 李鹤,马力,王维香. 溶菌酶的研究现状[J]. 食品研究与开发, 2008, 29(1):182-185.
[3] BULET P, HETRU C, DIMARCQ JL, et al. Antimicrobial peptides in insects; structure and function[J]. Developmental and Comparative Immunology, 1999, 23(4/5):329-344.
[4] HIKIMA S, HIKIMA J, ROJTINNAKORN J, et al. Characterization and function of kuruma shrimp lysozyme possessing lytic activity againstVibriospecies[J]. Gene, 2003, 316:187-195.
[5] 王丹,丛丽娜,谢三群,等. 重组海参溶菌酶工程菌发酵及表达产物纯化和性质的研究[J]. 生物技术通报, 2011(6):187-192.
[6] 奥斯伯 F M,金斯顿 R E,赛德曼 J G. 精编分子生物学实验指南[M]. 4版. 北京:科学出版社, 2005:55-56.
[7] BOMAN H G, FAYE I, GUDMUNDSSON G H, et al. Cell-free immunity inCecropia.:A model system for antibacterial proteins[J]. European Journal of Biochemistry, 1991, 201(1):23-31.
[8] CAO H, PREISS J. Site-directed mutagenesis evidence for arginine-384 residue at the active site of maize branching enzyme Ⅱ[J]. Journal of Protein Chemistry, 1999, 18(3):379-386.
[9] 唐金宝,李万忠,吉爱国,等. ProZZ-EGFP融合蛋白基因在大肠杆菌中分泌表达条件的优化[J]. 中国生化药物杂志, 2007, 28(1):37-39.
