营养调控胃肠道屏障
2012-09-22AdamMoeser
Adam Moeser

肠道紊乱是导致猪死亡和生产性能低下的一个主要因素。因此,对猪胃肠道健康及其影响因素的基本认识是研发猪最适肠道健康对策的一个关键。本文主要讨论肠道在肠腔中形成一道对病菌不可渗透屏障,同时又能最有效地消化和吸收水及营养物质的机理。文章详细阐述肠道防御的具体方面和影响胃肠道屏障完整性的因素,论述了养猪生产过程中影响肠道健康的因素和调控肠道健康及防御功能的有效措施。
1 肠黏膜:基本功能和解剖学结构
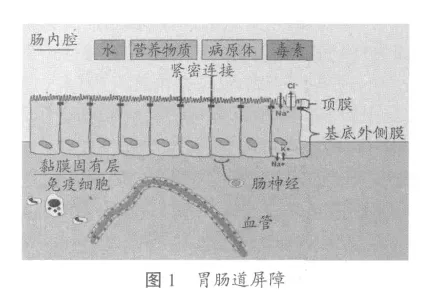
肠道表面积大于300 m2,是外界环境与机体的最大接触面。肠黏膜上皮细胞持续暴露在肠腔的恶劣环境中,包括病原微生物、毒素、酶和食物性抗原。因此,上皮组织必须提供一个选择性屏障,既能防止肠腔内病原和抗原穿过上皮细胞进入相关组织和体循环,同时又能促进肠腔营养物质的有效消化、吸收以及机体每天需要的大量水的吸收。为了完成这两个不同的角色,肠道上皮是极化的,这意味着肠上皮被位于毗连上皮细胞的侧膜顶部紧密连接分为顶端和基底外侧两部分(见图1)。顶膜和上皮组织间的紧密连接形成的连续密封作为屏障。极化使得细胞区分离子转运蛋白,构成细胞间吸收和分泌的电解质梯度。例如,Na+-K+ATP酶转运通道位于肠上皮细胞膜的基底外侧,产生细胞间电位提供能量使其他离子进出细胞。Na+-K+ATP酶保持细胞内Na+浓度相对较低(细胞间Na+浓度15 mEq vs血浆Na+浓度150 mEq),可优先允许Na+通过顶膜上的大量载体进入细胞。因此,这些顶部的载体(包括与Na+配对的糖和氨基酸的载体)利用由Na+-K+ATP酶构成电化学梯度。正是这种转运活动使细胞间能量推动营养物质的吸收。
进一步从解剖学上看,黏膜由腺体隐窝和绒毛(在小肠中)或进入隐窝的表面上皮细胞(在结肠中)组成(见图2)。隐窝-绒毛轴将上皮划分为分泌上皮和吸收上皮。这些具有相反功能的上皮细胞由位于隐窝中的干细胞分化而来。新形成的上皮细胞沿着隐窝-绒毛轴移动,逐渐成熟和分化出不同功能,直到形成约5 d后最终从绒毛顶端脱落。潘氏细胞停留在隐窝底部,不参与细胞向黏膜表面迁移的过程。总的来说,隐窝中不成熟的上皮细胞主要发挥分泌功能,而黏膜表面较成熟的上皮细胞主要发挥吸收功能。这对于许多腹泻疾病是很重要的,上皮表面受损,电解质和液体吸收紊乱,隐窝持续分泌往往会由于毒素或炎症刺激而加剧。
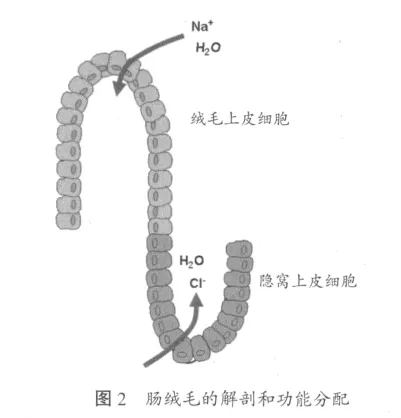
结肠的功能结构相似,包括干细胞和未成熟上皮细胞在隐窝中的位置和成熟细胞逐渐迁移出隐窝。然而,结肠中没有绒毛,而有简单的隐窝间表面上皮细胞,可发挥与小肠类似的吸收功能。另外,结肠中载体的排列不同,因为在大多数物种中,结肠是液体和电解质吸收的主要场所,因为结肠上皮表面缺乏绒毛的结构似乎是结肠的一个缺陷,但结肠能补偿隐窝中的液体流失,说明其吸收液体的功能不受绒毛缺乏的影响。这部分归功于整个胃肠道内都存在的上皮微绒毛,提高了胃肠道吸收能力。此外,由于结肠中紧密连接组织的排列更密集,与小肠上皮相比,结肠上皮不易通透,表明结肠吸收后液体回流到肠腔也更少。
在胃肠道正常和病理过程,超微上皮组分例如小肠神经系统(ENS)和免疫细胞负责调节物质分泌与吸收。ENS是由许多神经细胞构成的一个网状结构,在小肠离子转运过程中起主导作用。ENS主要由两大神经丛组成:肠肌层神经丛(两层肌肉层之间)和黏膜下层神经丛,两者相互连接又各自对运动和感觉神经输入信号起调节的作用。ENS能够接收来自中枢神经系统通过自发网状系统的交感和副交感分支发出的中枢输入信号。ENS的化学介质包括许多神经递质,其中由肠神经释放出的乙酰胆碱和血管活性肠肽是刺激上皮细胞分泌的主要神经递质。由神经释放出的去甲肾上腺素是在肠细胞和神经中通过激活α-2受体而具有前吸收效应的主要神经递质。这种介质主要起抑制神经效应的作用。ENS被许多毒素、内分泌物和炎症介质活化,导致肠分泌增加,从而引起动物腹泻性疾病。ENS的活化刺激肠道分泌的其中一个重要的机制是通过局部神经反射弧来实现的。反射弧包括感觉神经、传递给运动神经的中枢神经和主要为血管活性肠肽和拟胆碱药的运动神经。肠黏膜中的感受神经被细菌毒素、受感染上皮细胞的产物或者炎症因子刺激从而通过传入神经-中间神经元-分泌神经反射弧进行调节。一些细菌和病毒毒素类(例如艰难梭菌毒素A、轮状病毒肠毒素NSP4)刺激分泌神经反射弧分泌液体引起腹泻性疾病[1]。另一极其重要的肠黏膜组成部分是具有应答微生物和毒素入侵的免疫细胞。以先天性免疫为例,主细胞群通常由处于黏膜固有层中的嗜中性粒细胞组成,同时也可快速侵润到各循环系统。一旦上皮细胞损伤和被微生物激活,嗜中性粒细胞就向上皮细胞移动而最终跨过紧密连接之间的上皮单层细胞。快速地把有机体和毒素吞噬掉对宿主是有益的,但也可能因为胃肠道组织损伤而对宿主有害,因为嗜中性粒细胞在吞噬毒素的同时也可能释放出反应性氧化代谢产物介质引起机体过度反应,以及在迁移穿过黏膜过程中造成上皮细胞损伤。肥大细胞同样存在于上皮细胞下层和黏膜固有层组织中,起到第一道上皮防御屏障的作用。肥大细胞位于肠神经元、血管和上皮细胞邻近位置,当被激活时会释放大量的包含组胺、前列腺素、5-羟色胺(5HT)和蛋白酶等引起腹泻性疾病的分泌型和促炎症介质。
适应性免疫应答是通过抗原呈递细胞将抗原传递给存在于黏膜固有层中的淋巴细胞群来实现。此过程相关的细胞是位于上皮细胞中的M细胞,所起作用是处理和呈递抗原给淋巴细胞,尤其是呈递到位于回肠肠系膜对缘黏膜下层的派尔集合淋巴结处。这个过程则引起特异性抗原尤其是对微生物或其毒素产物的亚急性应答反应。亚急性应答进一步诱导细胞免疫应答,从而取代先天性免疫应答。
2 肠道黏膜防御:胃肠道屏障组成部分
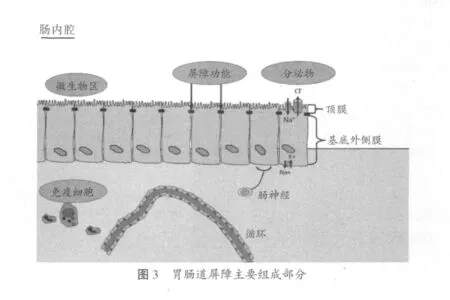
肠道屏障被分为三个主要的组成部分:①外层屏障:包括生理生化屏障,比如黏液碳酸氢盐层,能分泌抗菌肽和分泌型IgA,是微生物与机体的共生区域;②内层屏障:由肠上皮细胞紧密连接形成,主要调节肠道上皮组织屏障功能(通透性);③免疫屏障:聚集很多的淋巴组织,比如派尔集合淋巴结和上皮细胞相关的淋巴结,这些淋巴结能产生免疫诱导,能不停地获取肠道中的抗原物质,并呈递给免疫系统,建立免疫耐受(见图3)。免疫屏障内还包括先天性免疫细胞,比如嗜中性粒细胞、肥大细胞和巨噬细胞,这些先天性的免疫细胞存在于免疫屏障的深层组织,当被激活后能迅速地侵润到各组织。
3 肠道屏障功能损伤的后果
肠道上皮细胞之间的紧密连接对建立和维持肠道抵抗性的屏障有很大作用,这个肠道屏障能限制大分子物质(抗原、毒素等)随意地穿过上皮细胞进入肠道浆膜。当肠上皮细胞之间的连接被损坏后,肠上皮组织的通透性就会增大。此时,肠道中的微生物、毒素和抗原物质就能进入肠上皮下的组织,从而引起固有层组织中的炎症反应。更为严重的是,一旦肠上皮屏障被突破后,这些病原物质就能随意地进入机体的循环系统,造成败血症和多种器官疾病。肠道屏障的损伤还能使猪易于发生肠道疾病。比如,引起猪水肿病的大肠杆菌F18需要通透性高的肠道上皮细胞,以便于它产生的毒素(2e等)能进入浆膜,从而引起肠道疾病[2]。
4 影响猪肠道屏障完整性的因子
在养猪生产过程中,有很多因素能调节肠道屏障功能的健康,这些因素包括营养、传染病和应激。
4.1 营养
已有研究表明,饲料原料和肠道营养素能通过不同的机制影响黏膜屏障功能。但是,营养素对猪黏膜屏障特性影响的研究相对还比较少。最近,美国北卡罗来纳州立大学进行了特定的日粮因素影响断奶仔猪肠道屏障功能的研究。其中一项是研究日粮中添加不同Fe水平对断奶后仔猪肠道屏障功能的影响[3],结果表明,高Fe(500 mg/kg)日粮能引起炎症反应、黏膜损伤和增加肠上皮细胞通透性;而低Fe(50 mg/kg)日粮能使断奶仔猪肠道屏障发生与高Fe相似损伤,说明要维持猪肠道屏障的健康需要日粮中添加适量的Fe水平。另一项研究表明,喷雾干燥猪血浆添加到断奶仔猪日粮能改善仔猪肠道屏障功能和抑制肠道炎症反应[4]。还有其他一些日粮因子对调控肠道屏障健康起着很重要的作用,但他们对肠道屏障功能的调控机制并不被人熟知。比如,那些能显著改变肠道微生物的饲料成分(抗生素、益生素和益生元)能改变肠道屏障功能,他们是通过直接影响肠道上皮细胞(稳定紧密连接,病原菌的竞争性排斥等)和调控肠道免疫系统来实现对肠道屏障功能的调控的。现在,大家都将注意力放在研究不同益生素在日粮中的添加对猪肠道健康的改善效果,但是研究结果并不一致。Roselli等进行的猪肠细胞体外培养实验表明,乳酸菌sobrius能保护上皮细胞的紧密连接不受产毒性大肠杆菌的破坏[5]。其余有潜力的调控猪肠道屏障功能的营养素已经开始被研究者关注,这些营养素包括特殊的氨基酸(谷氨酰胺、精氨酸)和多不饱和脂肪酸。
4.2 传染性病原体
猪某种传染性病原体通过直接和间接两种机制破坏黏膜屏障功能。进入肠道内的药物通过直接释放特异的肠毒素改变黏膜紧密连接的完整性。例如,艰难梭菌毒素A和轮状病毒肠毒素NSP4依附在紧密连接蛋白上降低其紧密性,导致肠道渗透性增加,随后黏膜固有层炎症因子被激活。鼠伤寒沙门氏菌通过嗜中性粒细胞在肠腔的紧密连接处侵润和迁移引发特定的炎症反应破坏肠道屏障,从而引起动物腹泻。一些肠道病原体可通过间接作用机制破坏肠道屏障。例如,肠毒性大肠杆菌对肠黏膜结构的直接影响机制不明确,然而毒素分泌过多和液体流失破坏肠道屏障,引起动物体液缺失和肠道黏膜血流灌注不足[6]。仔猪败血症的机制是大肠杆菌及其细菌产物被受损的肠道屏障快速吸收进入全身组织的一种延迟反应。除了这种机制外,一旦肠道屏障受损,条件致病菌引发的续发性感染进一步加剧肠道疾病。
4.3 应激
在养猪生产过程中,猪面临多种应激,通过大量的未知机制造成猪患疾病。应激反应是一种正常的生理学反应,对动物的存活起关键作用。然而,当应激因子超过动物的抵抗力时,动物易发生疾病。越来越多的科学文献证明应激对肠道屏障功能的影响。大多数啮齿类动物试验研究证明,当动物在急性或慢性应激情况下,肠道渗透性增加。美国北卡罗来纳州立大学(NC)已经开始以仔猪断奶应激模型研究应激诱导肠道疾病机制。此模型研究结果表明,断奶诱导的一系列连锁应激反应通过增加肠道的渗透性和黏膜炎症来破坏肠道屏障功能[7-8]。应激反应基本机制的研究揭示出局部应激反应介质如促肾上腺皮质激素释放因子(CRF)和肠道黏膜免疫细胞之间复杂的相互影响的作用。另外,美国北卡罗来纳州立大学(NC)试验研究发现,早期断奶仔猪(断奶日龄为15~21 d)与23~28日龄断奶仔猪相比,断奶后7周其肠道渗透性增加,由于肠道黏膜屏障功能长期受损而使仔猪易发疾病。因此,黏膜屏障发育程度可以反映出仔猪遭受应激的日龄。
[1]Moeser A J,Blikslager A T.Mechanisms of porcine diarrheal disease[J].J.Am.Vet.Med.Assoc.,2007,231:56-67.
[2]Waddell T E,Gyles C L.Sodium deoxycholate facilitates systemic absorption of verotoxin 2e from pig intestine[J].Infect.Immun.,1995,63:4953-4956.
[3]Moeser A J.Dietary Fe in Post-Weaning Swine Diets:Finding the Right Balance Between Meeting Requirements and Gastrointestinal Health[J].Swine News.North Carolina State Cooperative Extension Service Publication,2009,32(8).
[4]R.M.Peace,J.Campbell,J.Polo,et al.Spray-Dried Porcine Plasma Influences Intestinal Barrier Function,Inflammation,and Diarrhea in Weaned Pigs[J].J.Nutr.,2011,141:1312-1317.
[5]Roselli M,Finamore A,Britti M S,et al.The novel porcine Lactobacillus sobrius strain protects intestinal cells from enterotoxigenic Escherichia coli K88 infection and prevents membrane barrier damage[J].J.Nutr.,2007,137:2709-2716.
[6]Berberov E M,Zhou Y,Francis D H,et al.Relative importance of heat-labile enterotoxin in the causation of severe diarrheal disease in the gnotobiotic piglet model by a strain of enterotoxigenic Escherichia coli that produces multiple enterotoxins[J].Infect.Immun.,2004,72:3914-3924.
[7]Moeser A J,Klok C V,Ryan K A,et al.Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J].Am.J.Physiol.Gastrointest Liver Physiol.,2007,292:G173-181.
[8]Moeser A J,Ryan K A,Nighot P K,et al.Gastrointestinal dysfunction induced by early weaning is attenuated by delayed weaning and mast cell blockade in pigs[J].Am.J.Physiol.Gastrointest.Liver Physiol.,2007,293:G413-421.
