黄鳝胚胎和仔鱼发育过程中机体营养成分的变化
2012-09-22王自蕊王晓芳朱长生周秋白
王自蕊 王晓芳 朱长生 周秋白
黄鳝(Monopterus albus),又名鳝鱼、长鱼等,属合鳃目,合鳃科,黄鳝属,是我国重要的淡水经济鱼类之一,主要分布在中国、朝鲜、日本等国家。黄鳝肉质细嫩、味道鲜美、营养价值高,含肉率高达65%以上[1]。黄鳝不仅有重要的食用价值,而且还具有良好的药用价值,近年来,各地广泛开展了黄鳝的人工养殖,取得了较好的效果[2]。目前,有关黄鳝幼体的研究,大多集中在形态学方面。杨代勤等(1999)用人工授精方法对黄鳝胚胎发育和鱼苗培育进行了初步探索[3]。周秋白等(2003)首次用显微摄影记录了黄鳝的胚胎期及胚后发育的过程[4]。评估机体生长发育状况和营养代谢的更好办法则是对机体生化成分变化的测定。目前国内有不少学者对部分鱼类不同生长阶段进行了机体生化成分的测定[5-6],但在受精卵孵化期间的机体营养成分变化方面报道较少。
许多鱼类的仔鱼在由内源性营养转换为外源性营养时往往会出现大量死亡,死亡原因错综复杂,但能否及时提供适口性饵料是其中一个重要因素[7]。在鱼类胚胎发育阶段和仔鱼发育早期,营养来源于卵黄所储存的内源性物质。一般而言,鱼卵含有仔鱼在卵黄营养阶段所需的所有营养,可以在仔鱼摄食外源性营养之前,保证内环境平衡和发育[8]。不同种类鱼卵的生化组成各不相同,其主要成分(蛋白质、脂肪和碳水化合物)的消耗顺序在质和量上都有区别[9]。因此,本试验以黄鳝为对象,研究受精胚胎发育期和仔鱼期在饥饿状态下机体主要营养成分的变化,为预测幼鱼的成活率及了解其开口仔鱼对蛋白质和脂肪的需求奠定基础。
1 材料与方法
1.1 材料来源
试验所用受精卵来自江西农业大学黄鳝繁殖试验基地。受精卵置直径14.8 cm的培养皿内加曝气自然水,室温(25~30℃)静水孵化到幼鱼阶段,定期换水,未喂食。
1.2 检测指标及方法
从卵受精当天开始,每2 d(仔鱼阶段每5 d)取样1次,每次取3份样品,每份样品40粒卵(仔鱼),用于测定水分、蛋白质和脂肪等的含量。干物质和粗蛋白质的含量测定分别参照国家标准GB 6435—86(1996)和GB/T 6432—94(1996)推荐的方法测定。脂肪含量测定采用Folch提取脂质法:每份取30颗卵或仔鱼,捣碎样品后,加1 ml氯仿-甲醇(1:2)搅拌摇匀后静置24 h,用混合液润洗滤纸和漏斗并抽提2~3次,倒入试管后加氯化镁,振荡1 min后静置2~3 h,待清晰分层后移走上层甲醇,放入真空干燥箱中干燥,15 d左右,至水分蒸发完全,称重。
1.3 统计分析
试验数据以“平均值±标准误”表示,采用SPSS 13.0软件进行统计分析。统计结果的显著性水平为P<0.05。
2 结果
2.1 湿重和干重及含水量(见表1)
由表1可知,黄鳝机体湿重在胚胎发育期和仔鱼发育期变化都不显著(P>0.05),但出膜前后变化显著(P<0.05),出膜前机体湿重为29.93 mg,出膜后第1 d湿重为17.52 mg,相比出膜前湿重含量下降了41%(P<0.05)。机体干重在整个胚胎发育期差异不显著,但在出膜后第10 d开始,机体干重显著下降(P<0.05)。含水量在受精卵的整个胚胎发育阶段差异不显著,保持在83.28%~83.71%之间。但在出膜前后却有显著差异(P<0.05),出膜后含水量突然下降,之后至第10 d开始慢慢恢复到出膜前的水平。
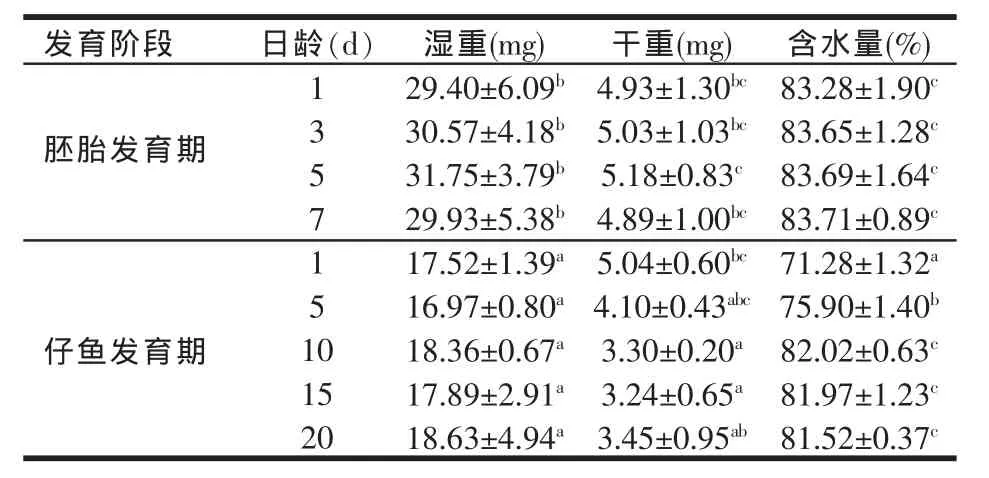
表1 黄鳝胚胎及仔鱼机体的湿重、干重和含水量
2.2 蛋白质和脂肪及占干湿重比(见表2)
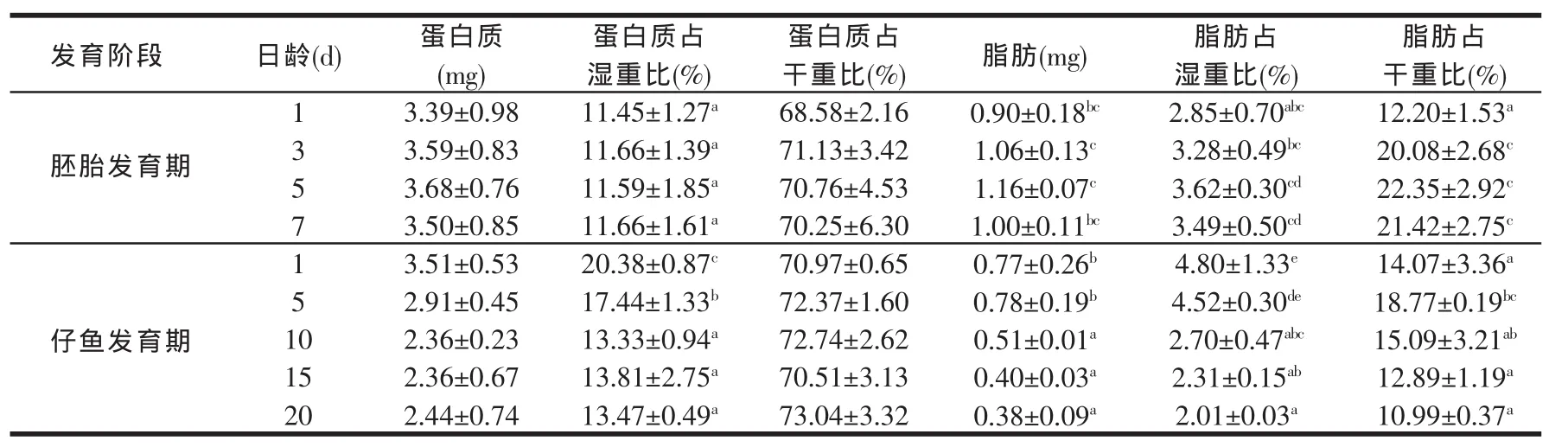
表2 黄鳝胚胎及仔鱼机体蛋白质和脂肪的含量及占湿重比
由表2可知,蛋白质的质量在黄鳝受精卵的整个发育期间差异不显著(P>0.05),但是呈下降趋势。仔鱼发育到20 d时,相比胚胎发育初期,蛋白质含量下降了28%。蛋白质占湿重的百分含量在胚胎发育期和仔鱼发育期第 10、15、20 d 之间差异都不显著(P>0.05),但与仔鱼发育期1 d和5 d相比差异显著(P<0.05),并且仔鱼发育期第1 d和第5 d之间存在显著差异(P<0.05)。
每颗卵粒蛋白质的质量在胚胎发育期为3.5 mg左右,仔鱼孵出后,蛋白质在出膜1 d时质量较大,1~10 d呈下降趋势,在出膜10 d时降到最低水平,随后保持基本稳定(P>0.05)。脂肪质量在胚胎发育期基本不变(P>0.05),仔鱼发育阶段明显下降,在出膜10 d后下降量显著高于出膜1 d仔鱼(P<0.05)。脂肪的质量在整个胚胎发育期无显著变化(P>0.05),但与仔鱼发育期第 10、15、20 d 相比存在显著差异(P<0.05)。仔鱼发育到第20 d时,相比胚胎发育初期,脂肪含量下降了57.8%。脂肪占湿重比整个脂肪发育期差异不显著,但在出膜后,脂肪占湿重比显著上升(P<0.05),之后随时间增加而呈下降趋势。而对于占湿重比例,蛋白质占湿重比和脂肪占湿重比两者在出膜时都有一迅速上升阶段。
由表2可知,蛋白质占干重的百分含量在整个发育期间差异不显著(P>0.05)。除去水分,蛋白质的变化范围很小,在胚胎发育期蛋白质占干重比从第3 d开始维持在70%左右。脂肪占干重的百分含量在胚胎发育初期含量较低,到第3 d时有明显增加(P<0.05),之后保持稳定。仔鱼发育初期,出膜1 d相比出膜前,脂肪占干重比显著下降(P<0.05),但出膜后第5 d,脂肪占干重比又明显增加(P<0.05),之后开始呈下降趋势,但差异不显著(P>0.05)。
3 讨论
卵黄囊期是鱼类早期发育中的一个重要阶段,是鱼类由内源性营养向外源性营养转化的一个关键时期[10]。从更深更广的角度来研究卵和幼体营养成分的变化,可间接了解能量转移和利用过程,这对满足幼鱼营养需求,提高其成活率有很大理论指导意义。
3.1 黄鳝胚胎发育期和仔鱼发育过程中机体水分含量的变化
黄鳝胚胎刚受精时,卵为浅黄色或橙黄色的正圆形卵,沉性,比一般鱼类的大。外层包有无色半透明的卵膜,卵黄均匀[11]。受精卵在发育阶段,水分变化不大,但在仔鱼发育期从第1 d开始,含水量急剧下降,由胚胎期第1 d的83.28%降到仔鱼出膜第1 d的71.28%,之后缓慢回升。说明仔鱼孵化过程中卵膜破裂时,卵膜细胞内非胚胎水分流出导致水分大幅减少。而仔鱼饥饿期间,细胞外间隙增加,细胞体积缩小,含水量百分比有所提高,而实际含水量下降[12]。当水产动物处于饥饿状态时,贮存于体内的脂肪被水解成甘油和游离脂肪酸,并释放入血液被运送全身各组织氧化利用。脂肪酸是机体的主要功能物质,在有氧条件下彻底氧化为水和二氧化碳,并释放大量的能量,以ATP的形式供机体利用[13]。因此,随着动物能源物质的不断消耗,动物体的含水量会逐渐上升,这也许是导致仔鱼后期含水量上升的重要因素。机体各种营养成分的变化处于动态平衡,而水分是维持机体正常新陈代谢的必要条件,所以仔鱼后期水分含量会逐渐升高直到与初始含水量相差不大。若不考虑水分的影响,蛋白质和脂肪总体上变化范围较小,说明水分在营养成分的变化过程中起主要作用。
依据鱼卵的比重和水的比重关系,可以把鱼类的卵分为浮性卵和沉性卵。殷名称(1993)指出,鱼类卵的浮性主要取决于卵(黄)内水分的含量,脂肪仅是营养物质存在的一种形式,浮性卵的含水量达90%~92%,而典型沉性卵含水量为60%~75%[14]。由本试验可知,黄鳝受精卵的含水量在整个发育期间保持在83.28%~83.71%,介于典型沉性卵和浮性卵之间。
3.2 黄鳝胚胎发育期和仔鱼发育过程中机体蛋白质和脂肪含量的变化
黄鳝胚胎发育期的蛋白质含量有不同程度的上升,这可归因于胚胎发育期随着卵裂的进行,细胞数目增多,组成各个细胞的细胞膜的脂肪和蛋白质的含量也相应增加[14]。熊传喜(1995)对建鲤胚胎和仔鱼机体蛋白质和脂肪含量的测定结果显示,受精卵发育阶段,蛋白质呈现明显下降趋势,而脂肪含量基本不变;仔鱼发育初期,脂肪和蛋白质含量均下降[5]。但本试验测定发现,胚胎发育期蛋白质和脂肪含量无显著变化。但仔鱼孵出后,蛋白质和脂肪含量都有不同程度的下降,仔鱼发育到20 d时,蛋白质和脂肪含量相比胚胎发育初期分别下降了28%和57.8%。在初孵仔鱼阶段,蛋白质和脂肪占湿重比均呈现下降趋势,但蛋白质含量占干重比上升,脂肪占干重比下降;仔鱼发育期5 d之后(卵黄囊消失)蛋白质质量保持稳定,脂肪质量呈下降趋势。试验还发现仔鱼发育期间,脂肪和蛋白质均消耗很大,这可能是由于仔鱼发育过程中生命活动和运动的能量消耗。脂肪和蛋白质的这种变化规律以及它们间的能量代谢,提示在投喂开口仔鱼时,应考虑饵料中蛋白质和脂肪的含量是否充足,以满足仔鱼正常生长发育的需要。
[1]曹克驹.名特水产动物养殖学[M].北京:中国农业出版社,2007:200.
[2]王武主编.鱼类增养殖学[M].北京:中国农业出版社,2000:516.
[3]杨代勤,陈芳,李道霞,等.黄鳝的胚胎发育及鱼苗培育[J].湖北农学院学报,1999,19(2):149-152.
[4]周秋白,吴华东,吴红翔,等.黄鳝的胚胎及胚后发育[J].水产学报,2003,27(6):505-512.
[5]熊传喜,谢从新,黎会平,等.建鲤卵和仔鱼发育阶段生化成分的变化[J].华中农业大学学报,1995,14(2):180-186.
[6]范海霞,吴志强,胡茂林.鄱阳湖不同生长阶段短颌鲚生化成分和能量的变化[J].水产科学,2011,2(2):91-93.
[7]朱成德.仔鱼的开口摄食期及其饵料综述[J].水生生物学报,1986,10(1):86-95.
[8]Mourente G,Vzquez R.Changes in the content of total lipid,lipid classes and their fatty acids of developing eggs and unfed larvae of the Senegal sole,Solea senegalensis Kaup [J].Fish Physiol.Biocheml.,1996,15:221-235.
[9]Sargent J R,Henderson R J,Tocher D R.The lipids[M]//Halver J E.Fish Nutrition(Eds1).New York:Academic Press,1989:153-218.
[10]张传骞,朱鑫华.海洋硬骨鱼类卵黄囊期生物能学研究[J].海洋科学集刊,2002,44:180-186.
[11]韩名竹,白利平,史扬白,等.黄鳝胚胎发育的初步研究[J].淡水渔业,1988(4):7-9.
[12]Ehrich K F.Chemical changes during growth and sarvation of Herring larve[J]//Blaxter J H S eds.The early life history of fish,Berlin:Spring-Verlag,1974:301-323.
[13]王金胜主编.基础生物化学[M].北京:中国林业出版社,2007:360-362.
[14]殷名称,S.M.哈维,J.C.A.凯克.江鲽在卵和卵黄囊期仔鱼发育阶段生化成分的变化[J].动物学报,1993,39(3):272-279.
