衰老大鼠睾丸组织SOD、MDA和血清睾酮含量的变化
2012-09-21宫铁红付淑华牛嗣云高福禄河北医科大学基础医学院河北石家庄05007承德市第五医院妇产科河北大学基础医学院承德县医院
宫铁红,付淑华,牛嗣云,高福禄△,李 然(.河北医科大学基础医学院,河北石家庄 05007;.承德市第五医院妇产科;.河北大学基础医学院;.承德县医院)
衰老是指在正常状况下生物体发育成熟后,随年龄增加自身机能减退,内环境稳定能力与应激能力下降,结构、组分逐步退行性变不可逆转的现象[1]。随着年龄的增长,睾丸亦呈现退行性变,如间质细胞数目减少、功能不足等。睾酮由睾丸间质细胞分泌,是体内最主要的雄激素,可促进精子发生和雄性生殖器官的发育,维持雄性第二性征。临床上常用睾酮水平判断睾丸的生精功能;超氧化物歧化酶(SOD)和丙二醛(MDA)是反应机体抗氧化能力的重要指标。本研究通过检测衰老大鼠睾丸组织SOD、MDA和血清睾酮含量的变化,观察衰老大鼠模型睾丸的衰老变化情况,进一步探讨机体衰老的机制及变化。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及分组:选用SPF级8周龄雄性SD大鼠20只(合格证号:1005050),随机分为正常组和D-半乳糖致衰组(模型组),每组10只大鼠;18月龄自然衰老雄性SD大鼠10只(自然衰老组,合格证号:1112043),均由河北医科大学实验动物中心提供。
1.1.2 主要试剂:D-半乳糖(批号:0914B70),北京化学试剂公司;SOD、MDA试剂盒,南京建成生物工程研究所;睾酮放免试剂盒,北京北方生物技术研究所。
1.2 实验方法
1.2.1 衰老动物模型的建立:模型组大鼠以6% D-半乳糖(300mg/kg/d,60d)连续腹腔注射建立亚急性衰老动物模型;正常组和自然衰老组大鼠腹腔注射等量生理盐水,时间同模型组。
1.2.2 血清睾酮含量的测定:大鼠10%水合氯醛腹腔注射麻醉,经内眦于眶后静脉取血约1.5ml,离心取血清,采用放射免疫法检测血清睾酮含量。
1.2.3 SOD、MDA含量的测定:大鼠取血后断头处死,每只大鼠取单侧新鲜等体积的部分睾丸组织(约100mg),用滤纸吸干水分后迅速冰浴,加入预冷的生理盐水制备成10%的组织匀浆,3000rpm/min离心15min,取匀浆上清,再用预冷生理盐水稀释成所需浓度。严格按照试剂盒说明书操作,用酶标仪测定睾丸组织蛋白的含量及SOD、MDA含量。
2 结果
与正常组大鼠比较,模型组和自然衰老组大鼠血清睾酮含量、睾丸组织SOD含量明显降低,睾丸组织MDA含量明显升高,差异均具有统计学意义(P<0.01);三个指标模型组和自然衰老组比较,差异无统计学意义(P>0.05)。见附表。
附表 各组大鼠血清睾酮含量和睾丸组织SOD、MDA含量(±s,n=10)
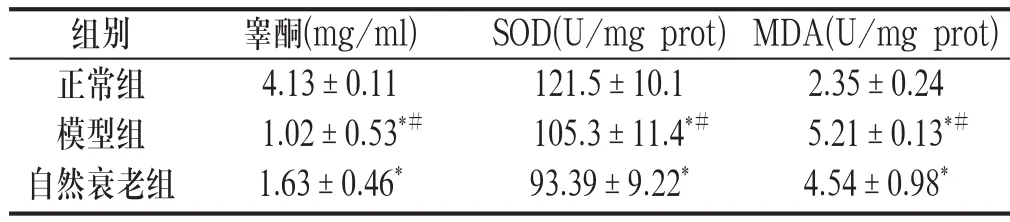
附表 各组大鼠血清睾酮含量和睾丸组织SOD、MDA含量(±s,n=10)
与正常组比较:*P<0.01,与自然衰老组比较:#P>0.05
组别 睾酮(mg/ml) SOD(U/mg prot) MDA(U/mg prot)正常组 4.13±0.11 121.5±10.1 2.35±0.24模型组 1.02±0.53*# 105.3±11.4*# 5.21±0.13*#自然衰老组 1.63±0.46* 93.39±9.22* 4.54±0.98*
3 讨论
自由基是人体正常的代谢产物,正常情况下人体内的自由基处于不断产生与消除的动态平衡。但随着年龄的增长,机体抗氧化防御物质合成和活性下降,清除自由基能力降低,机体产生和清除自由基的平衡被破坏自由基累积增多,清除率下降,损伤生物膜,造成组织损伤和器官退行性变化[2]。Inal[3]的研究也证实,SOD活性下降与衰老密切相关。氧在代谢过程中产生的多种性质活泼的自由基能使生物膜发生脂质过氧化,最终可以分解产生MDA,MDA可以引发多种生化毒性反应,造成机体衰老和多种疾病。
睾丸间质细胞分泌的睾酮可与生精细胞的雄激素受体结合,促进精子发生;睾酮也可以促进精母细胞转化为精子细胞,Nayemia等[4]发现粗线期精母细胞和减数分裂均依赖于睾酮的存在;Henkel等[5]发现,附睾精子成熟和精子活动力的诱导均需要有生物活性的睾酮的作用。因此,血清睾酮水平能很好的反应睾丸的功能。本研究发现,与正常组大鼠比较,自然衰老大鼠和D-半乳糖致衰大鼠血清睾酮含量明显降低,睾丸组织SOD含量显著降低、MDA含量显著升高,而自然衰老大鼠与D-半乳糖致衰大鼠比较无显著差异。因此表明,衰老大鼠睾丸抗氧化能力明显降低,睾丸间质细胞分泌睾酮的功能发生障碍,且D-半乳糖致衰老模型是自然衰老的很好再现。
[1]邹承鲁.当代生物学[M].北京:中国致公出版社,2000.394-396.
[2]Vihra BP, Sharma SP, Kansal VK. Age-dependent variation in mitochondrial and cytosolic antioxidant enzymes and lipi peroxidation in different regions of central nervous system o guinea pigs[J]. Indian J Biochem Biophys, 2001, 38(5):321-326.
[3]Inal ME, Kanbak G, Sunal E. Antioxidant enzyme activities and malondialdehyde levels related to aging [J]. Clin Chim Acta,2001, 305(1-2):75-78.
[4]Nayernia K, Vauti F, Meinhardt A, et al. Inactivation of a testis-specific Lis1 transcript in mice prevents spermatid differentiation and causes male infertility[J]. J Biol Chem, 2003,278(48): 48377-48385.
[5]Henkel R, Maass G, Schuppe HC, et al. Molecular aspects of declining sperm motility in older men[J]. Fertil Steril, 2005,84(5):1430-1437.
