心脉隆胶囊对原代大鼠血管平滑肌细胞形态损伤的保护作用
2012-09-19吴建新
肖 芬,吴建新
(大理学院药学与化学学院,云南大理 671000)
动脉粥样硬化(atherosclerosis,AS)是以血管平滑肌细胞 ( vascular smooth muscle cells,VSMCs) 增生和脂质沉积为特征的严重危害人类健康的疾病。随着现代科学技术的快速发展,已发现血管平滑肌的增殖与凋亡在AS形成过程中起核心作用,异常增殖的VSMCs,往往在形态上会发生明显的改变,如肌丝成分减少,以收缩为主变为以增殖为主,血管壁增厚〔1-2〕。而关于AS形成中的氧化学说,已越来越引起人们的重视,过氧化氢(peroxide hydrogen,H2O2)作为外源性氧自由基的来源,已被广泛地应用于体外氧化应激实验〔3〕。有研究表明,中药在防止或延缓AS的发生、发展中起到重要作用〔4〕。心脉隆胶囊(XMLJ)是从昆虫美洲大蠊中提取的一种新型核苷类化合物,对心血管系统具有一定作用〔5〕,但目前未见XMLJ对VSMCs形态损伤保护作用的疗效报道。本实验旨在用组织贴块法对原代VSMCs进行体外培养,建立VSMCs氧化应激损伤模型,研究XMLJ对VSMCs形态损伤的治疗效果,为今后临床治疗AS提供可靠的理论依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 DMEM/F12(Hycolone公司),无支原体胎牛血清(浙江天航生物科技有限公司),LGlntamine( BIOSHARP生产),心脉隆胶囊( 云南腾冲制药厂提供,试验用200 μg·mL-1心脉隆胶囊溶液用无血清培养基稀释),H2O2(试验用62.5 μmol·L-1H2O2用生理盐水稀释),其他试剂均为国产分析纯或进口分装。
1.1.2 仪器 CO2培养箱(珠海市造鑫企业有限公司),智能型生物安全柜(上海智城分析仪器制造有限公司),倒置相差显微镜(日本尼康公司),细胞专用磨砂玻片(北京)。
1.1.3 主动脉 VSMCs培养主动脉VSMCs的原代培养采用组织贴块法〔6〕进行。选用重量为180 g左右的雄性SD大鼠,用3%戊巴比妥钠腹腔注射麻醉,用酒精将大鼠全身擦拭消毒15 min,切开胸腹腔,无菌条件下分离全段主动脉,立刻放入含200 U·mL-1双抗的D-Hank’s液中,用PBS漂洗2次,用弯镊在含DHank’s液的培养皿中钝性分离得到中膜,将中膜用手术刀切成1 mm×1 mm大小的组织块,将切好的组织块贴置50 mL的玻璃细胞培养瓶内,组织块间距0.5 cm,培养瓶内加入2 mL含20%胎牛血清的DMEM/F12培养基,放入5%CO2的37℃的培养箱中,6 h后待组织块牢固贴附于细胞瓶壁,再轻轻翻转培养瓶,使组织块完全浸没于培养液中,放入培养箱中继续培养。细胞接种9 d后,可见组织块从组织边缘爬出,当单层细胞铺满近培养瓶底的80%以上时即可进行传代。实验所用的VSMCs为第五代。
1.2 方法
1.2.1 分组、细胞爬片 取第五代200 mL的VSMCs培养瓶1瓶,胰酶消化,离心,细胞重悬,细胞计数为1×105·mL-1,将细胞分为3组,正常组( 含血清培养基+不含血清培养基+生理盐水)、干预组(含血清培养基+不含血清培养基+62.5 μmol·L-1H2O2)、保护组( 含血清培养基+200 μg·mL-1XMLJ+62.5 μmol·L-1H2O2),每组6片爬片,每块爬片放入1 mL的细胞悬液,置60 mm培养皿中培养,4 h后在培养皿中加入6 mL含血清的DMEM/F12培养基,观察待细胞铺满爬片后,正常组和干预组加入6 mL不含血清的DMEM/F12培养基, 保护组加入6 mL200 μg·mL-1的XMLJ,24 h后正常组加入6 mL生理盐水,干预组和保护组各加入6 mL 62.5 μmol·L-1H2O2,均继续培养24 h。
1.2.2 HE染色 将细胞爬片从培养皿中取出,用PBS冲洗2遍,再用95%乙醇固定,进行HE染色,其中苏木素染色15 min,伊红染色5 min,酒精、二甲苯各洗脱3次。
1.2.3 倒置相差显微镜下及光镜下观察 对原代VSMCs的细胞形态观察并进行拍照。将HE染色的爬片在光镜下拍摄细胞形态。
2 结果
2.1 VSMCs原代培养 细胞接种9 d后,可见培养瓶底少数细胞自组织块周围游离出来(图1),14 d后细胞生长迅速,呈典型的峰、谷样生长,细胞形体多呈长梭形,核大,可见明显的肌丝纤维(图2)。
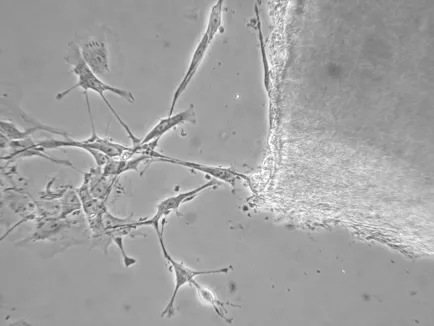
图1 VSMCs从组织块游离( ×100)
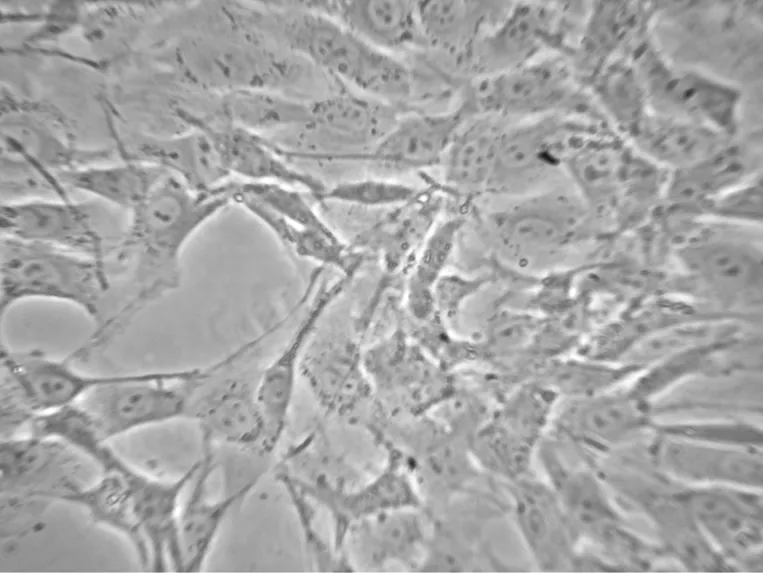
图2 原代VSMCs( ×200)
2.2 HE染色 正常组VSMCs( 图3),胞浆丰富,胞质密度高;干预组VSMCs(图4),细胞连接紧密,核细胞质浓密皱缩,肌丝成分减少;保护组VSMCs(图5),脂质胞浆皱缩程度明显减轻,细胞核增大,细胞形态较接近于正常组细胞。
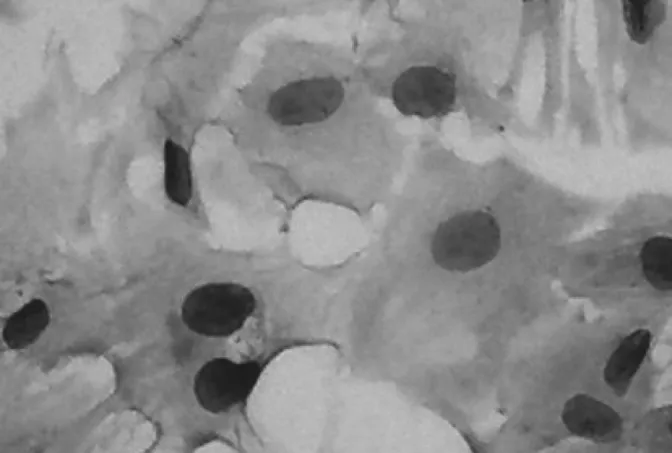
图3 正常组VSMCs( ×400)
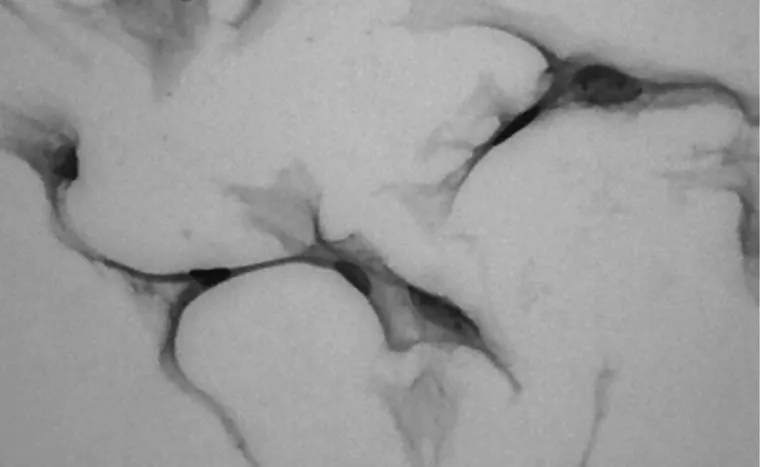
图4 干预组VSMCs( ×400)
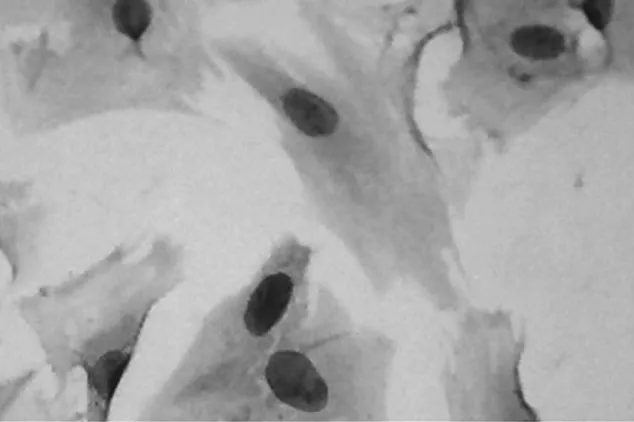
图5 保护组VSMCs( ×400)
3 讨论
原代培养VSMCs主要有两种方法:酶消化培养法和组织贴块法。采用胶原酶消化培养法所需组织量较大,而且胶原酶价格昂贵,实验成本较高,另外,酶消化法本身对细胞有毒性作用;采用组织块贴块法培养大鼠VSMCs更为简便、经济、有效〔7〕。原代细胞从组织块游离出来的时间常因为不同实验室条件、组织块多少等因素而有所不同。实验中,原代细胞在培养第9 d游离出来,之后瓶内的每块组织块均有VSMCs游离生长出来,由于VSMCs中混有部分成纤维细胞,实验VSMCs是通过差时贴壁法纯化的VSMCs。
AS的发生与多种因素有关,目前认为氧化应激、炎症是AS发生和发展的核心机制〔8-9〕。氧化应激是过量的活性氧与内源性清除活性氧的抗氧化系统间失去平衡,活性氧能介导血管内皮细胞和平滑肌细胞表型调节〔10〕。正常情况下,细胞具有平衡的抗氧化机制,但当某些因素作用于细胞使这一稳态失调,活性氧产生的速率大于被清除的速率时,就会造成活性氧的蓄积,进而导致动脉血管的损伤。实验中用62.5 μmol·L-1的过氧化氢对VSMCs产生氧化应激损伤作用,发现VSMCs形态明显改变,而在200 μg·mL-1的XMLJ保护组, 氧化应激致使的细胞形态改变程度明显减轻。只有当细胞形态保持稳定,细胞本身才能发挥其平衡抗氧化机制,而这种抗氧化机制可能与基质金属蛋白酶(MMPs)被突然激活有关〔11〕,因此XMLJ对VSMCs形态损伤保护作用的分子机制有待进一步研究。
〔1〕Falk E.Pathogenesis of atherosclerosis〔J〕.J Am Coll Cardiol, 2006, 47( Suppl 8) : C7-C12.
〔2〕王效浣,李广平,郭方明.血管平滑肌细胞在动脉粥样硬化发生中的哲学思维〔J〕.基础研究与临床,2008,29( 5):70-71.
〔3〕徐菁,朱从丽,王乔,等.血管平滑肌细胞的体外氧化应激反应及雌激素的影响〔J〕.中国组织化学与细胞化学杂志,2010,19( 6):537-541.
〔4〕陈焕清,邱嘉民,韩雪娟.通心络胶囊联用松龄血脉康治疗高脂血症的疗效观察〔J〕.医药世界,2006( 11):70-71.
〔5〕陆丽,刘晓波,方春生,等.心脉隆胶囊对动物心脏的影响〔J〕.大理学院学报,2010,8( 9):1-5.
〔6〕刘晶,马坤岭,倪杰,等.动脉粥样硬化模型小鼠血管平滑肌细胞原代培养及鉴定〔J〕.东南大学学报:医学版,2011,30( 4):537-540.
〔7〕段超,陈鑫,邱志兵,等.大鼠胸主动脉血管平滑肌细胞的原代培养和鉴定〔J〕.临床肺科杂志,2010,15( 4):468-470.
〔8〕Landmesser U,Spiekermann S,Dikalov S,et al.Vascular oxidative stress and endothelial dysfunction in patients with chronic heart failure:role of xanthine-oxidase and extracellular superoxide dismutase〔J〕.Circulation, 2002,106( 24): 3073-3078.
〔9〕Cominacini L,Ulisse G,Pasini AF,et al.Antioxidants inhibit the expression of intercellular cell adhension molecule-1 and vascular cell adhension molecule-1 induced by oxidized LDL on human umbilical endothelial cells〔J〕.Free Radical Biology Medicine, 1997( 2) :271-277.
〔10〕Liu L,Wen T,Zheng X Y.Remnant-like particles accelerate endothelial progenitor cells senescence and induce cellular dysfunction via an oxidative mechanism〔J〕.Atherosclerosis, 2009, 202( 2) : 405-406.
〔11〕庄瑜,刘俊,肖明第.血管平滑肌细胞在动脉粥样硬化中的作用〔J〕.现代生物医学进展,2009( 17):3375-3377.
