3日龄大鼠缺氧缺血性脑损伤脑组织VEGF表达变化探讨
2012-09-19刘利利
刘利利
随着围产医学的进步,早产儿脑损伤日益成为近年来国内外围产医学和新生儿学领域的研究热点。研究报道,早产儿这种神经系统功能障碍主要由脑白质损伤所致[1]。最近研究表明,众多细胞因子参与早产儿脑白质损伤的发病过程。血管内皮生长因子(vascular endothelial growth factor,VEGF)是近年来发现的一种细胞因子,其在早产儿脑白质损伤中的作用日益受到关注。本实验建立3日龄大鼠缺氧缺血性脑损伤模型,通过测定其后不同时间点脑白质区VEGF蛋白质的表达,探讨其在3日龄未成熟大鼠缺氧缺血后的表达变化规律,进一步阐明VEGF在早产儿脑损伤发病机理中的作用,以期为早产儿脑损伤的防治开辟新的途径,为临床的进一步研究和应用提供客观实验依据。
1 材料与方法
1.1 实验动物 92只3日 龄(出 生 日 为0天)SD(Sprague-Dawley)大鼠,雌雄不限,体重6.5~10.5 g。随机分为缺氧缺血模型组(以下简称实验组)50只和假手术组(以下简称对照组)42只,各组间雌雄、体重比较差异均无统计学意义(P>0.05)。术前称重及编号,实验组动物用无水乙醚吸入麻醉,仰卧位固定于手术台上,碘伏消毒手术区,紧贴气管右侧做一约1 cm纵切口,切开皮肤及皮下组织,分离肌层,暴露右侧颈总动脉,并用9-0丝线结扎,缝合伤口,再次消毒,表皮滴少量青霉素注射液。手术于5 min内完成。术后让实验鼠于37 ℃水浴箱中恢复2 h,后置于透明密封箱内,输入含氧气6%、氮气94%的混合气体,气体流量1.5 L/min,测氧仪监测得箱内O2浓度为6%,4 h后取出,放回原饲养环境中继续母乳喂养。对照组同样分离颈总动脉,然后仅将手术线从右侧颈总动脉穿过而不予以结扎,也不予以缺氧处理。整个手术及缺氧过程中,保持周围环境温度为30 ℃以上。实验组有10只大鼠因不能耐受手术,分别在手术中和手术后死亡。对照组有2只不明原因死亡。两组大鼠共80只(实验组和对照组各40只)分别于缺氧缺血后12、24、48、72 h及7 d处死(每组各时间点8只)。
1.2 取材及切片制备
1.2.1 取材 大鼠乙醚吸入麻醉后,开胸暴露心脏,经左心室灌注肝素化0.9%生理盐水20 ml,同时在右心耳处剪一切口,至流出液体变清为止。继予以4%冰多聚甲醛30 ml灌注,至肝脏明显变白及肺脏明显水肿、四肢完全僵直后,美蓝标记前囟位置,立即开颅取脑组织,将标本于4%冰多聚甲醛固定12 h,将固定的鼠脑从前囟后以视交叉为中心前后3 mm取材,再固定24 h。
1.2.2 切片制备 标本组织块经梯度脱水、浸蜡、包埋。包埋后的组织蜡块连续切片,厚度为3 μm,每块组织取连续切片2张(1张HE染色,1张免疫组化),分别裱于经APES处理的载玻片上,做免疫组化染色。
1.2.3 免疫组织化学染色法(SABC法)检测脑组织内VEGF的表达。
1.3 阳性结果的判定及计数方法 (1)阳性细胞的判断:VEGF显色主要在胞浆,有明确棕色或棕黄色染色为阳性细胞;iNOS显色定位于细胞浆/膜,有棕黄色染色为阳性细胞;(2)阳性细胞分级及计数方法:通过计算阳性细胞的比例和细胞染色强度,半定量评定VEGF及iNOS蛋白的表达。①根据阳性细胞所占的比例分为3个等级。1级:阳性细胞数<10%;2级:阳性细胞数10%~50%;3级:阳性细胞数>50%。②根据阳性细胞的染色强度分为5个等级。1级:阴性或微弱染色;2级:≤50%阳性细胞中等强度染色;3级:>50%阳性细胞中等强度染色;4级:≤50%阳性细胞高强度染色;5级:>50%阳性细胞高强度染色。
每组每个时间点各观察8只大鼠,每只大鼠取相邻切片2张,每张切片于右侧脑室周围白质和胼胝体区,各观察3个不重叠的高倍视野(10×40),取这3个视野细胞染色强度的等级平均值与阳性细胞比例等级数相乘,结果用任意单位(arbitraryunits,AU)值表示[2]。
1.4 统计学处理 采用SPSS 11.5进行统计学处理,计量资料以(±s)表示,表示成组设计的两样本均数比较采用t检验,多个样本均数比较采用单因素方差分析(one-way-ANOVA),两两比较,方差齐者用LSD法,方差不齐者用Duttet′T3法。P<0.05为差异有统计学意义。
2 结果
各组大鼠脑组织均可见VEGF蛋白的少量表达,免疫阳性细胞呈棕黄色表达于细胞浆中,细胞核为浅蓝色。VEGF在脑组织中呈广泛表达,主要见于胼胝体区、脑室周围白质的胶质细胞、海马、皮质区的神经元、内皮细胞、软脑膜细胞等。对照组胼胝体和脑室周围白质VEGF的表达较弱,且随日龄的增加表达没有明显变化,组间比较差异无统计学意义(P>0.05)。实验组VEGF阳性细胞在脑室周围白质和胼胝体区反应性增加,于缺氧缺血12 h表达开始增加,24 h表达达到高峰,7 d时恢复至正常,组间各时间点比较差异均有统计学意义(P<0.05)。实验组胼胝体、脑室周围白质VEGF的表达在12、24、48、72 h与对照组比较差异有统计学意义(P<0.05),7 d与对照组比较差异无统计学意义(P>0.05)。HI对侧亦有VEGF阳性细胞,但明显少于缺血侧。见表1、2。
表1 脑室周围白质VEGF表达(AU值)(±s)
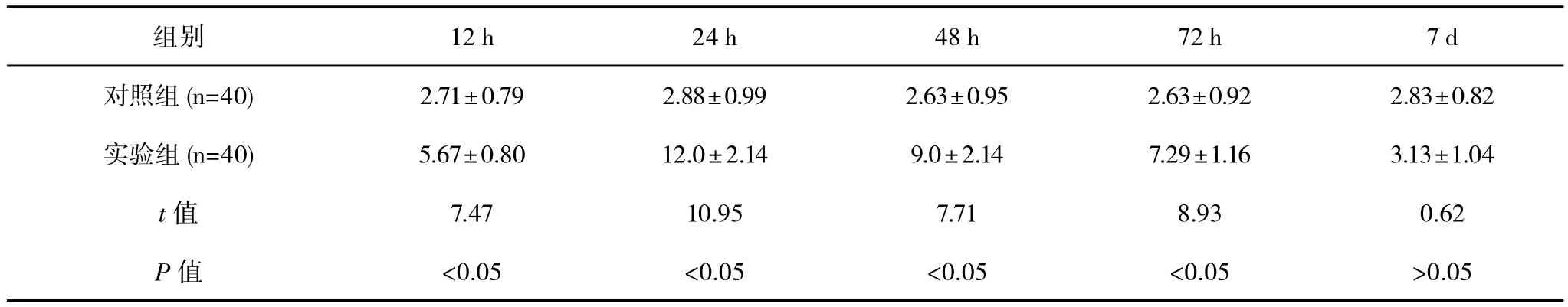
表1 脑室周围白质VEGF表达(AU值)(±s)
注:实验组各时间点间两两比较,P<0.05,F=36.88
组别 12 h 24 h 48 h 72 h 7 d对照组 (n=40) 2.71±0.79 2.88±0.99 2.63±0.95 2.63±0.92 2.83±0.82实验组 (n=40) 5.67±0.80 12.0±2.14 9.0±2.14 7.29±1.16 3.13±1.04 t值 7.47 10.95 7.71 8.93 0.62 P值 <0.05 <0.05 <0.05 <0.05 >0.05
表2 胼胝体区VEGF表达(AU值)(±s)

表2 胼胝体区VEGF表达(AU值)(±s)
注:验组各时间点间两两比较,P<0.05,F=43.28
组别 12 h 24 h 48 h 72 h 7 d对照组 (n=40) 2.71±0.79 2.92±1.05 2.71±0.98 2.54±0.85 2.67±1.01实验组 (n=40) 5.33±1.13 12.50±1.41 8.75±2.25 6.92±0.85 3.88±1.33 t值 5.40 15.39 6.96 10.27 1.55 P值 <0.05 <0.05 <0.05 <0.05 >0.05
3 讨论
随着围产保健及对宫内感染认识的重视,现临床所见宫内感染造成的脑白质损伤病例已逐渐下降。因此,缺氧缺血成为早产儿脑白质损伤的主要原因。缺氧缺血后,机体所诱发的一系列病理生理过程是诸多因素共同作用的结果。近年来,各种细胞因子的研究受到关注并取得较大进展。其中VEGF作为一种脑保护因子,其作用亦显重要。VEGF是Ferrara等[3]1989年首先从牛垂体的滤泡星状细胞中纯化出的同源二聚体糖蛋白。其分子量40~45 KD,耐酸、耐热,等电点>7.5。人VEGF基因位于6号染色体Gp21.3,全长14 kb,包括8个外显子、7个内含子,至少以6种亚型存在,分别为VEGF-A(VEGF165)、VEGF-B、VEGF-C、VEGF-D、VEGF-E及胎盘生长因子(PIGF)。在正常成人和动物组织中水平很低,而在某些病理情况下,如缺血、缺氧时,VEGF表达明显增加,尤以脑组织中VEGF表达升高明显[4]。VEGF是内皮细胞的强力丝裂剂,具有强大促进新血管生成作用,是最具特异性且作用最强的内源性血管生成因子。VEGF需与存在于内皮细胞表面的特异性受体(Flt-1,Flk-1/KDR)结合,促进血管内皮细胞增殖,刺激体内新生血管生成。关于VEGF在未成熟大鼠缺氧缺血性脑白质损伤的表达变化,国内外少见报道。
在实验中发现,各组大鼠脑组织均可见VEGF蛋白的少量表达,免疫阳性细胞呈棕黄色表达于细胞浆中,细胞核为浅蓝色。VEGF在脑组织中呈广泛表达,主要见于胼胝体区、脑室周围白质的胶质细胞、海马、皮质区的神经元、内皮细胞、软脑膜细胞等。VEGF于缺氧缺血12 h表达开始增加,缺氧缺血24 h表达达到高峰,缺氧缺血72 h仍有表达,7 d时恢复至正常。该结果考虑与HI脑组织通过VEGF表达促进血液再灌注及供氧量的增加,促进脑白质少突胶质细胞生理功能的恢复有关。其表达呈现出先升高后下降的趋势,这一结果与国外和国内一些研究一致。Ogunshola等[5]将新生大鼠出生后置于含90.5%氮气及9.5%氧气的缺氧条件下,发现VEGF蛋白在生后第8天表达明显增加,并持续至生后33 d,说明缺氧可诱导VEGF蛋白的表达。国内秦元华等[6]研究VEGF在7日龄SD大鼠HIBD后脑组织中的表达变化得出,VEGF在模型后即刻即有表达,12 h达到高峰,随后下降,7 d后呈低水平表达,说明大脑缺氧缺血会产生VEGF的高表达,且随时间波动。其结果的差异可能与动物模型、动物日龄不同、缺氧时间及浓度不同等有关。
在实验中还发现,实验组大鼠VEGF的表达明显高于对照组,且缺氧缺血侧脑白质VEGF的表达明显高于对侧。这一发现也与国外及国内研究一致。国外Lennmyr等[7]发现,在脑缺血缺氧后,神经元、胶质细胞、内皮细胞VEGF的表达增强。国内于慕刚等[8]观察7日龄大鼠HI后不同时间点VEGF和新生血管的表达,得出结论为,HI可诱导VEGF表达增加,VEGF参与了HI后脑组织新生血管的形成。
本实验表明,3日龄大鼠脑缺氧缺血可诱导脑白质内源性VEGF的表达增强,这可能是机体对抗缺血所引起的脑白质损害的一种自身保护方式。但机体的这种反应尚不足以促进脑缺氧缺血后的神经功能康复,适时地激活内源性VEGF表达或应用外源性VEGF,充分发挥其神经保护、神经再生及血管再生的作用,可能为早产儿脑白质损伤的治疗提供广阔的前景。本结果为以后开展VEGF干预治疗打下了实验基础。
[1] Volpe J J.Periventricular leukomalacia in the premature infant[J].Pediatr Res,2001,50(5):553-562.
[2] Mesters R M,Padro T,Bicker R,et al.Satble remission after administration of thereceptor tyrosine kinase inhibitor SU5416 in a patient with refratory acute myeloid leukemia[J].Blood,2001,1998(1):241-243.
[3] Ferrara N,Henzel W J.Pituitary follicular cells secrete a novel heparinbinding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res Commum,1989,161(2):851-858.
[4] Marti H H,Risau W.Systemic hypoxia changes the organ-specific distribution of vascular endothelial growth factor and its receptors[J].Proc Natl Acad Sci USA,1998,95(26):15809-15814.
[5] Ogunshola O O,Stewart W B,Mihalcik V,et al.Neuronal VEGF expression correlates with angiogenesis in postnatal developing rat brain[J].Dev Brain Res,2000,119(1):139-153.
[6] 秦元华,徐立新,屈云霞,等.新生鼠缺氧缺血性脑损伤后血管内皮生长因子的变化[J].新生儿科杂志,2004,19(2):65-68.
[7] Lennmyr F,Ata K A,Funa K,et al.Expression of vascular endothelial growth factor(VEGF) and its receptor(flt-1 and flk-1)following permnent and transient occlusion of the middle cerebral artery in the rats[J].Neuropathor Exp Neurol,1998,57(9):874-882.[8] 于慕刚,吴明哲,王华,等.新生大鼠缺氧缺血性脑损伤血管内皮生长因子表达与新生血管形成关系的研究[J].中国小儿急救医学,2007,14(1):45-47.
