CCI模型大鼠疼痛行为学观察
2012-09-19冯昌盛余庆波杨丹涂发平
冯昌盛 余庆波 杨丹 涂发平
疼痛是人们一生中经常遇到的不愉快感觉,它提供躯体受到威胁的警报信号,是生命不可缺少的一种特殊保护功能。另一方面,它又是各种疾病最常见的症状,也是当今困扰人类健康最严重的问题之一。根据神经生理功能,疼痛可分为生理性疼痛和病理性疼痛,神经病理性疼痛是由神经系统损伤或异常引起的一种难以治疗的疼痛状态。CCI模型是最常用的神经病理性疼痛动物模型。本研究主要观察CCI模型大鼠疼痛行为学表现。
1 资料与方法
1.1 实验动物 SPF级SD大鼠,6~8周龄,雄性,体重180~200 g,购自川北医学院实验动物中心。动物饲养环境安静,有良好的通风和空气过滤系统,室温22 ℃左右,湿度50%左右,明暗光照12 h:12 h,自由摄食,隔日更换笼具和垫料。动物适应环境3 d。雄性SD大鼠(n=48只)随机分为三组,即正常对照组(Nave组:n=16,分7、14 d亚组,每亚组8只)、假手术组(Sham组:n=16,分7、14 d亚组,每亚组8只)以及CCI组(n=16,分7、14 d亚组,每亚组8只)。
1.2 CCI模型的建立 (1)按Bennet和Xie[1]方法制作CCI模型;(2)称重:采用腹腔给药10%水合氯醛麻醉,300~500 mg/kg。侧卧位,手术侧在上,消毒,铺巾,选择左后肢,在股骨下方约l cm平行于股骨切开皮肤,用小剥离子经股二头肌间隙钝性分离肌肉,暴露坐骨神经,用神经剥离子轻柔将坐骨神经与周围软组织分离;(3)在坐骨神经分成三支前的主干部位游离神经7 mm左右,在距神经起始处(三支分叉处)上方2 mm处,用4.0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,使被结扎的神经长约4~5 mm。注意结扎的松紧度,以打结时可见肌肉轻微抽动为准;(4)局部生理盐水冲洗,间断缝合肌肉筋膜、皮下组织以及皮肤;术毕将大鼠放入鼠笼,于温暖、安静环境自由喂养;(5)假手术组除不结扎坐骨神经外,其余同模型组;手术由同一人操作。
1.3 行为学观察 在手术后2周内,每隔1~2 d观察1次,包括大鼠的步态和左后肢的姿势、局部皮肤以及肌肉张力的改变程度、是否存在舔咬肢体现象等。
1.4 机械刺激伤害感受阈值(MWT)的测量 在安静的环境中,将大鼠单独放置于透明的有机玻璃体中,待大鼠适应环境15~30 min后,以Electronic von Frey刺激针刺激大鼠左、右足底,每只大鼠刺激3次,间隔大于10 s。大鼠会出现抬足、缩足、快速甩足以及甩足后舔足等反应。将3次读数取平均值作为机械缩足反射阈值(MWT)。各组于术前、术后第1、3、6、8、10、13天进行测量。测量时间固定为9:00~13:00。术前测定值为基础机械痛阈。
1.5 统计学处理 采用PASW Statistics 18软件进行统计学处理,计量资料以(±s)表示,两组样本均数间的比较用t检验,组间比较采用重复资料方差分析和post hoc检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学变化 CCI大鼠术后健康状况良好,体重无明显减轻,毛发富有光泽,觅食饮水基本正常。术后1~2周,手术足趾并拢轻度外翻,下肢行走无力,步态呈现跛行,经常左后足悬空或不敢着地;站立时以右后肢持重,左后肢抬起并紧贴于腹部;术后14 d左右,左后肢出现比较明显的肌肉萎缩,给予轻微von Frey刺激时,大鼠经常迅速将左后肢抬起,有时放入口中舔吮;CCI大鼠左后肢悬空时间常超过25 s,CCI大鼠无自噬肢体现象。
2.2 大鼠体重变化 CCI组大鼠术后健康状况良好,体重无明显减轻,但体重增长较Sham组和Nave组略慢。各组大鼠术前基础值、术后第1、3天体重比较差异无统计学意义(P>0.05)。在术后第6、8、10、13天,CCI组大鼠体重与Nave组、Sham组比较差异有统计学意义(P<0.05)。术前、术后Nave组大鼠体重与Sham组比较差异无统计学意义(P>0.05),见表1。
表1 CCI模型大鼠体重变化(±s)g
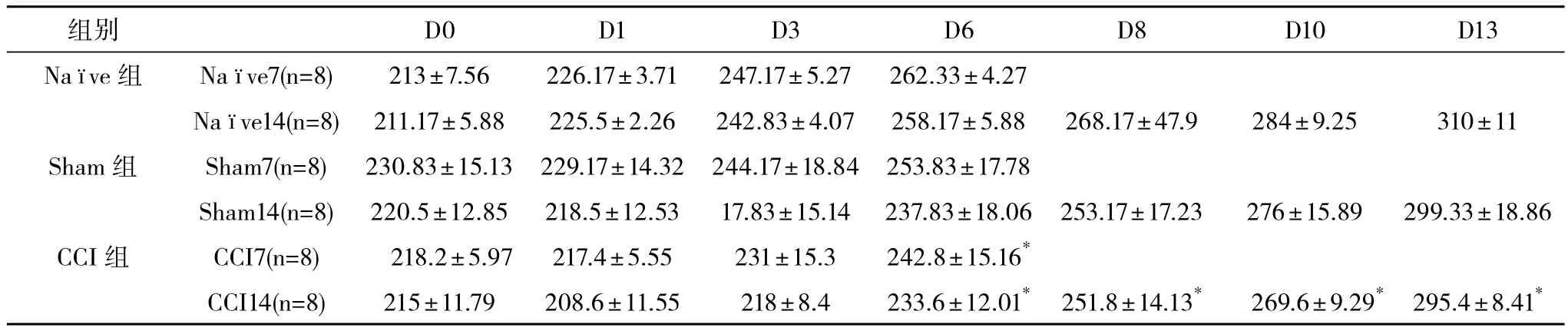
表1 CCI模型大鼠体重变化(±s)g
*CCI组与Nave组、Sham组比较,P<0.05
组别 D0 D1 D3 D6 D8 D10 D13 Naimages/BZ_6_1866_491_1881_534.pngve组 Naimages/BZ_6_1866_491_1881_534.pngve7(n=8) 213±7.56 226.17±3.71 247.17±5.27 262.33±4.27 Na images/BZ_6_1866_491_1881_534.pngve14(n=8) 211.17±5.88 225.5±2.26 242.83±4.07 258.17±5.88 268.17±47.9 284±9.25 310±11 Sham 组 Sham7(n=8) 230.83±15.13 229.17±14.32 244.17±18.84 253.83±17.78 Sham14(n=8) 220.5±12.85 218.5±12.53 17.83±15.14 237.83±18.06 253.17±17.23 276±15.89 299.33±18.86 CCI组 CCI7(n=8) 218.2±5.97 217.4±5.55 231±15.3 242.8±15.16*CCI14(n=8) 215±11.79 208.6±11.55 218±8.4 233.6±12.01* 251.8±14.13* 269.6±9.29* 295.4±8.41*
2.3 机械刺激伤害感受阈(MWT)变化 各组大鼠术前机械性痛阈比较差异无统计学意义(P>0.05)。手术前、后Nave组大鼠痛阈与Sham组比较差异无统计学意义(P>0.05)。各组大鼠非术侧机械性痛阈比较差异无统计学意义(P>0.05)。CCI组大鼠术侧痛阈在手术后第3、6、8、10、13天明显低于非手术侧,亦明显低于Sham组和Nave组(P<0.05)。CCI组大鼠术侧痛阈在手术后第6天降低最明显,此后一直保持此趋势至术后第13天,见表2。
表2 CCI模型大鼠机械刺激伤害感受阈变化(±s) g
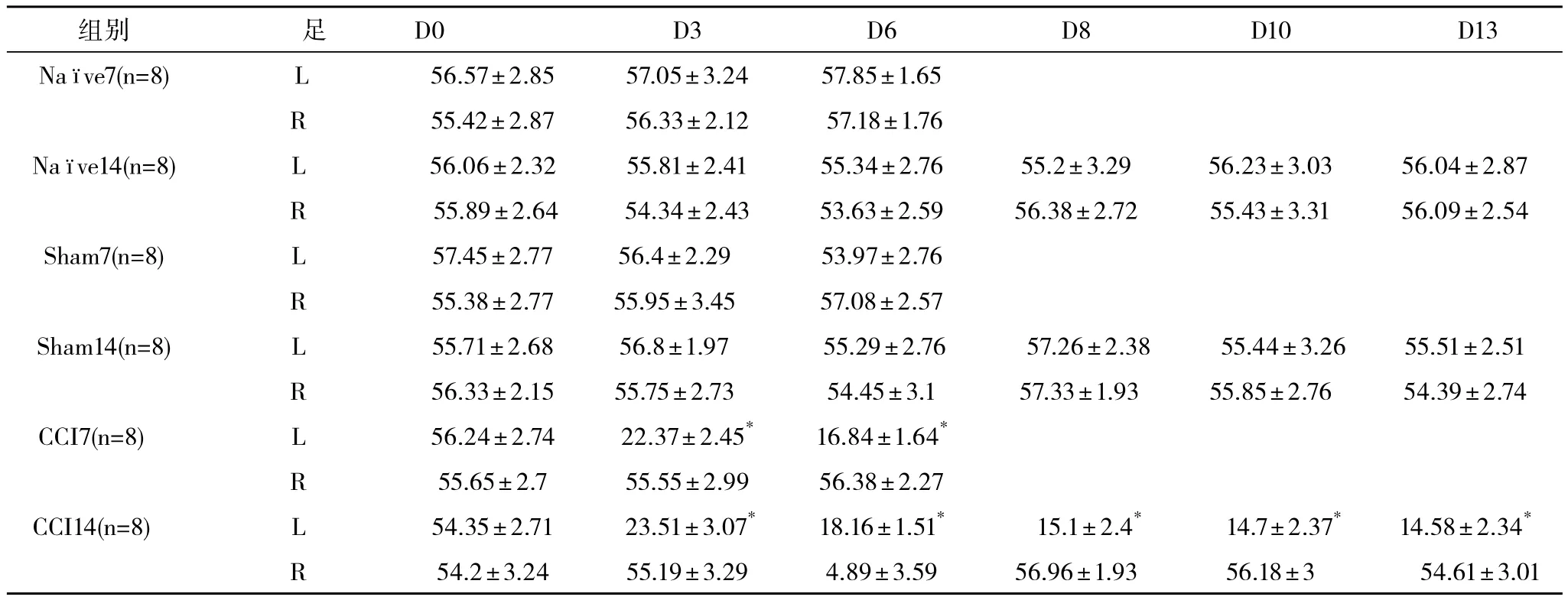
表2 CCI模型大鼠机械刺激伤害感受阈变化(±s) g
L:左足,R:右足,DX:*术后第X天CCI组与Nave组、Sham组比较,P<0.05
组别 足 D0 D3 D6 D8 D10 D13 Naimages/BZ_6_1866_491_1881_534.pngve7(n=8) L 56.57±2.85 57.05±3.24 57.85±1.65 R 55.42±2.87 56.33±2.12 57.18±1.76 Naimages/BZ_6_1866_491_1881_534.pngve14(n=8) L 56.06±2.32 55.81±2.41 55.34±2.76 55.2±3.29 56.23±3.03 56.04±2.87 R 55.89±2.64 54.34±2.43 53.63±2.59 56.38±2.72 55.43±3.31 56.09±2.54 Sham7(n=8) L 57.45±2.77 56.4±2.29 53.97±2.76 R 55.38±2.77 55.95±3.45 57.08±2.57 Sham14(n=8) L 55.71±2.68 56.8±1.97 55.29±2.76 57.26±2.38 55.44±3.26 55.51±2.51 R 56.33±2.15 55.75±2.73 54.45±3.1 57.33±1.93 55.85±2.76 54.39±2.74 CCI7(n=8) L 56.24±2.74 22.37±2.45* 16.84±1.64*R 55.65±2.7 55.55±2.99 56.38±2.27 CCI14(n=8) L 54.35±2.71 23.51±3.07* 18.16±1.51* 15.1±2.4* 14.7±2.37* 14.58±2.34*R 54.2±3.24 55.19±3.29 4.89±3.59 56.96±1.93 56.18±3 54.61±3.01
3 讨论
神经病理性疼痛的研究大多来源于动物模型,尽管目前模型还存在不少缺陷,但是它为理解和探索人类神经病理性疼痛的发病机制提供了有用的工具。病理性疼痛按其病程可分为急性和慢性两大类。前者多由损伤或炎症反应所致,当损伤痊愈或炎症消失时,疼痛即可消除。后者则多由难以消除的慢性炎症或神经病变所致,病程常迁延很久。慢性病理性疼痛模型主要分为两大类:炎症性及神经源性[1-2]。神经病理性疼痛的病理机制比较复杂,病变部位可从外周感受器一直到脑。神经病理性疼痛一般均伴有血管功能异常及炎症征象[3]。急性神经病理性疼痛患者由于患肢交感缩血管神经节后纤维神经递质释放量下降,引起表皮交感缩血管神经兴奋性功能丧失[4]。Bennett和xie于1988年首次复制出CCI模型,是国际上应用较多的疼痛模型。该模型操作简单,易掌握。该模型术后第2天开始出现痛反应,10~14 d达高峰,持续2个月后痛反应消失[1]。本次实验研究结果与上述理论相符。
CCI大鼠疼痛模型表现为自发痛(自发抬起损伤肢体,时而舔足、咬足或甩足,避免损伤侧的负重)、痛觉过敏(机械痛敏和冷痛敏)、轻度或中度的自残现象。多用于肿瘤压迫、重金属离子中毒、缺氧或代谢异常等诱发的神经病性慢性痛的研究[5]。由于铬肠线结扎之松紧度完全取决于实验操作,不同的松紧度可能导致不同程度的神经纤维功能的丧失,因此,来自于受损坐骨神经向脊髓节段的传入冲动可能存在差异。CCI模型的机制主要是由于机械压迫使轴突损伤并引起异位放电,并且用含铬肠线结扎坐骨神经后,局部重金属铬对神经的化学作用使炎症介质释放。大约在术后2周,神经损伤区域远端的有髓鞘纤维几乎全部脱髓鞘,但无髓鞘C纤维保持完整,损伤区域近端神经纤维正常[6]。
本研究还发现,CCI模型大鼠非手术侧(右侧)在术前、术后无显著变化,说明未发生超敏反应,无“镜像”痛发生。CCI大鼠行为学的改变及痛阈指标的变化有一定联系,与经典文献报道相符,说明模型建立成功,为进一步的深入研究奠定了良好基础。
[1] Bennett G J,Xie Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[2] Bellavance L L,Beitz A J,Anwyl.Altered e-fos expression in the parabrachial nucleus in rodent model of CFA·induced peripheral inflammation[J].J Comp Neuron,1996,366(3):431-447.
[3] Muenter Swift N,Charkoudian N,Dotson R M,et a1.Baroreflex control of muscle sympathetic nerve activity in postural orthostatic tachycardia syndrome[J].Am J Physiol Heart Circ Physiol,2005,289(3):1226-1233.
[4] Wasner G,Schattschneider J,Binder A,et a1.Complex regional pain syndrome-diagnostic,mechanisms,CNS involvement and therapy[J].Spinal Cord,2003,41(2):61-75.
[5] Attal N,Jazat F,Kayser V.Further evidence for “pain related”behaviors in a model of unilateral peripheral mononeuropathy[J].Pain,1990,41(2):235-251.
[6] Mosconi T'Kruger L.Fixed-diameter polyethelene cuffs applied to the rat sciatic nerve induce a painful neuropathy:ultrastruetrual morphometric analysis of axonal alterations[J].Pain,1996,64(1):37-57.
