肾移植受者并发恶性肿瘤34例临床分析
2012-09-17徐小明张岩徐自强郑少玲杨亦荣夏鹏
徐小明 张岩 徐自强 郑少玲 杨亦荣 夏鹏
随着免疫抑制剂的不断发展,肾移植受者长期带肾存活率明显提高。而由于长期使用免疫抑制剂、供受者年龄增长等原因,受者术后肿瘤发生也明显增多。为总结肾移植术后并发恶性肿瘤的发生情况、治疗措施及效果,我们回顾性分析温州医学院附属第一医院肾移植中心1983—2011年间1400例肾移植受者中发生恶性肿瘤患者的临床资料,现报道如下。
1 临床资料
1.1 一般资料
1400例肾移植受者发生恶性肿瘤34例(2.43%),男性23例,女性11例,移植时平均年龄(45±11)岁(27~67)岁。原发病为慢性肾小球肾炎10例、马兜铃酸肾病14例(肾移植术后发生肿瘤全部为尿路移行细胞癌)、高血压肾病3例、糖尿病肾病2例、多囊肾1例、IgA肾病1例、先天性海绵肾1例、肾病综合征1例和其他1例。34例均为首次移植:活体肾移植1例,尸体肾移植33例(其中1例为肝肾联合移植)。肾移植术后移植肾功能恢复正常33例,移植肾功能延迟1例。
1.2 免疫抑制方案
34例患者肾移植术后诱导期均使用甲泼尼龙冲击治疗3 d,剂量为第1天500 mg、第2天300 mg、第3天200 mg,其中有26例分别于术前2 h和术后第4天予以抗CD25单克隆抗体(商品名舒莱)20 mg。免疫抑制维持期:1例予以硫唑嘌呤+泼尼松,硫唑嘌呤起始剂量为200 mg/d,逐渐减量,半年后减量至75 mg/d,泼尼松起始剂量为80 mg/d,维持剂量为10 mg/d。2例采用环孢素+硫唑嘌呤+甲泼尼龙,后改为环孢素+吗替麦考酚酯+甲泼尼龙,7例采用他克莫司+吗替麦考酚酯+甲泼尼龙,24例采用环孢素+吗替麦考酚酯+甲泼尼龙。他克莫司起始剂量为0.05~0.15 mg·kg-1·d-1,环孢素起始剂量为6~8 mg·kg-1·d-1,根据血药浓度调整他克莫司和环孢素剂量;吗替麦考酚酯起始剂量为1.5~2.0 g/d,维持剂量为0.5~1.0 g/d;甲泼尼龙起始剂量为64 mg/d,每天递减8 mg,最后维持在4~6 mg/d。发生急性排斥反应的4例患者予以甲泼尼龙冲击治疗后肾功能恢复正常。
1.3 肿瘤诊断情况
泌尿系统肿瘤18例(2例并发泌尿系统肿瘤和肝癌),占52.9%,部位多发,组织病理学证实为Ⅰ~Ⅱ期12例,Ⅲ~Ⅳ期6例;消化系统肿瘤6例,占20.5%;血液系统肿瘤2例;甲状腺肿瘤2例;妇科肿瘤2例;其他肿瘤4例。34例恶性肿瘤患者发生肿瘤时平均年龄为(52±10)岁(29~71)岁,移植后至肿瘤确诊中位时间为74(8~325)个月。
诊断肿瘤时,34例患者HCV、HIV、梅毒ELISA检测结果均阴性,有2例HBsAg阳性(1例胆囊癌、1例泌尿系统肿瘤)。34例患者在首次肿瘤诊断时血清肌酐轻度升高(118±9 μmol/L)6例,明显升高(350±74 μmol/L)5例,余23例肾功能正常。
1.4 综合治疗措施
实体肿瘤尽可能手术切除。6例消化系统肿瘤中1例胆囊癌行胆囊切除+肝叶切除+淋巴结清扫术,1例乙状结肠腺癌行手术切除辅以化疗,1例直肠腺癌行根治术,1例胃小弯腺癌、1例结肠腺癌和1例肝细胞癌因广泛转移未行手术治疗;18例泌尿系统肿瘤患者中行2~4次经尿道膀胱肿瘤切除(transurethralresection ofbladdertumor,TURBT)12例,行膀胱部分切除7例,最终行膀胱全切除2例;2例血液系统肿瘤中1例左乳下方及腹壁皮下非霍奇金恶性淋巴瘤行手术治疗并予以氟达拉滨+环磷酰胺化疗,1例弥漫性大B细胞淋巴瘤、生发中心B细胞样予以氟达拉滨+环磷酰胺化疗;2例甲状腺癌均行根治性甲状腺肿瘤切除;2例妇科肿瘤患者1例为乳腺浸润性导管癌行乳腺癌改良根治手术并辅以环磷酰胺+亚叶酸钙+多柔比星化疗,1例宫颈癌行广泛子宫切除;1例左鼻背基底部细胞癌、右耳垂鳞癌行左鼻背及右耳廓恶性肿瘤扩大切除;1例喉癌、甲状腺微小腺癌行喉全切除、甲状腺次全切除;1例左眼眶腺癌行眼眶部肿瘤切除;1例左上颌牙龈中分化鳞癌浸润横纹肌、颌下淋巴结转移行左侧上颌骨全切除、左颊扩大切除。
所有患者在组织病理学确诊肿瘤时均调整免疫抑制剂剂量,根据肿瘤病理分级分期及患者全身情况将环孢素、他克莫司、吗替麦考酚酯及硫唑嘌呤剂量减少1/3~1/2。13例患者血清肌酐低于150 μmol/L、24 h尿蛋白总量少于1.5 g时用西罗莫司替换他克莫司或环孢素,其中5例出现肾功能轻度减退后加用小剂量他克莫司1例、再次转回环孢素2例、再次转回他克莫司2例。
12例膀胱肿瘤或肿瘤侵犯膀胱患者同时辅以重组人INF α-2b+表柔比星或吡柔比星、羟基喜树碱化疗。
1.5 随访结果
随访至2011年3月底,31例获得随访。3例分别随访74,60,115个月后失访,失访率为8.8%。存活22例肿瘤术后生存时间4~67个月,中位生存时间37个月;其中肾功能正常15例、血清肌酐轻度升高6例、移植肾切除后返回血液透析治疗1例。死亡9例肿瘤切除术后生存时间3~100个月,中位生存时间32个月;死亡原因为膀胱输尿管肿瘤并颅内占位出血1例、膀胱肿瘤腰大肌等远处转移1例、胃癌晚期广泛转移1例、肝细胞癌后腹膜转移及腹水1例、左鼻背基底部细胞癌及右耳垂鳞癌1例、喉癌及甲状腺微小腺癌均头颈部广泛转移1例、左眼眶腺癌颅内转移及左侧海绵窦占位1例、原因不详2例。见表1。各例患者临床资料详见附件1。
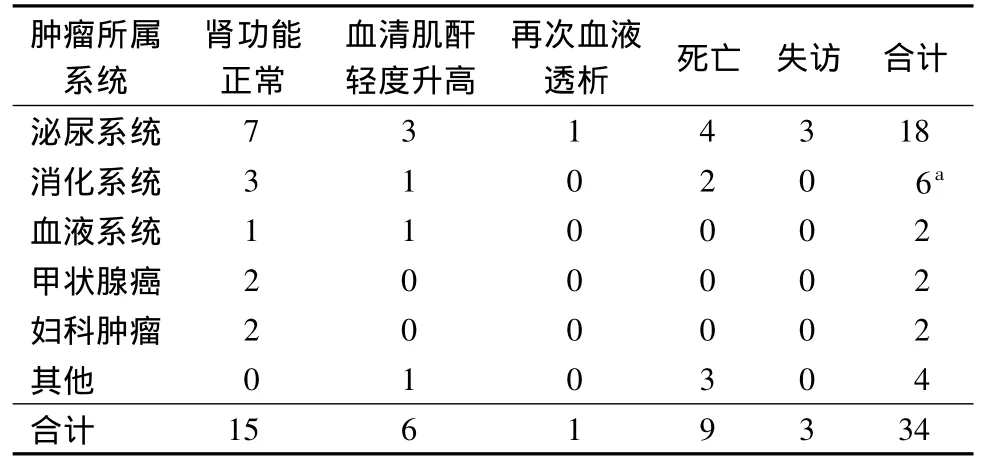
表1 34例各系统恶性肿瘤患者转归情况
2 讨论
随着器官移植技术的提高、新型免疫抑制剂的运用,肾移植术后长期带肾存活者越来越多,但术后恶性肿瘤的发生率和病死率也逐渐升高。国内外肾移植受者恶性肿瘤的发生率有所不同,Elkentaoui等[1]报道肾移植受者恶性肿瘤发生率为3.1%,Andrés等[2]荟萃分析了26篇文献112 308例肾移植受者的移植后肿瘤发生率为2.3% ~31%,平均10.45%。甚至国外有报道肾移植受者移植后10年恶性肿瘤发生率达到15% ~20%,移植后20年发生率达到40%[3]。国内刘广华等[4]报道肾移植受者恶性肿瘤发生率为3.6%,而彭明强等[5]对国内已公开发表的15篇文献进行总结分析得出肾移植受者恶性肿瘤发生率为0.56%~4.20%。本组受者恶性肿瘤发生率为2.43%,与国内数据接近,而明显高于中国普通人群恶性肿瘤发病率(273.66/10 万)[6]。
肾移植术后恶性肿瘤发生的原因是多方面的,其中与免疫抑制剂的使用关系较大,可能的机制包括:(1)免疫抑制剂的使用导致机体免疫系统监控能力下降,不能及时消灭突变的细胞;(2)机体免疫防御功能下降导致病毒感染机会增加,致使病毒相关肿瘤发生率升高,如人疱疹病毒-8与卡波西肉瘤有关、EB病毒与移植后淋巴增生性疾病有关;(3)某些免疫抑制剂有直接致癌作用,如硫唑嘌呤能诱导氧化应激和DNA突变以及DNA链断裂,环孢素可以阻碍断裂的DNA修复和减少体外诱导的细胞凋亡以及促使TGF-β增加从而促进肿瘤生长,同为钙调磷酸酶抑制剂的他克莫司也有类似的作用;(4)免疫诱导治疗过程中运用抗淋巴细胞抗体,增加移植后淋巴增生性疾病的风险。本组患者中有26例术前及术后分别使用抗CD25单克隆抗体行免疫诱导治疗,占74.5%。另外长期慢性抗原刺激、尿毒症期体内代谢的毒素对机体的长期慢性刺激、血液透析、过量日光照射、移植肾长期存活、供受者年龄较大、供受者术前存在未被发现的肿瘤等都是导致肿瘤发生率增加的因素。在中国还有另外一个重要原因:含马兜铃酸(aristolochic acid)中草药的使用。从1993年Vanherweghem首先发现马兜铃酸与肾间质纤维化、肾衰竭有关以来,有关马兜铃酸与肿瘤的报道层出不穷。Grollman 等[7]、Moriya 等[8]发现马兜铃酸能够导致p53基因中的A∶T突变为T∶A,从而增加泌尿系统肿瘤发生率;Wang等[9]通过动物实验发现马兜铃酸可导致H-Ras及K-Ras基因突变引起肿瘤发生。国内也有大量的临床文献报道马兜铃酸与泌尿系统肿瘤有关[4,10-12]。在本组18例泌尿系统肿瘤患者中有14例原发病为马兜铃酸肾病,且这14例均为尿路移行细胞癌,占整个泌尿系统肿瘤的77.7%,高于国内文献报道,这可能与浙南地区众多使用含马兜铃酸的中草药有关。因此在习惯使用中草药的中国乃至东南亚一带,需重视马兜铃酸肾病这一肿瘤高发因素。
肾移植术后恶性肿瘤呈现多发、累及多系统、发生率高的特点。本组34例恶性肿瘤中泌尿系统肿瘤18例,发生率为1.28%,发生率最高;其次为消化系统肿瘤6例,发生率为0.50%;再次为淋巴瘤、甲状腺肿瘤、妇科肿瘤,无肺部肿瘤发生。而在中国普通人群中肺部恶性肿瘤的发病率为49.7/10万,占18.16%;整个泌尿系统恶性肿瘤发病率为11.29/10万,占4.12%;消化系统恶性肿瘤的发病率为121.58/10万,占44.43%[6]。因此肾移植术后恶性肿瘤的发病情况与中国普通人群恶性肿瘤的发病情况明显不同:总发生率高于普通人群,以泌尿系统肿瘤为主,其次是消化系统肿瘤。但美国器官获取组织/器官分配联合网络(Organ Procurement and Transplantation Network/United Network for Organ Sharing)的数据显示,肾移植受者皮肤癌和移植后淋巴增生性疾病最多见,而泌尿系统肿瘤所占比例较小[13],这与国内文献报道的以泌尿系统肿瘤最多见(占 41.7% ~ 72.0%[4,14-17])不一致。本组报道的肿瘤发病类型也以泌尿系统肿瘤为主。
鉴于肾移植术后恶性肿瘤的恶性程度高、广泛转移、病死率高等特点,一旦发现肿瘤,应采取积极调整免疫抑制剂量,对实体肿瘤争取行手术治疗,同时辅以放疗、化疗、免疫治疗等综合治疗。在免疫抑制剂调整方面我们根据受者肾功能及术后病理分级分期调整免疫抑制剂,对病理分级为G1~G2、分期为Ⅰ~Ⅱ期的肿瘤患者,一般减少1/3左右免疫抑制剂剂量,对病理分级为G2以上、分期为Ⅱ期以上者减少1/2左右免疫抑制剂剂量,在肾功能正常情况下合理停用抗增殖类药物。此外当患者血清肌酐<150 μmol/L,24 h尿蛋白总量 <1.5 g时可用具有一定抑制肿瘤作用的西罗莫司替换他克莫司和环孢素。Geissler等[18]认为西罗莫司可以从哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及离子通道等6个方面抑制肿瘤生长;Wallerand等[19]认为西罗莫司能够通过mTOR抑制肿瘤新生血管形成和抑制肿瘤细胞生长,用mTOR抑制剂替换钙调磷酸酶抑制剂能够延长肾移植后肿瘤患者的生存时间。国内胡小朋等[16]认为使用西罗莫司联合低剂量环孢素对肾移植后尿路移行细胞癌安全、有效。本组共有13例由他克莫司或者环孢素转换为西罗莫司,结果肾功能正常7例、死亡1例、肾功能轻度减退5例;5例肾功能减退者中加用小剂量他克莫司1例、再次转为环孢素2例、再次转为他克莫司2例,再次转换后死亡1例、血清肌酐轻度升高1例、肾功能正常2例。肾功能稳定的9例中有1例非霍奇金淋巴瘤(外周性T细胞淋巴瘤)转换为西罗莫司后同时予以氟达拉滨+环磷酰胺化疗,治疗3个月后CT复查胸腹壁内淋巴结较前有所缩小。
在手术方面尤其是泌尿系统肿瘤,如果膀胱移行细胞癌为T1~T2期可采取TURBT治疗,复发且情况较好也可再次行TURBT,但多次复发、T2~T4期而无明显远处转移、原位癌、肉瘤样变或双侧肾盂输尿管移行细胞癌可尽量行膀胱部分切除,从而改善患者生活质量;但当移植肾基本无功能且膀胱肿瘤多次TURBT术后复发,不适合再次移植时可行膀胱全切除。本组18例泌尿系统肿瘤中曾行2~4次TURBT 12例、行膀胱部分切除7例、最终行膀胱全切除2例。对于肾盂输尿管移行细胞癌可行腹腔镜下或开放手术肾盂输尿管全切除+膀胱袖状切除。国外也有人主张预防性行肾、输尿管切除。杨宏伟等[11]主张对于原发病为马兜铃酸肾病肾移植术后对侧易复发的患者在行一侧肿瘤切除时,如果患者身体状况允许,可以同时行预防性手术。我们认为在多次尿细胞学阳性而影像学阴性、年龄>45岁、原发病为马兜铃酸肾病的患者,在身体状况允许的情况下可以行预防性手术。本组有2例为服用含马兜铃酸药物3年以上患者,首次发现时的肿瘤均为左侧肾盂输尿管移行细胞癌,在手术治疗后的多次尿细胞学检查中均发现异形细胞,但影像学检查为阴性,行预防性手术治疗后的病理结果证实为尿路上皮异型增生,其中1例伴癌变。另外,积极处理肿瘤的同时,应密切监测肾功能,一旦肿瘤出现广泛转移、不能控制,应以维护患者生命为主,放弃移植肾、停用免疫抑制剂,改血液透析治疗,这样有利于控制肿瘤,延长患者生命。
基于延长患者生命、改善患者生存质量考虑,我们认为术前应严格做好对供受者关于肿瘤、病毒感染等方面的筛查,术后加强抗感染治疗,加强受者宣教,建立健全的随访制度。我们建议对高危受者定期进行血常规、尿常规、肿瘤标志物、粪常规+隐血、尿细胞学等检查,对于女性受者每年还应做乳房钼靶X线和宫颈过氧化物抗过氧化物酶染色检查,争取每3个月1次超声检查,每半年1次膀胱镜检查。出现血尿时应立即随诊,必要时辅以CT、MRI、活组织等检查,争取对肾移植术后肿瘤患者早诊断、早治疗。
附件1:34例肾移植受者术后继发恶性肿瘤病理分级分期、治疗及转归情况一览表
1 Elkentaoui H,Robert G,Pasticier G,et al.Therapeutic management ofde novourological malignancy in renal transplant recipients:the experience ofthe French DepartmentofUrology and Kidney Transplantation from Bordeaux[J].Urology,2010,75(1):126-133.
2 Andrés A.Cancer incidence after immunosuppressive treatment following kidney transplantation[J].Crit Rev Oncol Hematol,2005,56(1):71-85.
3 Lutz J,Heemann U.Tumors after kidney transplantation[J].Curr Opin Urol,2003,13(2):105-109.
4 刘广华,李汉忠,王惠君,等.肾移植术后恶性肿瘤的发病类型和治疗[J].中国医学科学报,2009,31(3):288-291.
5 彭明强,杨志豪,方自林.国内公开报道的肾移植后并发恶性肿瘤病例的总结分析[J].中华器官移植杂志,2005,26(5):269-271.
6 赵平,程万青.2009年中国肿瘤登记年报[R].北京:军事医学出版社,2010:42-54,62-65.
7 Grollman AP,Shibutani S,Moriya M,et al.Aristolochic acid and the etiology of endemic(Balkan)nephropathy[J].Proc Natl Acad Sci U S A,2007,104(29):12 129-12 134.
8 Moriya M,Slade N,Brdar B,et al.TP53 mutational signature for aristolochic acid:an environmental carcinogen[J].Int J Cancer,2011,129(6):1532-1536.
9 Wang Y,Meng F,Arlt VM,et al.Aristolochic acid-induced carcinogenesis examined by ACB-PCR quantification of H-Ras and K-Ras mutant fraction[J].Mutagenesis,2011,26(5):619-628.
10周颖,黄丽华,梁雁,等.服含马兜铃酸中药患者肾移植术后发生继发肿瘤风险的调查[J].药物不良反应杂志,2009,11(1):9-12.
11杨宏伟,刘龙.马兜铃酸肾病肾移植术后并发泌尿系肿瘤5例并文献复习[J].现代泌尿生殖肿瘤杂志,2011,3(1):45.
12肖龙仁,杨亦荣,夏鹏,等.马兜铃酸肾病肾移植术后泌尿系统并发尿路上皮癌8例临床分析[J].解放军医学杂志,2010,35(4):442-444.
13 Kauffman HM,Cherikh WS,McBride MA,et al.Post-transplantde novomalignancies in renal transplant recipients:the past and present[J].Transpl Int,2006,19(8):607-620.
14范宇,石炳毅,常京元,等.肾移植术后并发恶性肿瘤分析[J].解放军医学杂志,2007,32(5):529-530.
15 Wu MJ,Lian JD,Yang CR,et al.High cumulative incidence of urinary tract transitional cell carcinoma after kidney transplantation in Taiwan[J].Am J Kidney Dis,2004,43(6):1091-1097.
16胡小朋,马麟麟,张小东,等.肾移植术后并发尿路上皮肿瘤的临床分析[J].中华泌尿外科杂志,2006,27(7):493-495.
17孟慧林,杨德安,李香铁,等.肾移植术后恶性肿瘤12例分析[J].中华器官移植杂志,2002,23(3):146-148.
18 Geissler EK.Can immunosuppressive strategies be used to reduce cancer risk in renal transplant patients?[J].Transplant Proc,2010,42(9 Suppl):S32-S35.
19 Wallerand H,Ravaud A,Ferrière JM,et al.Bladder cancer in patients after organ transplantation[J].Curr Opin Urol,2010,20(5):432-436.
