超高效液相色谱-串联三重四极杆串联质谱法 测定细辛中的4种马兜铃酸
2022-05-30欧爱芬黄嘉乐董杨静赵肃清
欧爱芬,黄嘉乐,董杨静,赵肃清
(1.广东工业大学生物医药学院,广东广州 511400)(2.广州城市职业学院食品科学与美食养生学院,广东广州 510405)(3.广州检验检测认证集团有限公司,广东广州 511440)
马兜铃酸是一类硝基菲羧酸,主要存在于马兜铃科的马兜铃属和细辛属植物中[1-4]。在我国马兜铃科植物经过炮制解毒入药已有几千年历史,在南朝时期唐甑所著的《药性论》中,就有马兜铃的入药记载,如马兜铃性平,能主肺气上急,坐息不得,主咳逆连连不可止[5,6]。1964年,吴松寒[7]对2例急性肾衰竭的患者进行诊断发现,均是因为大剂量服用关木通所导致。1992年,比利时病理医师对两位肾功能不全者的患者研究发现,他们均在同一家减肥诊所接受减肥治疗,随后研究人员对他们服用的减肥胶囊进行成分检查测,被证实减肥胶囊种含有马兜铃科植物广防己。同时也从受害者的肾组织种分离出马兜铃-DNA加合物,该事件被国际医学界关注,继而对马兜铃酸展开全面研究,并被称为“马兜铃酸肾病”[8-10]。2012年国际癌症研究组织将马兜铃酸及含有马兜铃酸的植物被列为一类致癌物[11,12]。近年,对多瑙河地区性家族性肾病研究发现,马兜铃酸随着植物腐烂进入土壤后能够抵制植株中酶体系及土壤微生物对其的分解作用,被土壤种植的植物吸收而产生富集[13,14],因此马兜铃酸不单是一种药源性疾病,同时还是环境污染所致的食源性疾病。2020年版《中国药典》收录的细辛,不单作为中药材用于中医,并且在民间作为一种煲汤食材用于温肺止咳化痰、益气祛风、散寒止痛的食疗方法。
目前马兜铃酸的检测方法主要是色谱,包括薄层色谱、高相液相色谱、液质联用等,其中薄层色谱主要用于定性[15,16];高相液相色谱可以用于定性和定量[17-20],但是由于中药材成分的复杂性,在分离过程中很难排除其他成分的干扰,存在一定的局限性;液质可以准确地用于定性和定量,但是目前关于液质检测马兜铃酸的含量,主要集中在含量较高毒性最强的马兜铃酸A上[21-26]。随着对马兜铃酸结构进一步研究后发现,马兜铃酸主要结构除了马兜铃酸A以外,还有马兜铃酸B、马兜铃酸C、马兜铃酸D,其结构差异主要是甲氧基或者羟基的位置不同[27]。马兜铃酸的毒性与其结构有关,硝基是马兜铃酸类衍生物中最主要的毒性基团,此外羟基的存在可以使马兜铃酸的毒性进一步加强,其中马兜铃酸A的毒性最强,马兜铃酸B也具有一定毒性,而其他成分的肾毒性和致癌性差异尚不明确[28]。因此建立同时测定马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D的液质方法,并对目前市售细辛及含有细辛的8种中成药中四种马兜铃酸含量进行分析,对细辛的食用及药用安全,以及及含细辛中成药的质量控制具有重要意义。
超高相液相色谱(UPLC)相对于高效液相色谱,其可以在工作压力超过6000 psi或工作温度超过环境温度的下应用,可以使用填充颗粒更小的色谱柱,不仅可以实现更高的分辨率,同时还能缩短整体的分析时间。质谱分析具有灵敏度高,准确性好,定性和定量能同时准确检测等优点。三重四级杆质谱仪利用母离子和子离子的共同特征,定量选择性高。因此,本文建立了同时快速测定中药材中马兜铃酸A、B、C、D四种物质的超高相液相色谱串联三重四级杆质谱法(UPLC-QQQ-MS/MS),并对9个样品中四种物质的含量进行测定。
1 材料与方法
1.1 材料与仪器
甲醇、甲酸,均为色谱纯,德国Merck公司;马兜铃酸A(CAS:313-67-7),罗恩试剂;马兜铃酸B(CAS:475-80-9)、马兜铃酸C(CAS:4849-90-5)、马兜铃酸D(CAS:17413-38-6)标准品均购于中国广州测试中心;9种试验用药,市售。
岛津LC-30A超高效液相色谱仪,日本岛津;高效液相色谱-串联质谱仪,美国AB Sciex公司;AB Sciex 5500三重四级杆质谱仪,(配备电喷雾离子源(ESI),software version: Analyst.7.1),美国AB SCIEX公司;十万分之一电子天平,美国梅特勒公司;高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;涡漩振荡仪,德国IKA公司;超声波清洗器,昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 液相色谱条件
色谱柱:Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm×1.8 μm);流动相:甲醇,含0.1%甲酸水溶液,梯度洗脱。梯度洗脱参数见表1;流速:0.3 mL/min;柱温:40 ℃;进样体积:5 μL。
1.2.2 质谱条件
离子源:电喷雾离子源(ESI+源);检测方式:多反应监测(MRM);扫描方式:正离子模式扫描[29];气帘气(CUR):30 μL/min;离子化电压(IS):5500 V;离子源温度(TEM):550 ℃;喷雾器(GS1):50 psi;辅助加热器(GS2):50 psi;喷撞气(CAD):9 psi;碰撞电池入口电压(EP):10 V;碰撞电池出口电压(CXP):13 V;倍增光电压(CEM):2100 V;采用多反应监测(MRM)模式采集数据,质谱参数见表2。

表2 马兜铃酸A、B、C、D质谱分析参数Table 2 The MS condition for determination of four aristolochic acids
1.2.3 对照品溶液的制备
(1)标准储备液:精密称取马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D各0.0050 g(精确至0.00001 g),置于100.00 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制成浓度为50.00 mg/L标准储备液,4 ℃保存。
(2)混合标准中间液:分别准确量取0.20 mL马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D上述标准储备液,置于10.00 mL容量瓶中,用甲醇稀释至刻度,摇匀,制成马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D浓度为1.00 µg/mL的混合标准中间液,4 ℃保存。
(3)混合标准工作液:准确吸取4种马兜铃酸标准中间溶液4.00、20.00、40.00、60.00、80.00、100.00 μL,分别用70%甲醇水定容至1.00 mL,配制得到4.00、20.00、40.00、60.00、80.00、100.00 μg/L系列浓度标准工作曲线。临用前配制。
1.2.4 样品溶液的制备
(1)液体试样:选取10支混合均匀,精密量取1.00 mL液,置于50.00 mL容量瓶中,用70%甲醇稀释至刻度,摇匀,超声30 min,放冷,用70%甲醇定容至刻度,用0.22 μm有机系滤膜过滤,作为供试品溶液。
(2)固体试样:取10片或者适量研磨成粉状后,精密称取1.00 g试样,置于50 mL容量瓶中,加入40 mL 70%甲醇,超声30 min,放冷,用70%甲醇定容至刻度,用0.22 μm有机系滤膜过滤,作为供试品溶液。
2 结果与讨论
2.1 流动相系统的选择
马兜铃酸A、B、C、D是一类硝基菲羧酸,结构类似,为了获得四种目标物最好的分离分析效果,考察了甲醇-0.1甲酸水溶液、乙腈-0.1甲酸水溶液以及二氯甲烷-0.1甲酸水溶液作为流动相进行分析。结果显示,甲醇和乙腈由于极性大,具有较好分离效果;而二氯甲烷极性较小,无法有效洗脱吸附在色谱柱上的待测物。但是,考虑到环境污染,人员健康问题,最后选用了甲醇作为流动相,对马兜铃酸类物质进行检测。
2.2 色谱柱的选择
选用了Welch AQ-C18(4.6 mm×100 mm,5 μm)、Phenomenex Luna NH2(4.6 mm×100 mm,3 μm)、Phenomenex KinetexC18(4.6 mm×100 mm,2.6 μm)、Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm×1.8 μm)等常用的4种液相色谱柱。通过对四种物质的混合标准溶液进行进样分析发现,NH2柱(图1a)对马兜铃酸类物质的保留较强,无法达到预期实验效果;AQ-C18(图1b)柱及C18(图1c)对马兜铃酸类物质的分离能力较差;T3(图1d)对4马兜铃酸类物质的分离效果较理想,故选用Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm×1.8 μm)作为四种物质的分离色谱柱。
2.3 线性关系
将1.2.3中配制的混合标准工作液在1.2.1与1.2.2项条件下测定(图2、图3),出峰的先后顺序依次是马兜铃酸C、马兜铃酸D、马兜铃酸B、马兜铃酸A,以标准品溶液的浓度为横坐标,以色谱峰面积为纵坐标进行线性拟合,马兜铃酸A、B、C、D的线性方程分别为:y=0.2133x+0.2227(R²=0.999);y=0.0916x+ 0.0615(R²=0.9981);y=0.0575x+0.0245(R²=0.999);y=0.0081x-0.0079(R²=0.9967)。四种物质在4.00~100.0 μg/L浓度范围内线性关系良好,相关系数均在0.995以上。并以信噪比(S/N=3)来确定马兜铃酸A、B、C、D最低检出限,分别为3.00、5.00、25.00、20.00 μg/kg。
2.4 精密度
将浓度为40 μg/L混合标准工作液重复进样6次进行检测,结果如表3。测得马兜铃酸A、B、C、D的峰面积RSD分别为1.41%、1.54%、1.73%、1.26%,表明该仪器精密度良好。

表3 精密度实验结果(n=6)Table 3 The results of precision (n=6)
2.5 稳定性
取细辛粉末适量,按1.2.4固体试样制备供试品溶液,在0、2、4、8、12、24 h对样品进行测定[30],记录色谱峰面积,并计算各组分的含量。结果如表4,马兜铃酸B和马兜铃酸C均未检出,马兜铃酸A和马兜铃酸D的RSD值分别为1.22%、0.67%,表明供试品溶液在24 h内稳定。
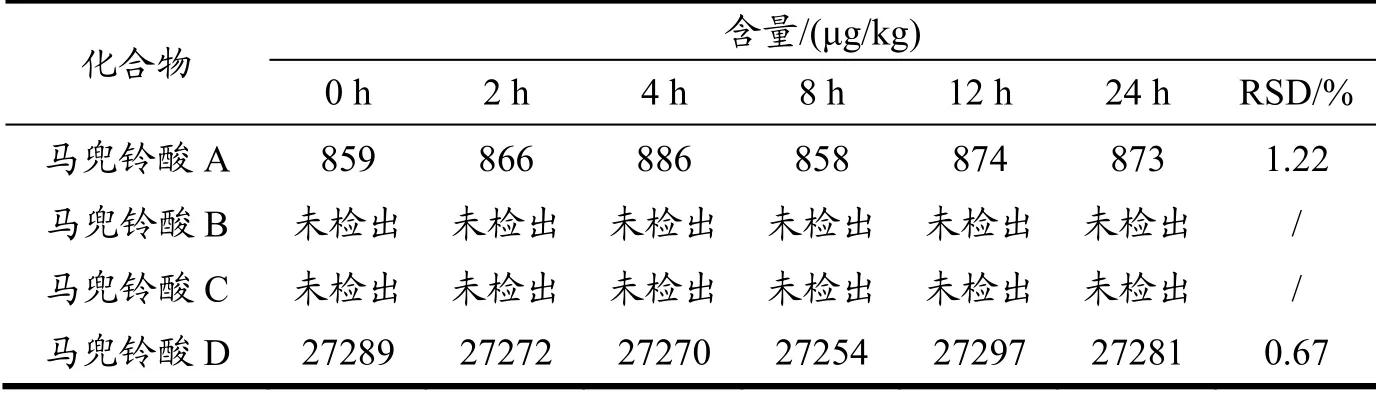
表4 稳定性实验结果(n=6)Table 4 The results of stability (n=6)
2.6 重复性
取同一批次细辛药材磨成粉末,精密称取6份,按按1.2.4固体试样制备供试品溶液,并进行测定,记录色谱峰面积,并计算各组分的含量。结果如表5,马兜铃酸B和马兜铃酸C均未检出,马兜铃酸A和马兜铃酸D的RSD值分别为1.42%、0.31%,表明该方法重复性好。
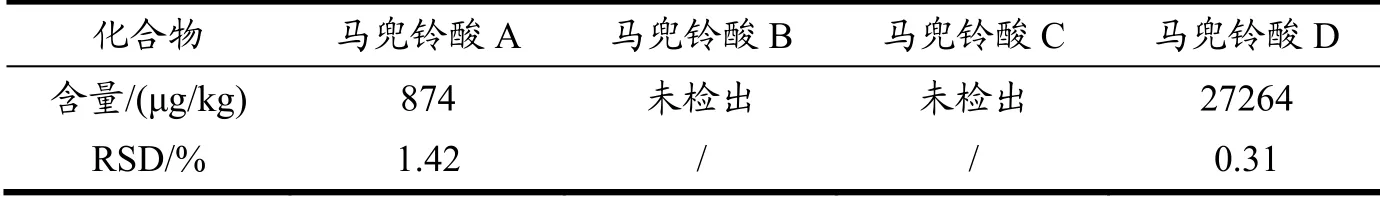
表5 重复性实验结果(n=6)Table 5 The results of repeatability (n=6)
2.7 加样回收
取同一批次细辛药材磨成粉末,精密称取9份样品,加入一定量的混合标准中间液,配制成高、中、低的加标溶液,按1.2.4制备供试品溶液,进行测定,其中马兜铃酸D在1.2.4的基础上再稀释10倍进行测定,计算其加标回收率及RSD,结果如表6所示。结果表明,四种物质的3个不同浓度加标回收率均在91.97%~106.40%之间,RSD均小于4.24%,可满足检测要求。
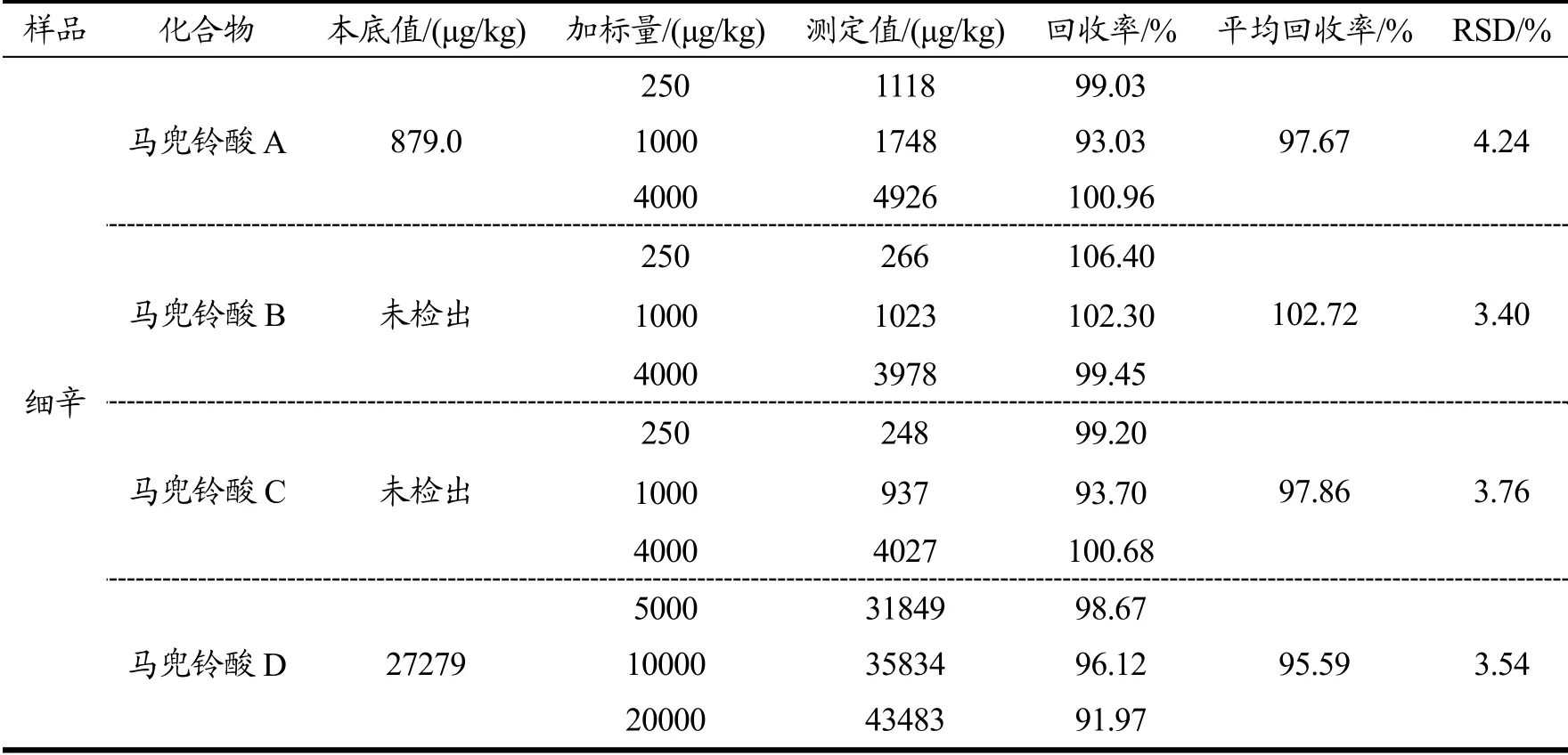
表6 加标回收率(n=9)Table 6 The results of recovery (n=9)
2.8 样品测定
精密称取适量样品,按1.2.4制备供试品溶液,用外表法计算四种物质的含量,结果见表7。从结果可以看出含有细辛及细辛类中成药中除了含有马兜铃酸A还有一定量的马兜铃酸D,且都不含有马兜铃酸B及马兜铃酸C,细辛中成药中马兜铃酸A和马兜铃酸D两种成分的含量均低于细辛原材料。

表7 9种中药材的检测结果Table 7 Test results of 9 kinds of Chinese medicinal materials samples (¯x±s, μg/kg, n=3)
3 结论
3.1 本文建立里了超高相液相色谱串联三重四级杆质谱法,用于同时测定样品中四种马兜铃酸(马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D)含量,在4~100 μg/L浓度范围内线性关系均良好(r≥0.995),检出限分别为3.00 μg/kg、5.00 μg/kg、25.00 μg/kg、20.00 μg/kg,加样回收率在91.97%~106.40%之间,RSD≤4.24%(n=9)。该方法专属性强,准确度和精密度高,线性范围广,适用于样品中四种马兜铃酸的同时检测。并用该方法对目前市售的细辛及8个含细辛中成药进行了这四个成分的含量测定,细辛及8个含细辛的中成药均含有不同程度的马兜铃酸A或马兜铃酸D,均未检出马兜铃酸B和马兜铃酸C。同时细辛中成药中马兜铃酸A和马兜铃酸D的含量均低于细辛药材,且细辛及细辛中成药中马兜铃酸A的含量均低于《中国药典》规定的每克含量不得超过0.001%,符合安全使用标准。2007年,李伟等[31]对细辛及养血清脑颗粒中马兜铃酸A进行测定,发现细辛中含有微量的马兜铃酸A,而以细辛为原料的养血清脑颗粒中却没有检测到马兜铃酸A,因为中成药在配伍和提取制剂过程中具有减毒增效的作用。2017年,李功辉等[32]采用UPLC-QQQ-MS对不同药材中的马兜铃酸A进行测定,其中细辛类药材中马兜铃酸A的含量均小于10 μg/g。
3.2 目前从马兜铃科植物中提取的含马兜铃酸类结果的化合物有160多个,最基本的结构有马兜铃酸A、马兜铃酸B、马兜铃酸C、马兜铃酸D四种,在细辛及含细辛的中成药中除了检出马兜铃酸A外,还含有一定量的马兜铃酸D。2018年,丁慧等[33]采用UPLC-MS/MS对天仙藤、青木香、马兜铃、寻骨风、朱砂莲五种药材中的四种马兜铃酸含量进行测定,结果显示四种物质在五种药材中的含量有较大的差别。这提示我们在研究细辛类中药材在食用及药用的安全性时,不能只关注马兜铃酸A,还应该关注马兜铃酸D。
