改良式肝提拉法血流阻断无血肝切除的临床应用研究
2012-09-13俞小炯
熊 伟 俞小炯 董 科
四川省医学科学院 四川省人民医院肝胆胰中心二病区,四川成都 610072
肝脏是人体中血流充足的消化腺,可对体内的各种物质进行控制和调节并分解毒素,是人体重要的消化器官。在行肝切除手术时易发生大出血和肝损伤从而影响手术成功率和术后患者的正常功能,降低了患者的生活质量[1-2]。改良式肝提拉法是一种行肝切除术的新兴方法,对血流进行阻断从而减少出血率,并尽可能保留残肝的功能。我院采用改良式肝提拉法对2010年7月~2011年12月的164例需行肝切除术的患者进行手术治疗,并对治疗效果进行总结和分析,以期对改良式肝提拉法的临床应用价值进行探讨和评价。
1 资料与方法
1.1 一般资料
选择 2010年 7月~2011年 12月,经血常规、CT、MRI、B超检查需行肝切除术治疗的患者164例,其中男107例,女57例,年龄 13~72 岁,平均(45.6±23)岁;根据入院时间随机分为三组,第一肝门入肝血流阻断组(A组,n=49例)、半肝入肝血流阻断组(B组,n=56例)和改良式绕肝提拉法肝血流阻断组(C组,n=59例),术前所有患者经医院伦理委员会通过并签知情同意书。其中原发性肝细胞癌患者115例,肝内胆管结石26例,胆管细胞癌患者13例,肝血管瘤患者6例,混合性肝癌患者4例。三组患者年龄、性别、肿瘤大小和部位等一般资料比较差异无统计学意义(P<0.05),具有可比性。
1.2 肝血流控制方法
A组患者采用导尿管或门静脉阻断钳对腹主动脉、第一肝门和下腔静脉进行阻断,使肝脏呈无血状态。行肝切除并控制阻断时间在15~25min。B组患者于左右肝门分叉处进行分离,门静脉与下腔静脉间隙处放置止血带,使患侧肝血呈无血状态。C组患者:①无血右半肝切除:对肝右静脉和肝中静脉进行分离,暴露肝上静脉窝,再对肝下下腔静脉进行分离,提拉悬吊带止血,分离结扎肝右静脉,并对肝脏进行切除。②无血左半肝切除:于肝圆韧带近肝门处分离肝动脉和门静脉左支,再分离肝左静脉,悬吊带穿过后收紧,切除左半肝。相比于传统Belghiti绕肝提拉法,笔者在术中依照患者具体的情况和切肝部位进行灵活的改变,优先选择游离右肝周韧带,于直视下行右肝短静脉和右后下静脉的结扎,使手术更安全。同时,在放置提拉带之前,笔者先对入肝血流进行结扎,再对提拉带进行收紧,这样更符合无瘤手术原则的手术操作顺序,避免肿瘤细胞进入血液,造成血行扩散。另外,传统的Belghiti绕肝提拉法只应用于右半肝的切除,但笔者也将其应用到左半肝,并取得成功。由此,笔者对传统的Belghiti绕肝提拉法进行了改良。术后,笔者对三组患者术中出血量、手术时间、术后肝功能的恢复时间、术后血浆管引流量、输血量、术后并发症以及住院时间进行观察和对比,对改良Belghiti绕肝提拉法手术治疗效果进行综合评价。
1.3 统计学方法
采用SPSS 19.0 对数据进行分析处理,计量资料数据以均数±标准差(±s)表示,采用方差分析,两两比较采用 LSD-t检验。计数资料采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 三组患者的术中、术后情况比较
A、B、C 三组患者术 中出血量分别为 (371±136)mL、(365±126)mL、(217±96)mL;经比较三组间以改良式绕肝提拉法肝血流阻断肝切除(C组)出血量最少,同A、B两组比较差异有统计学意义 (P<0.05);A、B、C三组出现并发症分别是 6例(6/49)、6例(6/56)和 5例(5/59);B 组患者因术后肝功能衰竭死亡1例,A、C组无一例死亡。见表1。
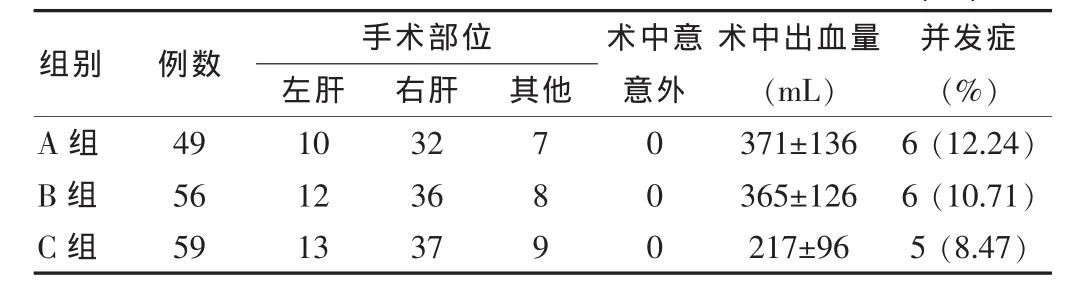
表1 164例肝切除患者不同阻断方法的术中、术后情况(例)
2.2 三组患者的术后情况比较
A、B、C 三组手术时间分别为(136±60)min、(147±65)min和(150±70)min,C组平均手术时间最长,但组间差异无统计学意义(P>0.05);术后3 d的血浆引流总量分别为(185±30)mL、(128±20)mL、和(100±36)mL,以 C 组引流量最少,A组引流量最多(P<0.05)。住院时间A、B、C三组平均分别为(8.0±4.5)d、(7.0±3.5)d、(6.0±3.5)d,差异有统计学意义(P<0.05)。A、B、C 三组输血例数分别是 6例(6/49)、6例(6/56)和5例(5/59),差异无统计学意义(P>0.05)。见表2。
表2 164例肝切除患者不同阻断方法术后临床资料对比(±s)
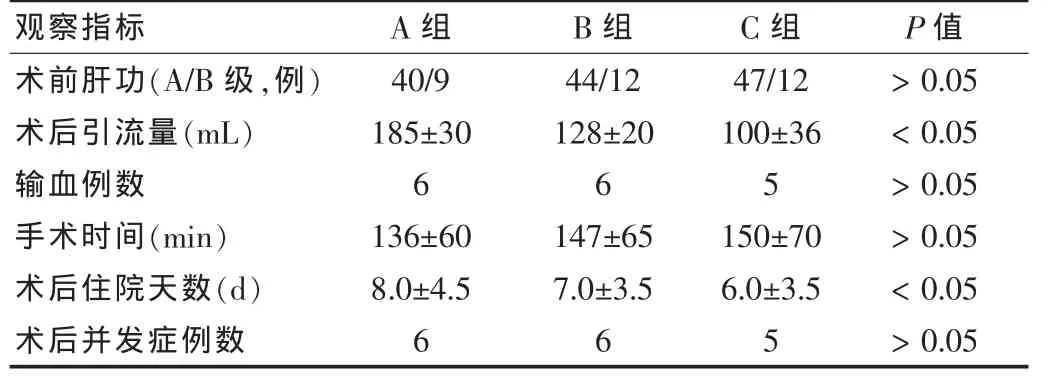
表2 164例肝切除患者不同阻断方法术后临床资料对比(±s)
观察指标 A组 B组 C组 P值术前肝功(A/B级,例)术后引流量(mL)输血例数手术时间(min)术后住院天数(d)术后并发症例数40/9 185±30 6 136±60 8.0±4.56 44/12 128±20 6 147±657.0±3.56 47/12 100±36 5150±70 6.0±3.55>0.05<0.05>0.05>0.05<0.05>0.05
2.3 三组患者的手术前后ALT、AST检测情况比较
A、B、C三组术前血清转氨酶比较无差异(P>0.05)。术后B、C组3 d和7 d的血清转氨酶 [天门冬氨酸氨基转移酶(AST),丙氨酸氨基转移酶(ALT)]明显低于 A 组,且下降程度也较之明显,A组和B、C组之间差异有统计学意义 (P<0.05)。见表3。A组TB胆红素术后3、7 d下降速度较B、C组慢,差异有统计学意义(P<0.05)。A组CHE和ALB术后恢复时间较B、C组慢,差异有统计学意义(P<0.05)。
3 讨论
肝切除术是治疗各种肝脏疾病如肿瘤、肝硬化、胆管结石等相关疾病的重要方法,术中大出血和肝损伤的发生则大大增加了手术的风险性并降低了成功率,对患者的预后和生活质量造成了很大影响。由此,肝血流的阻断技术对提高手术成功率并改善患者预后具有重要的意义。
自2001年Belghiti报道用肝脏提拉法切除不能游离右肝韧带已侵犯隔肌及腹壁的右肝肝癌。相继日本、德国有类似报道[2-4]。传统Belghiti肝提拉法对于技术要求高,肝后隧道也往往在盲视的情况下操作,且仅应用于右半肝。经改良后的Belghiti绕肝提拉法无血半肝切除术在实际的应用中,尽可能先游离右肝周韧带,可在直视下进行操作,使手术更安全,防止下腔静脉的损伤。提拉带的使用可以在术中防止大出血的发生,直视操作对于提拉带的有效实施提供了更好的安全保障。
我国随着生活水平的提高,已成为了肝病的高发国家,特别是肝脏肿瘤的发生率呈逐年增加的趋势。在肿瘤手术的无瘤原则中,由于手术中的一些钝性操作易使肿瘤细胞进入血液形成扩散,故手术操作顺序应先对肿瘤的出、入血管进行结扎,再对肿瘤的周围组织进行分离,以避免血行扩散。由此,笔者在切肝之前会先结扎或阻断肝静脉,遵循无瘤原则,真正起到根治作用并降低患者的手术风险。同时,改良Belghiti肝提拉法应用更广,能够更好的适应患者的需要,扩大肝脏切除术的适应证,帮助更多患者病情得到逆转。第一肝门阻断组在肝切除手术中一直有着广泛的应用。无需游离肝脏,操作简便。但由于缺血器官再灌注损伤机制的存在,涉及了肝内肝外的病理变化[3-4],也给手术带来了较高的操作难度甚至危及患者生命[4-8]。
表3 三组患者手术前后ALT和AST比较(±s)

表3 三组患者手术前后ALT和AST比较(±s)
阻断方式 术前ALT AST术后3 d ALT AST术后7 d ALT AST A组B组C组P值54.56±18.2 55.12±14.1 54.45±21.3>0.0552.23±10.556.12±18.6 52.56±14.5>0.05534.54±96.6 254.68±63.7 234.78±53.7<0.05504.62±90.2 205.94±82.7 201.55±52.6<0.05204.72±64.9 78.72±14.7 68.72±32.7<0.05198.21±64.7 59.83±10.0 54.83±10.2<0.05
本研究A组49例患者中,术中平均出血量、术后并发症发生率均比半肝入肝血流阻断和改良式无血半肝切除术高。术后B、C组3 d和7 d的血清转氨酶明显低于A组,且下降程度也较之明显;A组TB胆红素术后3、7 d下降速度较B、C组慢;A组CHE和ALB术后恢复时间较B、C组慢,这些都说明,全肝入肝血流阻断对肝功能损害最大,恢复亦最慢。同时,通过对三组患者术中、术后比较情况的分析,采用改良Belghiti肝提拉法的患者术中出血量明显低于A组和B组患者,差异有统计学意义(P<0.05)。且引流量少,住院时间短,与其他组相比差异有统计学意义(P<0.05)。
综上所述,改良Belghiti肝提拉法无血半肝切除术与传统手术方式相比术中出血少,安全性高,可有效减少并发症的发生,是一种安全合理的手术方式。
[1] Makuuchi M,Mori T,Gunven P,et al.Safety of hemihepatic vascular occlusion during resection of the liver[J].S.G.O, 1987,164:155-158.
[2] Belghiti J,Guevara OA,Noun R,et al.Liver hanging maneuver:a safe approach to right hepatectomy without liver mobilization[J].Am Coll Surg,2001,193(1):109-111.
[3] Gutierrez G.Cellular energy metabolism During hypoxia[J].Crit Care Med,1991,19(5):619-626.
[4] Kim YI,Song KE,Kim JW,et al.Enhanced inflammatory cytokine production at ischemia/reperfusion in human liver resection[J].Hepatogastroenterology,2002,49(46):1077-1082.
[5] Garcea G,Gescher A,Steward W,et al.Oxidative stress in humans following the Pringle maneuver[J].Hepatobiliary Pancreat Dis Int,2006,5(2):210-214.
[6] 李远征,刘胜利.肝脏手术中控制出血的方法及评价[J].中南大学学报:医学版,2012,31(3):373-377.
[7] FU SY,LAU WY,LI AJ,et al.Liver resection under total vascular exclusion with or without preceding Pringle manoeuvre[J].Br J Surg,2010,97(1):50-55.
[8] 傅思源,孙玉明,李爱军,等.全肝血流阻断和肝静脉阻断对肝肿瘤切除术中血流动力学的影响比较[J].肝胆胰外科杂志,2010,22(3):196-199.
