大蒜绿变过程中几种关键物质的变化规律*
2012-09-12郝晓然牟聪华乔旭光
郝晓然,牟聪华,乔旭光
(山东农业大学食品科学与工程学院,山东 泰安,271018)
大蒜绿变过程中几种关键物质的变化规律*
郝晓然,牟聪华,乔旭光
(山东农业大学食品科学与工程学院,山东 泰安,271018)
研究测定了4℃贮藏条件下大蒜绿变强度、三羧酸循环中间物有机酸和δ-氨基酮戊酸(aminolevulinic acid,ALA)含量的变化。结果表明:随着贮藏时间的延长,大蒜绿变强度增大,柠檬酸、α-酮戊二酸、延胡索酸含量和ALA含量均明显增加。经钙离子调控三羧酸循环后,大蒜的绿变强度、柠檬酸和α-酮戊二酸含量逐渐升高,延胡索酸含量逐渐降低;经丙二酸调控三羧酸循环后,大蒜绿变强度先升高后降低,延胡索酸含量显著降低,表明三羧酸循环可以影响大蒜绿色素的形成。
大蒜绿变,柠檬酸,α-酮戊二酸,延胡索酸,δ-氨基酮戊酸
大蒜(Allium Sativum L.)鳞茎具有极高的营养价值,含有蛋白质、糖类、脂肪、维生素和钙、磷、铁、硒、锗等矿物元素。另外,大蒜及其制品还有很高的药用价值,有杀菌、防止动脉粥样硬化和血小板凝集、防止血栓的形成、抗糖尿病、提高机体的免疫能力等多方面的作用[1]。但是大蒜在加工过程中,特别是解除休眠以后,容易发生绿变现象,严重影响大蒜制品的外观质量和品质[2],成为妨碍大蒜深加工,造成大蒜生产加工企业严重经济损失的主要问题。
目前已有研究人员通过 Paar-Knnor反应[3,4],用6种包括甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸等侧链较小的疏水氨基酸与2,5-二甲氧基四氢呋喃体外合成吡咯基氨基酸,通过加入外源吡咯基缬氨酸可使大蒜变绿,证明了它可能就是大蒜绿色素的前体物质[5]。Shinsuke Imai等体外模拟色素形成时发现,丙烯基硫代亚磺酸酯与丙氨酸或缬氨酸反应生成N-(3,4-二甲基)吡咯基氨基酸类化合物,此物质再与烯丙基硫代亚磺酸酯生成紫红色素[6]。陈聪采用固相萃取法,吸附树脂法和凝胶层析法对大蒜绿色素进行了分离纯化,通过核磁共振对绿色素结构进行了鉴定。研究得出绿色素的分子量为527,初步判断其结构含有吡咯环[7]。Wang D等用丙酮酸分别与P-甘氨酸、P-缬氨酸和P-异亮氨酸反应制得三种黄色素,鉴定结构发现均含有吡咯环[8];Hu D等制备的 P-天冬氨酸和 P-谷氨酸可以使新蒜发生绿变[9]。这些结果都直接证明了吡咯基化合物是大蒜绿色素的前体物质。
已有的研究表明大蒜绿色素不是叶绿素[19],其紫外可见吸收峰在 440nm 和 590nm[20,21],与叶绿素的吸收峰不同,但其生物合成途径可能与叶绿素的合成途径有相似之处。因此,本试验以低温强制解除休眠的大蒜为原料,测定大蒜绿变前后TCA中间物柠檬酸、α-酮戊二酸和延胡索酸含量的变化,分别采用钙离子和关键步骤酶琥珀酸脱氢酶的底物类似物丙二酸,控制循环的速度,促进琥珀酰CoA向吡咯基化合物的转化,揭示TCA与大蒜绿变的关系,以期从本质上阐明大蒜绿色素的生物合成途径,提出切实可行的生产上控制绿变发生的措施。
1 材料与方法
1.1 材料
贮藏在4℃中无病虫害、无机械损伤的邳州大蒜。
1.2 主要仪器
Unic UV-2000紫外分光光度计,尤尼柯(上海)仪器有限公司;TGL-18C高速台式离心机,上海安亭科学仪器厂;LC-20A高效液相色谱仪,日本岛津公司。
1.3 方法
1.3.1 大蒜绿变强度的测定
取大蒜鳞茎20.00 g除芽后捣碎,加入2%柠檬酸,搅拌均匀后于80℃水浴加热30 min,室温冷却后用95%乙醇定容至50 mL,4℃浸提24h,过滤后取上清液测定440 nm、590 nm处的吸光值。
定义:绿变强度=A590(440)×10。
1.3.2 TCA中间物有机酸对大蒜绿变的影响
1.3.2.1 有机酸含量测定方法
参考沈宏等[22]的方法。有机酸提取:取大蒜鳞茎1.00 g,除芽后加入2 mL去离子水研磨成浆,再加入3 mL去离子水将其洗入离心管中,9000 r/min离心30 min,取上清液经微孔滤膜(0.45 μm)过滤,用于测定TCA中有机酸。
参考崔玉林[23],李红卫等[24]的方法。测定条件:紫外检测器,Alltiman C18Column(250 mm×4.6 mm,5 μm)色谱柱,流速:0.4 mL/min,进样体积:20 μL,检测波长:214 nm,柱温:30℃,流动相:含5%甲醇的0.01 moL/L H3PO4-KH2PO4缓冲液(pH 2.35)。
1.3.2.2 钙离子处理大蒜的方法
1.4统计学方法应用SPSS13.0软件完成统计学分析,各组间计量资料比较采用成组t检验,各组采用均数±标准差(±s)表示,计数资料采用卡方检验,以P<0.05为差异有统计学意义。
挑选大小一致的大蒜,去皮剥瓣,切片除芽,取适量蒜片放到不同浓度的CaCl2溶液中浸泡15 min,室温(25℃)下沥干,在去离子水中浸泡的蒜片设为对照组,测定经不同浓度CaCl2溶液处理后大蒜的绿变强度和TCA中间物有机酸含量变化[25]。
1.3.2.3 丙二酸处理大蒜的方法
挑选大小一致的大蒜,去皮剥瓣,切片除芽,按大蒜质量添加不同浓度丙二酸破碎,以不加丙二酸的大蒜设为对照组,测定经不同浓度丙二酸处理后大蒜的绿变强度和延胡索酸含量变化。
1.3.3 ALA含量的测定
参考王凌健[26],郭进魁等[27]的方法。取大蒜鳞茎1.50 g,除芽后加入8 mL 4%的三氯乙酸溶液中研磨,离心后取上清液与乙酸钠缓冲液和乙酰丙酮混合,沸水浴中加热10 min,后冷却至室温,然后取样品液按照体积比1∶1的比例加入Ehrlich’s试剂,显色后于553 nm处测定吸光值。
1.3.4 数据处理及分析
数据用SAS9.0软件进行统计分析。
2 结果与分析
2.1 不同贮藏时间大蒜绿变强度
由图1可知,在4℃贮藏条件下,随着贮藏时间的延长,大蒜绿变强度逐渐增大。低温贮藏8 d以后,大蒜绿变强度急剧增大。低温贮藏有助于解除大蒜休眠,促进代谢水平提高,但由于合成叶绿素的途径在低温下受阻,导致大蒜绿色素合成物质的产生和积累,绿变现象加重。

图1 不同贮藏时间大蒜绿变强度变化
2.2 TCA中间物有机酸对大蒜绿变的影响
2.2.1 不同贮藏时间大蒜中TCA中间物有机酸含量的变化
图2表明,随着贮藏时间的延长,大蒜中柠檬酸、α-酮戊二酸和延胡索酸含量逐渐升高,与大蒜绿变强度变化趋势一致。

图2 不同贮藏时间大蒜中柠檬酸、α-酮戊二酸、延胡索酸含量变化
分别对不同贮藏时间大蒜绿变强度与柠檬酸、α-酮戊二酸和延胡索酸含量进行相关分析,如表1所示,大蒜绿变强度与柠檬酸、α-酮戊二酸和延胡索酸含量变化具有极显著相关性,进一步表明了大蒜解除休眠后,TCA增强,与大蒜绿色素生物合成有关的各种生理活动变得活跃,但由于低温条件下阻断了叶绿素的合成,造成吡咯基化合物累积,进而为大蒜绿色素的合成提供了物质条件。研究推测TCA对大蒜绿变的影响是经循环中间物α-酮戊二酸、琥珀酰CoA进入吡咯化合物合成途径,该吡咯化合物为大蒜绿色素的合成提供前体物质,进而证明TCA与大蒜绿变有关。
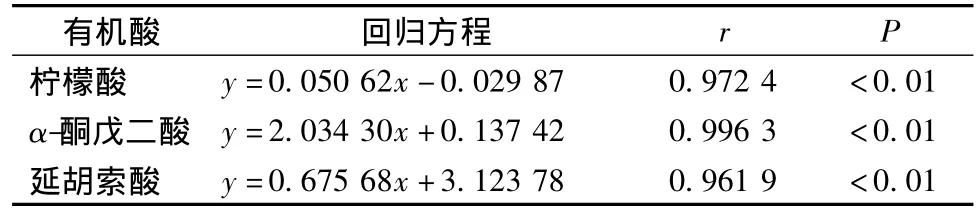
表1 有机酸和大蒜绿变强度(440 nm)相关性

表2 有机酸和大蒜绿变强度(590 nm)相关性
2.2.2 Ca2+调控TCA对大蒜绿变的影响
Ca2+对TCA中的丙酮酸脱氢酶、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶都有激活作用[28]。由图3、图4可看出,随着Ca2+浓度的增加,大蒜的绿变强度不断增大,柠檬酸和α-酮戊二酸含量增加显著,延胡索酸含量逐渐降低。

图3 不同浓度Ca2+处理大蒜后绿变强度变化
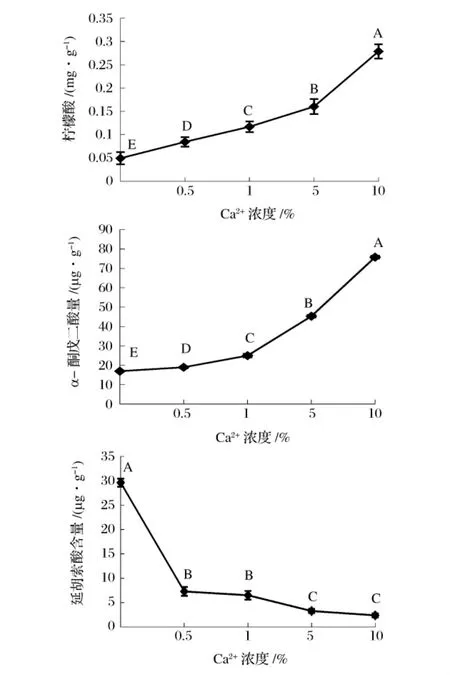
图4 不同浓度Ca2+处理大蒜后柠檬酸、α-酮戊二酸和延胡索酸含量变化
延胡索酸含量减少,可能是由于α-酮戊二酸经氧化脱羧生成琥珀酰CoA,之后转化形成吡咯基化合物,导致琥珀酰CoA向延胡索酸的转化量减少。这与4℃贮藏不同时间后大蒜TCA中间物有机酸含量变化的研究结果一致。
2.2.3 丙二酸调控TCA对大蒜绿变的影响
TCA中的琥珀酸脱氢酶可以催化琥珀酸向延胡索酸转化,丙二酸的分子结构与琥珀酸类似,所以可与琥珀酸竞争性地与酶的活性中心结合,是琥珀酸脱氢酶的竞争性抑制剂[18]。丙二酸与琥珀酸脱氢酶的亲和力远大于琥珀酸本身对它的亲和力,因此抑制作用很强,对其有很强的抑制作用。
由图5、图6可以看出,随着丙二酸浓度的增加,大蒜绿变强度先升高后降低,但均高于对照组。延胡索酸的含量逐渐降低,是由于丙二酸作用于琥珀酸脱氢酶,使其活性降低,导致琥珀酸积累,从而降低了琥珀酰CoA向琥珀酸的转化速率,利于琥珀酰CoA生成吡咯基化合物,所以大蒜绿变强度增大,延胡索酸生成量减小。丙二酸可以抑制细胞呼吸[18],当其浓度高于0.4%时,其抑制程度过大,阻断了TCA,导致琥珀酰CoA向吡咯基化合物转化反应受阻,大蒜绿变强度开始降低。
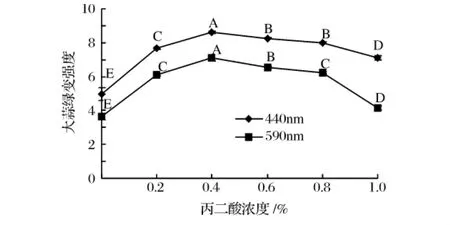
图5 不同浓度丙二酸处理大蒜后绿变强度变化
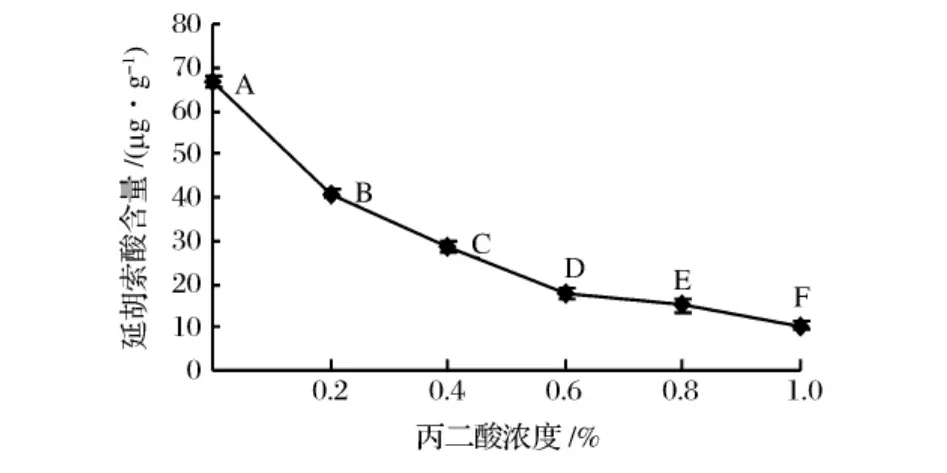
图6 不同浓度丙二酸处理大蒜后延胡索酸含量变化
3 ALA与大蒜绿变的关系
崔海瑞等[16]研究表明低温条件下水稻ALA积累量明显高于高温条件下。由图7可以看到随着贮藏时间延长ALA含量不断增加。对不同贮藏时间大蒜绿变强度与ALA含量进行相关分析,结果表明,在440 nm和590 nm测定条件下,大蒜绿变强度与ALA含量之间的相关系数分别是 r=0.9795**和r=0.9978**,呈现极显著相关性,表明ALA是大蒜绿色素生物合成的关键物质。

图7 不同贮藏时间大蒜ALA含量的变化
,4 结论
4℃贮藏条件下,随着贮藏时间的延长,TCA中间物柠檬酸、α-酮戊二酸、延胡索酸的含量不断增加,与绿变强度变化相关性极显著;ALA含量不断升高,且与绿变强度相关性极显著。表明TCA可促进大蒜绿色素前体吡咯基化合物的生成,与大蒜绿变密切相关。
Ca2+调控 TCA后,随着 Ca2+浓度的增加,TCA中间物柠檬酸、α-酮戊二酸的含量明显增高,延胡索酸含量显著降低,绿变强度增大;丙二酸调控TCA后,随着丙二酸浓度的增加,大蒜绿变强度先升高后降低,延胡索酸含量显著降低。进一步表明TCA影响与大蒜绿色素生物合成有关的生理活动。推测TCA对大蒜绿变的影响是经循环中间物α-酮戊二酸、琥珀酰CoA进入吡咯化合物合成途径,该吡咯化合物为大蒜绿色素的合成提供前体物质。
[1]王岩,乔旭光.大蒜绿变物质的提取及其分离[J].食品与发酵工业,2006,32(3):106-108.
[2]Jungeum Cho,Eun Jin Lee,Kil Sun Yoo,et al.Identification of candidate amino acids involved in the formation of blue pigments in crushed garlic cloves(Allium sativum L.)[J].Journal of Food Science,2009,74(1):C11-C16.
[3]Uemura J,Miyahara M,Matsumoto T,et al.Effect of electric field on the defrosting rate of frozen pork[J].Journal of the Japanese Society for Food Science and Technology,2005,52(7):311-314.
[4]Castro I,Macedo B,Teixeira J A,et al.The effect of electric field on important food-processing enzymes:compaison of inactivation kinetics under conventional and ohmic heating[J].Journal of Food Science,2004,69(9):C696-C701.
[5]Wang D,Nanding H,Han N,et al.2-(1Hpyrrolyl)carboxylic acids as pigment precursors in garlic greening[J].Journal of Agricultural and Food Chemistry,2008,56:1495-1500.
[6]Imai S,Akita K,Tomotake M,et al.Identification of two novel pigment precursors and a reddish-purple pigment involved in the blue-green discoloration of onion and garlic[J].Journal of Agricultural and Food Chemistry,2006,54:843-847.
[7]陈聪.大蒜绿变色素分离纯化及结构鉴定[D].泰安:山东农业大学,2008.
[8]Wang D,Yang X,Wang Z,et al.Isolation and identification of one kind of yellow pigments from model reaction systems related to garlic greening[J].Journal of Food Chemistry,2009,117(2),296-301.
[9]Hu D,Zhang J,Zhang T,et al.Characterization of yellow pigments formed on reaction of 2-(1H-pyrrolyl)carboxylic acids with pyruvic aicd in garlic greening model systems[J].Journal of Food Research International,2010,43,915-921.
[10]程智慧,杜慧芳,孟焕文.大蒜鳞茎采后呼吸及芽形态变化与品种和温度的关系[J].绵阳农专学报,1996,13(2):7-12.
[11]姜华武,王琳.大蒜鳞茎休眠解除后的生理生化变化[J].湖北农学院学报,1998,18(4):315-317.
[12]周莉蓉,于珊珊.不同低温贮藏对大蒜理化指标的影响[J].贮藏与加工,2007(10):21-23.
[13]张伟成,严文梅.温度对大蒜鳞茎休眠的影响及其在贮藏保鲜上的应用[J].植物生理学通讯,1998(1):25-29.
[14]李蕾,赵广华,胡小松,等.硫代亚磺酸酯参与大蒜绿变作用机理初探[J].中国调味品,2005(7):13-17.
[15]王岩,乔旭光.大蒜绿变机理的研究进展[J].中国食物与营养,2005(11):23-25.
[16]崔海瑞,夏英武,高明尉.温度对水稻突变体W1叶色及叶绿素生物合成的影响[J].核农学报,2001,15(5):269-273.
[17]和红云,薛琳,田丽萍,等.低温胁迫对甜瓜幼苗叶绿素含量及荧光参数的影响[J].北方园艺,2008(4):13-16.
[18] 王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.366-368.
[19]Joslyn M A,Sano Tatsuo.The formation and decomposition of green pigment in crushed garlic tissue[J].Journal of Food Science,1956,21:170-183.
[20]赵晓丹.醋浸绿蒜的功能及其绿变色素的分离、性质研究[D].北京:中国农业大学,2005.
[21]王岩.大蒜绿色素提取、分离及其性质的研究[D].泰安:山东农业大学,2006.
[22]沈宏,严小龙,郑少玲,等.菜豆有机酸和无机阴离子同时分析的离子色谱法[J].华南农业大学学报,2001,22(2):8-10.
[23]崔雨林,戴蕴青,韩雅珊.高效液相色谱法测定水果及其果汁中的几种有机酸[J].北京农业大学学报,1995,21(1):39-43.
[24]李红卫,尹秀华,冯双庆,等.简易气调贮藏对冬枣果实乙醇、有机酸含量及相关酶活性的影响[J].农业工程学报,2005,1(4):172-175.
[25]施瑞城,周丽珍,张熙新,等.钙处理对芒果采后生理的影响[J].热带作物学报,2000,20(1):52-55.
[26]王凌健,倪迪安,叶瘕丰,等.植物叶片中δ-氨基乙酰丙酸的测定[J].植物生理学通讯,1997,35(6):439-441.
[27]郭进魁,毕玉蓉,李红玉,等.外源Narciclasine对黄化植物中δ-氨基乙酰丙酸生物合成的抑制作用及其与6-BA和ABA作用的关系[J].植物生理学报,2000,26(5):437-440.
[28]Brookes P S,Yoon Y,Robotham J L,et al.Calcium,ATP,and ROS:a mitochondrial love-hate triangle[J].American Journal of Physiology Cell Physiology,2004,287:C817-C833.
ABSTRACTIn order to determine the biosynthesis of garlic greening,the contents of citric acid,α-ketoglutarate,fumarate and δ-ALA were investigated.The results showed that with the storage time prolonged,the contents of citric acid,α-ketoglutarate,fumarate and ALA increased significantly,the strength of garlic greening was with the same trend.Treatment with Ca2+could increase the content of citric acid,α-ketoglutarate and the strength of garlic greening,but decrease the content of fumarate significantly.Malonic acid can reduce the content of fumarate significantly,the garlic greening rate increased first and then decreased slightly.It showed that tricarboxylic acid cycle and biosynthesis of garlic green pigment was correlated.
Key wordsgarlic greening,citric acid,α-ketoglutarate,fumarate,δ-aminolevulinic acid
Effects of Several Key Substances on Garlic Greening
Hao Xiao-ran,Mou Cong-hua,Qiao Xu-guang
(College of Food Science and Engineering,Shandong Agricultural University,Tai’an 271018,China)
硕士研究生(乔旭光教授为通讯作者,Email:xgqiao@sdau.edu.cn)
*国家自然科学基金(30972040)和高等学校博士学科点专项科研基金(20093702110002)资助
2012-02-14,改回日期:2012-04-18
