花生中辅酶Q10的提取工艺及含量测定*
2012-09-12王改玲宋瑞雯陶志杰孙晓侠
王改玲,宋瑞雯,陶志杰,孙晓侠
1(蚌埠学院生物与食品工程系,安徽蚌埠,233030)
2(辽宁师范大学生命科学院,辽宁大连,116081)
花生中辅酶Q10的提取工艺及含量测定*
王改玲1,宋瑞雯2,陶志杰1,孙晓侠1
1(蚌埠学院生物与食品工程系,安徽蚌埠,233030)
2(辽宁师范大学生命科学院,辽宁大连,116081)
花生中富含辅酶Q10,以高效液相色谱法测量的辅酶Q10含量为指标,系统研究了利用超声波细胞破碎仪从花生中提取辅酶Q10时不同提取条件对其含量的影响。结果表明:4个因素对提取率影响大小的顺序为:提取功率>提取时间>单次辐射时间>料液比,其中提取功率和提取时间对花生中辅酶Q10的提取率有极显著影响。最佳工艺参数为:提取功率400 W,提取时间15 min,单次辐射时间为6.0 s/5.0,料液比为1∶6,在此条件下花生中辅酶 Q10的提取率为92.4 μg/g。
花生,辅酶Q10,高效液相色谱法
辅酶Q10是一种脂溶性的类维生素物质,广泛存在于动物、植物、微生物等细胞的线粒体上,主要结合在线粒体内膜上,构成呼吸链中的重要递氢体。具有清除自由基、维持细胞膜的通透性和提高机体自身免疫力的功能,对心脏、肝脏和肾脏有较好的保健作用,在临床上广泛用于心血管疾病、肝病、中风和癌症的治疗[1-2]。此外,由于辅酶Q10所具有的独特生理活性在食品添加剂、化妆品等行业也具有广阔的应用前景。资料显示,目前全球辅酶Q10的年消费量高达500多吨,而我国年需求量约为60多吨。目前辅酶Q10的制备方法主要有生物组织提取法、微生物发酵法和化学合成法3种[3-5]。对辅酶Q10的生物组织提取主要集中在烟草等植物,而研究表明花生中也含有大量的辅酶Q10[6],而关于花生中辅酶Q10报道很少,本课题组主要研究如何利用当地的大量花生资源,从中制备辅酶Q10,旨为花生中辅酶Q10的开发利用奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
花生,购自安徽蚌埠。
三氯甲烷、丙酮、乙酸乙酯、无水乙醇等试剂均为分析纯(国药集团化学试剂有限公司);辅酶Q10标准品(阿拉丁试剂,分析标准品≥98%);HPLC所用流动相为色谱级甲醇。
高效液相色谱仪(Waters 2487紫外检测器,Wa-ters 1575二元泵);UH-500B型超声波细胞粉碎仪,天津奥特赛恩斯仪器有限公司;RE52CS型旋转蒸发仪,上海亚荣生化仪器厂;BS224S型电子分析天平,北京赛多利斯仪器系统有限公司;FW-100型高速万能粉碎机,北京市永光明医疗仪器厂。
1.2 实验方法
1.2.1 标准溶液的配制
准确称取辅酶Q10标准品10 mg于25 mL棕色容量瓶中,加无水乙醇适量振摇溶解并稀释至刻度。制成400 μg/mL的标准储备液。准确量取储备液0.1、1、2、4、6 mL分别置于10 mL容量瓶中并用无水乙醇定容至刻度,制成系列标准溶液待测。
1.2.2 辅酶 Q10含量测定
采用HPLC法测定辅酶Q10含量,色谱条件为:以V(甲醇)∶V(乙醇)=30∶70为流动相,色谱柱温度:35℃;流速:1 mL/min;样品进样体积 20 μL;检测波长:275 nm。记录辅酶Q10峰面积,利用回归方程求的其含量。
1.2.3 辅酶 Q10提取方法[7]
称取干燥粉碎好的样品5 g置于50 mL离心管中,加入30 mL甲醇,浸提5min,离心(3000 r/min,10 min)去上清液。固形物中加30 mL溶剂,不同条件下利用超声波破碎仪提取。提取液离心得上清液,重复一次,合并上清液。将上清液减压浓缩至半干,浸膏中加5 mL流动相,在超声波清洗仪中溶解3 min,溶液用0.45 μm滤膜过滤,收集滤液待测。
1.2.4 单因素试验
以提取量为测定指标,进行单因素试验以确定提取溶剂、超声波输出功率、超声波单次辐射时间、提取总时间、料液比5个因素对辅酶Q10提取量的影响。
1.2.5 正交试验
在单因素试验的基础上,进行4因素3水平正交试验,采用L9(34)正交实验设计方案进行优化提取实验,因素水平见表1。

表1 正交试验因素水平表
2 结果与分析
2.1 线性范围和精密度试验
取标准系列溶液进行HPLC进样分析,进样量10 μl,以峰面积对浓度进行线性回归,得到回归方程Y=11798X+1370.4。R2=0.9992(n=5)表明辅酶Q10在4~240 μg/mL内积分面积和浓度线性关系良好。取浓度80 μg/mL的标准溶液连续进样5次,其峰面积RSD=0.5%。
2.2 单因素试验
2.2.1 不同提取溶剂对辅酶Q10提取量的影响
在其他超声波提取条件固定的情况下,利用不同的溶剂提取发现。如图1所示,不同提取溶剂提取效果差异较大。乙醇溶液的提取率最低仅为33 μg/g,三氯甲烷和乙酸乙酯的提取率较高,可以达到81 μg/g,且两者相差不大。考虑到三氯甲烷对人体危害性大于乙酸乙酯,故选用乙酸乙酯作为提取溶剂。同时发现,如果在用超声波细胞破碎仪提取前用甲醇处理,4种溶剂的提取率都有所提高,其中乙酸乙酯提高了8﹪。而且得到的色谱图较没用甲醇处理的杂质数量要少些,峰型也要好一些。主要可能因为用甲醇短时间处理可以去点一些脂溶性杂质,同时也使溶剂的的细胞组织穿透力增强,有利于目标成分的提取。
2.2.2 超声波提取时间对辅酶Q10提取量的影响
如图2所示,在其他提取条件相同的情况下,随着提取时间的延长,辅酶Q10的提取率有明显增高的趋势,提取5min时辅酶Q10含量仅为37 μg/g,当提取时间为10 min时,辅酶Q10含量增高了48%。15 min后,辅酶Q10含量达到最高88 μg/g。然而其含量并没有随着时间的延长一直增高。提取20 min时含量较15 min时不但没有增加,反而呈下降趋势,这可能是因为随着提取时间的延长,大量辅酶Q10被提取到溶剂中,但是同时由于受氧气和光照的影响辅酶Q10也在不断地降解而导致的。同时考虑到提取时间越长杂质含量也越多,为后面的纯化分离增加困难,因此,选用提取时间15 min为最佳提取时间。
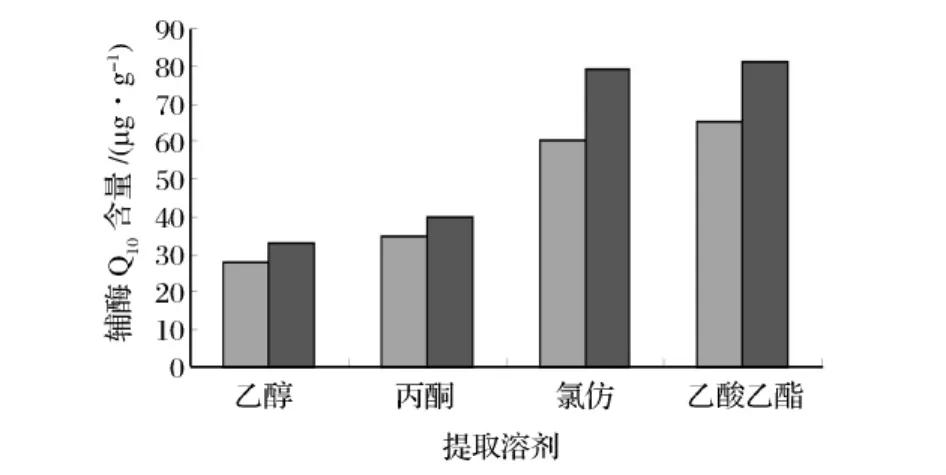
图1 不同提取溶剂对辅酶Q10提取量的影响

图2 超声波提取时间对辅酶Q10提取量的影响
2.2.3 超声波提取功率对辅酶Q10提取量的影响
从图3可以看到,辅酶Q10提取量随着超声波提取功率的增加呈先升后降的趋势。提取功率小于200 W时辅酶Q10含量较低,考虑主要可能是因为功率过小,花生组织不能被完全破坏,使得辅酶Q10不能完全溶解到溶剂中,增加功率有利于溶剂中空穴效应的形成,从而产生大量空化泡,使得破碎作用加强,大量辅酶Q10被释放到溶剂中,故提取功率从100 W升到400 W时辅酶Q10含量随提取功率的增加而增加。然而提取功率>400 W时辅酶Q10含量却又呈下降趋势,主要可能是由于超声波处理引起的局部高温高压使溶液中H和OH自由基含量增加而导致辅酶Q10氧化降解[8]。故选择超声波提取功率400 W为花生中辅酶Q10的最佳提取功率。
2.2.4 超声波单次辐射时间对辅酶Q10提取量的影响

图3 超声波提取功率对辅酶Q10提取量的影响
在超声波提取功率为400 W,提取时间15 min,料液比例为1∶5的条件下,由图4可知,超声波单次辐射时间在6.0~8.0 s,间歇时间5 s时提取效果较好。超声波破碎细胞的过程也就是空化泡形成、震动、膨胀、压缩和崩溃闭合的过程[9,10]。当单次辐射时间低时,辅酶Q10提取量较少,这是由于辐射时间过短,超声波空化效应不能发挥爆裂破壁作用导致的。但是当单次工作时间超过8.0 s后,虽然能产生大量空化泡而是细胞破裂,但同时会产生较多活性氧而引起辅酶Q10含量下降。因此,最佳的单次超声时间/间歇时间为 6.0 s/5.0 s~8.5 s/5.0 s。

图4 超声波单次辐射时间对辅酶Q10提取量的影响
2.2.5 料液比对辅酶Q10提取量的影响
由图5可以看出,提取溶剂量为20 mL时,辅酶Q10提取量较小,这一方面是因为溶液中花生组织浓度大,不利于空化泡的形成;另一方面是因为提取溶液少时,溶液中的辅酶Q10浓度较大,在离心过滤时大量辅酶Q10黏附在花生残渣上损失而导致含量减少。当料液比大于1∶5时,增加料液比对辅酶Q10提取量的影响幅度不是很大。料液比从1∶4增加到1∶5,辅酶Q10提取量提高了32%,而料液比从1∶5增加到1∶8,辅酶Q10提取量仅仅提高了26%。这主要是因为利用超声波细胞破碎仪提取不同于传统的浸提法,提取量受细胞内外浓度差的影响较小。料液比大于1∶8后,提取量下降可能是由于溶剂量加大后,超声波在溶剂中传递的损失增大,细胞破碎效果变差导致的。故料液比为1∶7为花生中辅酶Q10的最佳溶剂用量。
2.3 正交试验

图5 料液比对辅酶Q10提取量的影响
超声波破碎法提取花生中辅酶Q10的正交试验结果见表2,方差分析结果见表3。

表2 正交试验结果

表3 正交试验方差分析结果
从表2和表3可以看出超声波功率和提取时间对辅酶Q10提取量有极显著影响,超声波单次辐射时间影响显著,而料液比对辅酶Q10提取量的影响较小。4个因素对提取率影响大小的顺序为:提取功率>提取时间>单次辐射时间>料液比。综合各因子的k值比较可得到A2B2C3D3为最佳提取条件,即提取时间15 min,输出功率400 W,单次辐射时间10.0 s/5.0 s,溶剂用量为 40 mL,即料液比为 1∶8。取 5份花生材料在此条件下做验证试验得辅酶Q10平均提取量为 92.4 μg/g,RSD=1.18%
2.4 超声波破碎仪提取与传统提取方法比较
取5 g花生材料3份,分别采用浸提法、超声波破碎仪提取和碱醇皂化法提取[4-5],结果显示超声波法辅助提取效果更佳,辅酶Q10提取量为91.9 μg/mL,碘醇皂化法辅酶Q10提取量为56.3 μg/mL,普通浸提法提取量最低仅有30 μg/mL。所以用超声波破碎仪提取辅酶Q10操作简便,省时,提取效率高。
3 结论
本研究优化了超声波破碎仪提取辅酶Q10的提取工艺,确定最佳提取工艺为提取时间15 min,输出功率400 W,单次辐射时间10.0 s/5.0 s,溶剂用量为40 mL,即料液比为1∶8。在该条件下辅酶Q10平均提取量高达92.4 μg/g。和其他传统方法相比,提取率高,省时省力,且操作方便。对于花生中的辅酶Q10的工业化提取具有良好的应用前景。后续的研究工作主要集中在如何分离富集花生中的辅酶Q10。
[1]桑艳双,魏敏吉.辅酶Q10的生化作用机理和药物临床应用进展[J].中国医药导刊,2005,7(5):371-373.
[2]张楠,曹玉成.辅酶Q10制备方法研究进展[J].榆林学院学报,2006,16(6):12-14.
[3]王青云,王发祥.微生物发酵法生产辅酶Q10的研究进展[J].化学与生物工程,2006,23(8):11-13.
[4]吕茂春,李英华,安艳秋,等.辅酶Q10几种提取工艺的优化研究[J].食品科学,2007,28(12):132-135.
[5]龙海燕,郭育涛,邢远清.超声辅助皂化提取黑曲霉中辅酶Q10的研究[J].应用化工,2007,36(3):265-269.
[6]张姣勤,陈军,李子雨,等.花生功能活性成分研究进展[J].粮油加工,2008,12:73-76.
[7]王辛,乔海鸥,穆敏杰.保健食品中辅酶Q10含量的测定及其提取条件的研究[J].中国卫生检验杂志,2008,18(7):1321-1323
[8]李聚海,岳田利,袁亚宏.辅酶Q10超声波破碎法提取工艺条件研究[J].西北农林科技大学学报,2007,35(5):207-211.
[9]欧阳琴,陈兴才,黄亚治.雨生红球藻提取虾青素不同机械破壁方法的研究[J].福州大学学报:自然科学版,2005,33(1):111-115.
[10]许晖,孙兰萍,李善菊.等.超声波辅助提取亚麻籽油的工艺条件优化[J].中国粮油学报,2009,24(7):64-68.
ABSTRACTPeanut contains coenzyme Q10,the content of Q10was detected by HPLC.The effect of different conditions by using ultrasonic cell-break method for extraction was systematically studied.The results showed that the size order of influence by four factors on the extraction rate was:extraction power>extraction time>duration of radiation each time>ratio of material to liquid.The power extraction and extraction time had significant effect on the extraction rate of coenzyme Q10.The optimal condition for coenzyme Q10extraction was as follows:400W,extraction time:15min,duration of radiation:6.0s/5,ratio of solid to liquid:1∶6.Under this condition,the coenzyme Q10extraction rate was 92.4ug/g.
Key wordspeanut,coenzyme Q10,HPLC
Extraction Technology and Content Determination of Coenzyme Q10in Peanut
Wang Gai-ling1,Song Rui-wen,Tao Zhi-jie1,Sun Xiao-xia1
1(Department of Biology and Food Engineering,Bengbu College.Anhui,Bengbu 233030,China)
2(Life Science College,Liaoning Normal University,liaoning,Dalian 116081,China)
硕士研究生,讲师(陶志杰为通讯作者)。
*蚌埠学院院级科研项目(2010ZR17)
2012-04-02,改回日期:2012-04-26
