正交实验法优化牛鼻软骨中硫酸软骨素的醇沉工艺
2012-09-12李利晓夏延斌
李利晓,夏延斌,2,*
(1.湖南农业大学食品科技学院,湖南长沙 410128;2.国家蔬菜加工技术研发分中心,湖南长沙 410128)
正交实验法优化牛鼻软骨中硫酸软骨素的醇沉工艺
李利晓1,夏延斌1,2,*
(1.湖南农业大学食品科技学院,湖南长沙 410128;2.国家蔬菜加工技术研发分中心,湖南长沙 410128)
研究牛鼻软骨碱提液中硫酸软骨素的醇沉工艺。通过单因素和正交实验对醇沉工艺进行优化,确定的最佳条件是:乙醇浓度65%,乙酸钠浓度4.5%,pH6.0。在该条件下,提取率为14.81%,葡萄糖醛酸含量33.36%,硫酸软骨素纯度达85.9%。紫外光谱分析:样品在196nm处有多糖的吸收峰,未见蛋白质(280nm)与核酸(260nm)的特征吸收峰。
正交实验,硫酸软骨素,醇沉工艺
Abstract:The ethanol deposition technology of chondroitin sulfate was studied in the paper,witch was extracted from bovine nose cartilage hydrolyzed by alkaline solution.The optimal ethanol deposition conditions of chondroitin sulfate were explored by single factor and orthogonal experiments to be ethanol solution of 65%,sodium acetate solution of 4.5%,pH6.0.Under the optimal conditions,the yield was 14.81%,the content of glucuronic acid was 33.36%,the purity quotient of chondroitin sulfate was 85.9%.UV analysis revealed that the absorption peak of chondroitin sulfate appears at 196nm,while characteristic absorption peaks of protein(280nm)and nucleic acid(260nm)were not found.
Key words:orthogonal test;chondroitin sulfate;ethanol precipitation techniques
硫酸软骨素(Chondroitin Sulfate,ChS)是来自动物喉骨、鼻软骨、气管等富含软骨组织的一类重要酸性黏多糖,根据分子结构中糖环上硫酸酸基取代位置的不同,主要分为硫酸软骨素A和硫酸软骨素C两种类型。ChS具有多种生物活性,具有抗炎、抗癌、抗HIV、降血脂、抗凝血活性、预防关节炎、减轻打鼾、改善食物风味、口感、光泽,保湿性[1-3]等重要生物活性。目前,临床医学上已用于骨关节炎(OA)、冠心病[4]、偏头痛[5]等;生物医学中主要用于生物膜、活性脚手架、人工骨类的构建;同时也广泛用于化妆品和保健食品[6]等行业,有非常广阔的开发前景。中国牛饲养量占据世界首位,牛骨综合利用率低,牛软骨中含有丰富的硫酸软骨素,以前文献也没有系统的报道过以牛骨为原料提取硫酸软骨素的醇析工艺。因此,本文以牛鼻软骨为原料,旨在充分从牛鼻软骨粉的碱提液中醇析出硫酸软骨素的有效成分,采用正交和单因素相结合的实验方法对硫酸软骨素的醇沉工艺进行探讨,为硫酸软骨素的纯化精制工艺提供实验基础。
1 材料与方法
1.1 材料与仪器
软骨粉碱提液 实验室自制(保存在4℃);无水乙醇、无水乙酸钠、浓硫酸、咔唑、色谱纯乙腈、戊烷磺酸钠等 均为分析纯,国药集团化学试剂有限公司;硫酸软骨素A Sigma公司。
富磁pHS-3C pH计 上海精隆科学仪器有限公司;DHG-924OA电热恒温鼓风干燥箱 上海飞越实验仪器有限公司;UV-2450岛津紫外分光光度计 日本岛津公司;Agilent1100serie高效液相色谱仪。
1.2 实验方法
1.2.1 碱提液醇沉工艺[7-9]碱提液→调节pH→4000r/min,离心20min过滤→取上清液→加入无水乙酸钠、无水乙醇至一定浓度→4℃静置一夜→5000r/min,离心20min过滤→洗涤60℃干燥→粗品粉末
1.2.2 醇沉工艺的正交和单因素实验 影响硫酸软骨素醇沉工艺的因素很多,在参考文献[10-13]的基础上,选用乙酸钠浓度、pH、乙醇浓度三个关键因素作为实验因素,以硫酸软骨素提取率、葡萄糖醛酸含量为指标,进行三因素三水平L9(33)的正交实验,确定最佳醇沉工艺参数,正交实验设计见表1所示,然后在正交实验的基础上进行单因素实验,进一步的优化醇沉工艺参数。

表1 正交实验的因素水平设计Table 1 Factors and levels of orthogonal experiments
1.2.3 测定方法
1.2.3.1 硫酸软骨素提取率测定 硫酸咔唑法[14-16]:硫酸软骨素中主要包含葡萄糖醛酸(GlcA)、氨基己糖和硫酸根,样品中葡萄糖醛酸的总质量能间接反映硫酸软骨素的含量,而且测定方法简单,可以进行大规模筛选实验,本文主要以粗品中葡萄糖醛酸的总质量(硫酸咔唑法)反映硫酸软骨素提取率的高低。
1.2.3.2 标准曲线的制作 精密量取对照品溶液(40μg/mL):0、0.1、0.2、0.4、0.6、0.8、0.9、1.0mL分别置于25mL具塞试管,用蒸馏水定至1mL,混匀,得到一系列的葡萄糖醛酸标准溶液。于冰盐浴条件下缓缓加入5mL 0.025mol/L四硼酸钠溶液-浓硫酸,其间注意避免出现沸腾的现象。置于90℃水浴加热20min(中间振摇一次),迅速冷却,分别加0.2%咔唑-无水乙醇溶液0.2mL,摇匀,置于90℃水浴中,加热20min(中间振摇一次),冷却至室温于530nm比色,根据吸光值(y)和葡萄糖醛酸的浓度(x)绘制其标准曲线,得y=0.0113x+0.002,R=0.9996。
1.2.3.3 样品中糖醛酸含量测定 取供试品溶液1mL(40~100μg/mL),同时做3个重复,以蒸馏水作为参比,按上述标准曲线的测定方法,分别测定其吸光度,计算样品中的葡萄糖醛酸含量。

式中:m为粗品中葡萄糖醛酸总质量(g);M1为风干粗品质量(g)。

式中:m为粗品中葡萄糖醛酸总质量(g);M为原料风干样品质量(g)。
1.2.3.4 硫酸软骨素纯度测定 液相色谱法[18]。
1.2.3.5 硫酸软骨素的紫外光谱分析[19-20]以蒸馏水调零,在190~400nm波长范围内对0.5mg/mL的多糖溶液进行紫外扫描,观察260和280nm处多糖水溶液的紫外吸收情况。
1.2.3.6 数据处理 采用minitab15和Excel2003进行数据处理。
2 结果与分析
2.1 醇沉工艺的正交实验[21]
将碱提取液平均分成9等份,按表1条件进行醇沉。数据处理采用加权评分法,评分标准为:设定葡萄糖醛酸含量(X)和硫酸软骨素提取率(Y)两者的权重系数均为1,对两项指标进行加权求和。通过公式Z=X+Y,得到综合评分(Z),正交实验结果见表2,方差分析结果见表3。
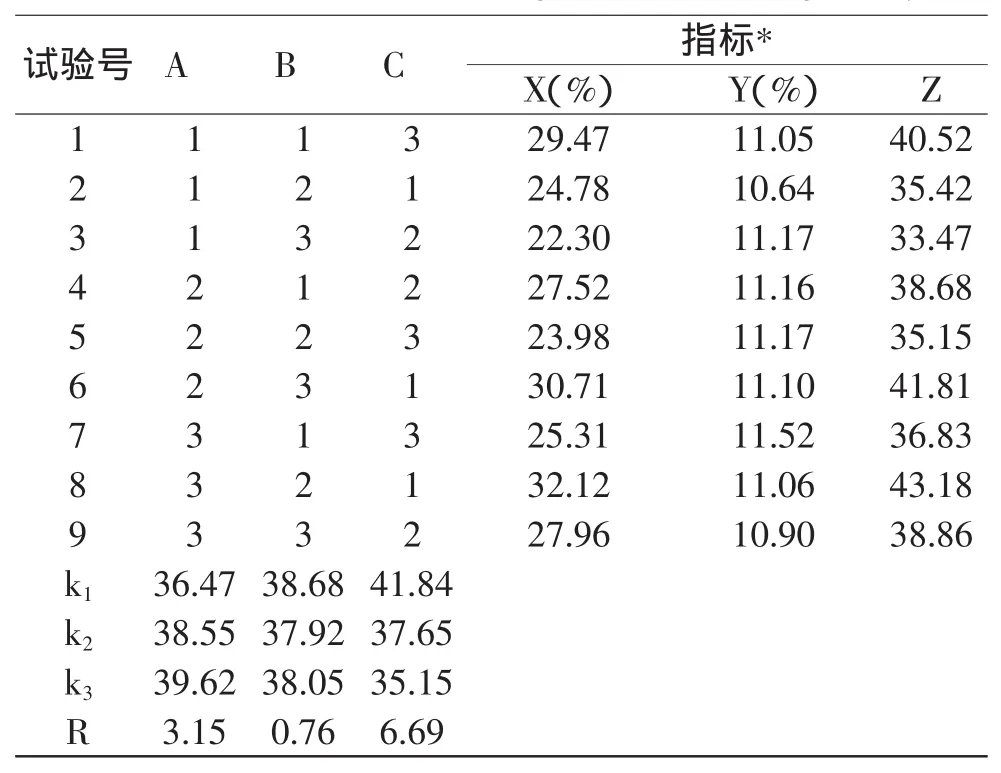
表2 正交实验结果Table 2Results of L9(34)orthogonal test and range analysis
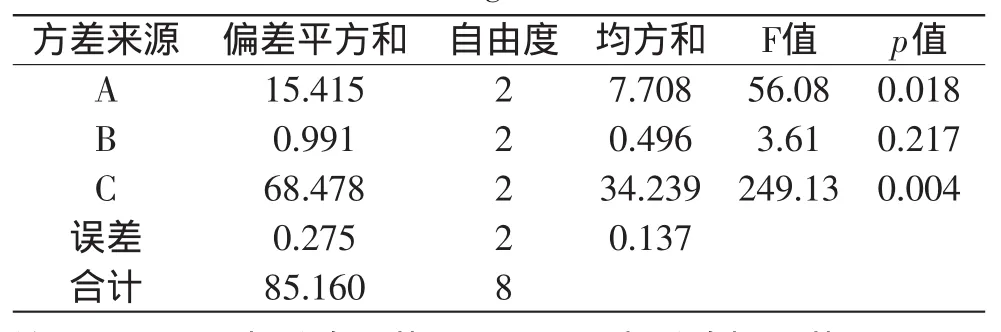
表3 正交实验综合评分的方差分析表Table 3 Analysis of variance for results of comprehensive score of orthogonal test
注:p<0.05,因素影响显著;p<0.01,因素影响极显著;p>0.05,因素影响不显著。
由表2可知,影响硫酸软骨素醇沉工艺的主次因素顺序为:乙醇浓度(C因素)>乙酸钠浓度(A因素)>pH(B因素),根据k值和R值得最优工艺参数选择A3B1C1,即乙酸钠浓度4%,pH6.0,乙醇浓度65%,以最佳参数得到的产品中葡萄糖醛酸含量33.16%,ChS提取率14.64%,综合评分47.8,高于正交实验表中的任一组工艺;从表3的方差分析可知,醇沉体系中乙醇浓度影响极显著(p<0.01),乙酸钠浓度影响显著(p<0.05),pH影响不显著(p>0.05)。因此为了得到更佳的工艺方案,本实验进一步采用醇沉体系中乙醇浓度、乙酸钠浓度为因素,以葡萄糖醛酸含量和硫酸软骨素提取率为指标,进行单因素实验来确定工艺参数最优值。
2.2 醇沉工艺的单因素实验
2.2.1 乙醇浓度对硫酸软骨素醇沉效果的影响 将碱提取液(提取液中多糖浓度保持在1%~2%[8])平均分成7等份,按提取液体积加入无水乙酸钠,搅拌溶解使体系中乙酸钠浓度为4%,调节pH为6.0,然后分别加入无水乙醇至醇沉体系的乙醇浓度分别50%、55%、60%、65%、70%、75%、80%(v/v),4℃下静置一夜,5000r/min离心20min,收集沉淀,研究不同乙醇浓度对硫酸软骨素醇沉效果的影响,结果见图1。
从图1可知,醇沉体系中,不同的乙醇浓度对ChS提取率和产品中葡萄糖醛酸含量的影响很大,这与上文的正交实验结果一致。当乙醇浓度为50%~65%时,ChS提取率呈上升趋势,当乙醇浓度大于65%后,随着乙醇浓度的增加,提取率下降。这是由于乙醇浓度的升高,提高了一些蛋白质的溶解度,使ChS也随之溶于乙醇溶液中而没有被沉降下来,同时,也会降低一些醇溶性杂质和亲脂性较强类物质的溶解度,使其溶出量增加,降低多糖溶出量,两者共同导致了ChS提取率的降低;还可以看出,当乙醇浓度为50%~65%时,产品中葡萄糖醛酸的含量呈稳定趋势,当乙醇浓度大于65%后,葡萄糖醛酸的含量因为某些杂质蛋白和有机盐离子的大量析出而迅速下降。综合考虑得知,65%为最佳的乙醇沉淀浓度。许琳[22]研究可知,乙醇浓度对多糖提取率的大小,主要取决于多糖的相对分子质量的大小和分子的形状。一般情况下,多糖的分子质量越大,被沉淀下来所需的乙醇体积分数就越小,由此发现稀碱法提取的ChS相对分子质量很大,保持了多糖的结构稳定性。
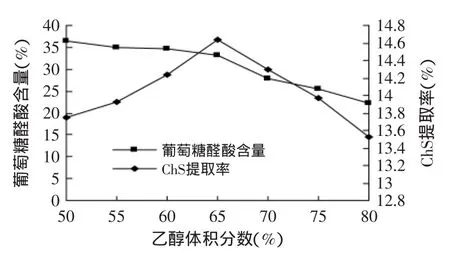
图1 醇沉体系中乙醇浓度对葡萄糖醛酸含量和ChS提取率的影响Fig.1 Effect of ethanol concentration on the content ofglucuronic acid and extraction rate of chondroitin sulfate in the ethanol precipitation system
2.2.2 乙酸钠浓度对硫酸软骨素醇沉效果的影响将碱提取液(提取液中多糖浓度保持在1%~2%)平均分成7等份,按提取液体积加入无水乙酸钠,搅拌溶解使体系中乙酸钠浓度分别为2%、3%、3.5%、4%、4.5%、5%、5.5%(g/mL),调节pH为6.0,然后分别加入无水乙醇至醇沉体系的乙醇浓度为65%(v/v),4℃下静置一夜,5000r/min离心20min,收集沉淀,研究不同乙酸钠浓度对硫酸软骨素醇沉效果的影响,结果见图2。
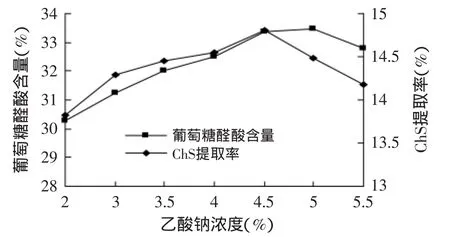
图2 醇沉体系中乙酸钠浓度对葡萄糖醛酸含量和ChS提取率的影响Fig.2 Effect of sodium acetate concentration on the content of glucuronic acid and extraction rate of chondroitin sulfate in the ethanol precipitation system
从图2可知,随着醇沉体系中乙酸钠浓度的增大,产品中葡萄糖醛酸含量增加,这是因为[23]盐离子破坏了硫酸软骨素与水分子之间强烈的吸附作用,使之溶解度降低而大量聚集沉降析出,在乙酸钠浓度5%时达到最高。而当盐离子浓度过大时,一些蛋白质变性沉降从而降低了ChS的析出量,葡萄糖醛酸含量下降。还可得知,ChS提取率的变化趋势与葡萄糖醛酸含量基本一致,在乙酸钠浓度4.5%时ChS提取率达高峰;当盐离子浓度过大时,一些杂质(某些蛋白质和有机盐)溶出率增大,造成ChS溶出量减少使提取率降低。醇沉过程的主要目的是最大程度的沉淀硫酸软骨素,所以从节约成本角度选取4.5%为最佳的乙酸钠浓度。
2.3 验证实验
最终得出的硫酸软骨素最佳醇沉工艺为:调节碱提液pH6.0,按提取液体积加入4.5%乙酸钠为助沉剂,搅拌溶解后加入沉淀剂无水乙醇至体系中乙醇浓度达65%,在4℃冰箱中静置一夜,5000r/min离心20min,收集沉淀用无水乙醇洗涤数次,于60℃烘箱中干燥至无纯味,得到粗品粉末,干燥保存。重复三次进行实验验证发现,粗品葡萄糖醛酸含量33.36%,ChS提取率为14.81%。
2.4 紫外光谱
将粗多糖产品配制成0.5mg/mL的溶液,以蒸馏水做空白对照,在波长190~400nm之间扫描得紫外扫描图谱如图3所示。
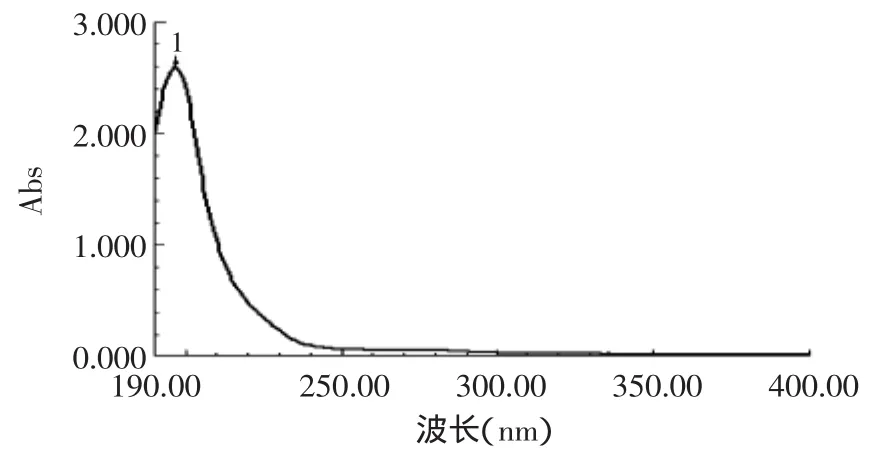
图3 产品的紫外光谱Fig.3 UV spectrum of product
图3表明,样品在波长196nm附近有葡萄糖醛酸的典型吸收峰,280nm处没显示出蛋白质吸收峰,260nm处无紫外吸收,说明无核酸存在。
3 结论与讨论
采用乙酸钠代替传统的助沉剂氯化钠作为多糖醇沉体系中的助沉剂,优点在于乙酸钠在乙醇中的溶解度很大,不容易随着硫酸软骨素一起沉淀,产品纯度提高,有利于后续产品的精制纯化。另外,在乙醇沉淀分离时,还需注意一些操作事项:a.提取液需冷却后再加入乙醇,以免乙醇受热挥发损失;b.醇沉时慢加快搅,即快速搅拌药液,缓缓加入乙醇,以避免局部醇浓度过高造成有效成分被包裹损失,促进硫酸软骨素迅速聚集沉降,获得较好的得率,提高了生产效率。
经过正交实验和单因素实验确定ChS碱提液的最佳醇沉工艺为:乙醇浓度65%,乙酸钠浓度4.5%,pH 6.0,沉淀经干燥后得到白色粉末产品。在此条件下,重复三次进行验证得ChS提取率为14.81%,葡萄糖醛酸含量33.36%,硫酸软骨素纯度达85.9%,超过国家出口标准(84.6%)。
紫外光谱分析,260及280nm处没有最大吸收,说明产品基本不存在蛋白质和核酸。
[1]熊双丽,李安林.酸性多糖的最新研究进展[J].食品科技,2010,35(5):80-83.
[2]沈渤江,窦韵.硫酸软骨素制剂在澳大利亚的应用概况[J].食品与药品,2009,11(1):4-7.
[3]Volpi N.Quality of different chondroitin sulfate preparations in relation to their therapeutic activity[J].J Pharm Pharmacol,2009,61:1271-1280.
[4]张天民,凌沛学.糖胺聚糖研究新进展[J].食品与药品,2008,10(9):1-5.
[5]于广利,赵峡,张天民.硫酸软骨素的结构特点及其质量控制[J].食品与药品,2010,12(5):153-157.
[6]张秀娟,张丽娟,季宇彬.硫酸软骨素的生物活性及应用研究进展[C]//全国生物多样性保护及外来有害物种防治交流研讨会论文集.2008:135-138.
[7]Murado M A,Fragues J,Montemayor M I,et al.Preparation ofhighly purified chondroitin sulphate from skate(Rafa clavata)cartilage by-productis.Processoptimization including a newprocedure of alkaline hydroalcoholic hydrolysis[J].Biochem Eng J,2010,49:126-132.
[8]张豁中,温玉麟.动物活性成分化学[M].天津:天津科学技术出版社,1995:1019-1020.
[9]胥传来,周康.鲨鱼硫酸软骨素的研制[J].无锡轻工业大学学报,1999,18(3):57-61.
[10]李南.硫酸软骨素的开发及生产工艺控制[J].上海水产大学学报,1998,7(1):38-43.
[11]陈亚.硫酸软骨素生产工艺的优化研究[D].广州:华南理工大学,2010.
[12]夏未铭,赵德怀,高睿.硫酸软骨素粉制备方法的改进[J].陕西师范大学学报:自然科学版,2006,34(1):256-257.
[13]田甲春.硫酸软骨素提取工艺的研究[D].兰州:甘肃农业大学,2010.
[14]熊双丽,李安林,吴照民,等.鸡胸软骨硫酸软骨素的提取及分离纯化[J].农业工程学报,2009,25(1):271-275.
[15]中国药品生物制品检定所.WS1-XG-2002硫酸软骨素A钠[S].北京:中国医药科技出版社,2002.
[16]BITI’ER T,MUIR H M.A modified uronic acid reaction[J].Anal Biochem,1962(4):330-334.
[17]张娜,陈锦屏,严静,等.柿皮果胶纤维素酶法提取工艺[J].食品科学,2011,32(12):160-163.
[18]中华人民共和国国家山东出入境检验检疫局.GB/T20365-2006硫酸软骨素和盐酸氨基葡萄糖含量的测定液相色谱法[S].北京:中国标准出版社,2006.
[19]陈玉玲,张宜英,王碧.南瓜多糖的提取及纯化[J].内江师范学院学报,2010,25(2):38-41.
[20]石宝霞,车会莲,赵利霞,等.碎米荠硒多糖的分离纯化及光谱分析[J].食品科学,2007,28(6):298-301.
[21]张平一,宋群亮,黄赵刚,等.正交实验优选亮菌多糖的醇沉工艺[J].安徽医药,2007,11(5):395-396.
[22]许琳,刘建伟.米糠多糖乙醇沉淀工艺特性的研究[J].农产品加工·学刊,2008(4):22-24.
Optimization of ethanol precipitation techniques for chondroitin sulfate from bovine nose cartilage with orthogonal test
LI Li-xiao1,XIA Yan-bin1,2,*
(1.Food Science and Technology,Hunan Agricultural University,Changsha 410128,China;2.National R&D Branch Center for Vegetable Processing,Changsha 410128,China)
TS201.1
B
1002-0306(2012)16-0261-04
2012-02-01 *通讯联系人
李利晓(1984-),女,硕士研究生,研究方向:食品化学与营养。
湖南省科技创新项目(60030183711)。
