超声斑点追踪及成像技术评价主动脉瓣反流患者左室扭转运动
2012-09-12谢明星王蕾王新房吕清华中科技大学同济医学院附属协和医院超声影像科湖北省分子影像重点实验室武汉430022
谢明星 王蕾 王新房 吕清 华中科技大学同济医学院附属协和医院超声影像科 湖北省分子影像重点实验室 (武汉 430022)
正常主动脉瓣舒张期关闭,阻止主动脉腔内血液反流入左室腔。若主动脉瓣或主动脉根部发生病变,则形成主动脉瓣反流,舒张期左室腔被动接受主动脉瓣反流血液,左室容量负荷增加。病程早期左室心肌代偿加强收缩,维持正常心功能。随着病情进展,反流量可逐渐加重,左室负荷不断增加,心肌收缩产生失代,左室功能减低。因此,评价不同程度AR患者左室收缩功能改变,对确定其手术适应征与制定手术方案有着重要的临床价值。
1.资料与方法
1.1 研究对象
AR组:2009年1月至2010年5月,在我院就诊并经二维彩色多普勒超声诊断为单纯性主动脉瓣反流患者95例,男54例,女41例。依据2003年ASE建议,确定AR程度[1,2],并将病例组分为三组:A组为轻度组,30例,男16例,女14例,年龄28~78 (50.60±10.42) 岁,包括主动脉瓣退行性变20例,瓣叶对合错位或脱垂2例,无明显病因者8例。B组为中度反流组,31例,男19例,女12例,年龄19~76 (49.90±14.36)岁,包括风湿性病变4例,二瓣化畸形例7例,退行性变例17例,瓣环扩张3例。C组为重度反流组,者34例, 男19例, 女15例,年龄15~70(48.8±16.3) 岁,包括风湿性病变4例,退行性变8例,瓣叶对合错位或脱垂8例,瓣环扩张3例,二瓣化畸形9例,感染性心内膜炎2例。
排除标准:以上病例均排除心内分流、心房颤动、房室传导阻滞 (Ⅱ度以上)、频发室性期前收缩和严重肺部疾患。
对照组:性别及年龄与AR组相匹配的健康志愿者30例,男15例,女15例,年龄18~72(46.9±14.1)岁。窦性心律,无心血管病史,排除各种器质性疾病。
1.2 仪器
GE vivid 7 Dimension彩色多普勒超声诊断系统,二维相控阵探头M3S(频率1.7~3.4MHz)。
GE EchoPAC二维应变分析软件工作站。
1.3 检查方法
1.3.1 图像采集
受检者左侧卧位,嘱平静呼吸,超声检查时同步记录心电图,帧频在60帧/s以上。
待受检者各项生理指标平稳后,行超声心动图检查。显示左室心尖四腔观、二腔观及左室长轴观切面二维图像;显示胸骨旁二尖瓣口水平短轴切面、左室乳头肌短轴切面及心尖水平切面二维图像,短轴切面左室腔应尽可能保持圆形。四腔心切面尽可能清晰显示左室全貌及左室壁心内膜,嘱受检者呼气末屏气,取心率稳定的连续3个心动周期的二维灰阶动态图像存储于硬盘,检查完毕后将图像原始数据刻录成光盘。
1.3.2 图像分析
将数据导入GE EchoPAC工作站后,于左室流出道血流频谱等容舒张期时间处,设定主动脉瓣关闭时间点(AVC)及二尖瓣开放时间点(MVO)。进入工作站2D strain模式下,将二维图像停帧于心内膜显示最清晰的收缩期末,在左室心尖四腔切面上清晰显示后间隔及侧壁、两腔切面清晰显示前壁及下壁、心尖长轴切面清晰显示前间隔及后壁。手动仔细勾画左室心内膜边界后,系统可自动对心肌内斑点进行追踪。调整感兴趣区宽度,使其包纳心肌全层。软件自动将左室壁分为6个节段,并将各节段的追踪结果以“V”(二维图像满足STI分析要求)或“X”(不满足)的形式表示。从心尖向心底部方向观察,心肌呈逆时针旋转以正值表示,顺时针旋转则以负值表示。扭转角度等于心尖部与基底部旋转角度的净差,将心尖部和心底部所有参数数据转化为数据表格,计算心底部旋转角度峰值(Peak rotation on basal plane,旋转MV)、心尖部旋转角度峰值(Peak rotation on apical plane,旋转AP),扭转角度峰值(Peak twist, Ptw)、收缩期末扭转角度(Twist at aortic valve closure, AVCtw)、等容舒张期末扭转角度(Twist at mitral valve opening, MVOtw)。STI软件对不同研究对象间心率差异进行时间标化,将主动脉瓣关闭(AVC)点设定为收缩期末,下一个心动周期的R波顶点设定为舒张期末,心动周期标化为60点。
采用双平面Simpson法测量舒张末期左室容积(LVEDV)、收缩末期左室容积(LVESV)及左室射血分数(LVEF)。
1.4 统计学处理
所有计量数据用均数±标准差表示。统计分析采用SPSS 16.0软件包(SPSS Inc., Chicago,Illinois, USA),两组间比较采用配对t检验,多组间参数比较采用One Way ANOVA分析SNK法。P<0.05为差异有统计学意义。
2.结果
2.1 各观察组间一般资料比较
各组间年龄、性别、身高、体重、体表面积和心率差异均无统计学意义(P>0.05)。(表1)
2.2 各观察组间常规超声参数及血流动力学情况比较
轻度AR组与正常对照组比较,舒张末期左室内径、收缩末期左室内径、舒张末期左室容积、收缩末期左室容积、二尖瓣口舒张期E峰、A峰及E/A比值差异均无统计学意义(P>0.05)。中度AR组及重度AR组与正常对照组相比,舒张末期左室内径、舒张末期左室容积增大(P<0.05)。中度AR组左室射血分数、二尖瓣口舒张期E、A峰及E/A比值差异与正常对照组相比均无明显统计学意义(P>0.05)。重度AR组左室射血分数与对照组相比有显著差异,但二尖瓣口舒张期E、A峰及E/A比值差异则无明显统计学意义(P<0.05)。(表2)

表1. 对照组及AR反流组一般情况比较
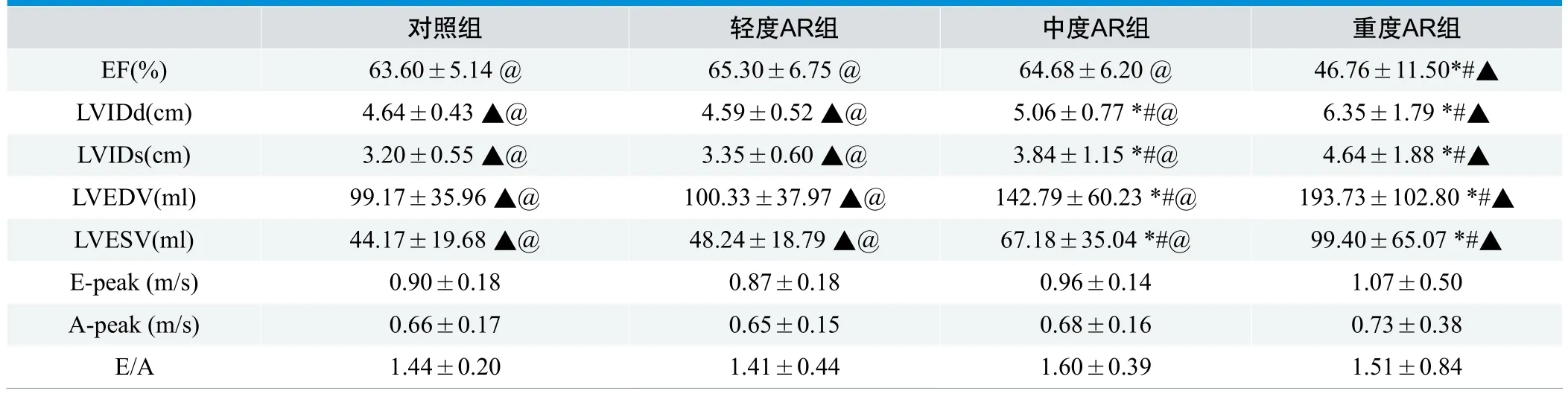
表2. 对照组与AR反流组二维参数比较

表3. 对照组与各型主动脉瓣反流组左室旋转及扭转角度参数比较
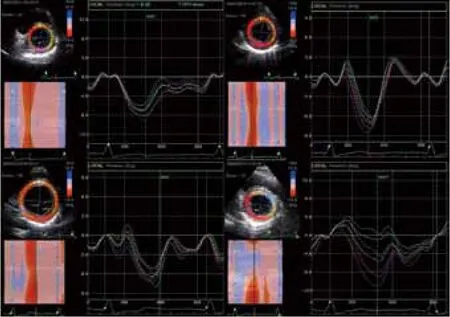
图1. 左室短轴方向心底水平观旋转:从左至右,从上至下依次为正常对照组、轻度AR组、中度AR组及重度AR组,正常对照组和轻度AR组可见心底水平旋转曲线为负向波形,曲线形态规则,旋转角度较为一致,中度AR组与对照组相似,但旋转角度增大,且曲线形态不一,重度AR组曲线与对照组相似,但旋转角度明显降低,且曲线形态紊乱

图2. 左室短轴方向心尖水平观旋转:从左至右,从上至下依次为正常对照组、轻度AR组、中度AR组及重度AR组,正常对照组和轻度AR组可见心尖水平旋转曲线为正向波形,曲线形态规则,旋转角度较为一致,中度AR组与对照组相似,但旋转角度增大,且曲线形态不一,重度AR组曲线与对照组相似,但旋转角度明显降低,且曲线形态紊乱
2.3 各观察组间左室旋转及扭转角度比较
正常对照组心底水平旋转曲线表现为负向波形,心尖水平表现为正向波形,心尖部水平旋转角度均大于心底部水平。左室扭转曲线表现为正向波形。轻度AR组心底、心尖部旋转及扭转曲线与正常对照组较一致。中度AR组心底、心尖部旋转及扭转曲线形态稍显不一致,未见明显变化规律。重度AR组心底、心尖部旋转及扭转曲线形态明显不一致且形态紊乱。中度AR组心底、心尖部旋转及扭转角度较正常对照组明显增大(P<0.05),重度AR组心底、心尖部旋转及扭转角度较正常对照组明显减小(P<0.05)。(表1~3,图1~2)
3.讨论
临床实践中, AR患者在左心室收缩功能测值正常的情况下,左室腔径增大,尤其是收缩末期长径或容积增大,亦是左心室功能失代偿的早期表现,其具有外科手术治疗指征。但当病程进展为重度主动脉瓣关闭不全时,则意味着患者具有较高死亡率[3],此阶段即使进行手术,心功能恢复亦较困难,患者预后差,此时术前左室收缩功能状态是决定患者预后的重要因素之一[4~6]。而中度以上主动脉瓣反流患者,其早期左室收缩功能降低往往是可逆的,左室扩张和收缩功能不全常可在手术治疗后得到逆转[5],临床症状明显好转。左室射血分数(left ventricular ejection fraction,LVEF)是评价主动脉瓣反流患者左室功能常用和主要超声指标,已被广泛应用于临床实践。然而,左室收缩功能受前负荷、后负荷及心肌收缩力影响。根据Frank-Starling机制,在维持心肌收缩力不变的情况下,增加前负荷时,心肌长度亦增加,心肌收缩功能则会增强[7]。主动脉瓣发生反流时,左室容量负荷逐渐增加,以至容量负荷过重[8],此时心肌收缩功能虽增强,但心肌收缩力可能并未发生改变,此时临床上不能判断左室收缩功能的改变是由于心肌收缩力改变还是由于容量负荷增加所致,单独LVEF测值不能准确评价此种状态下心肌功能不全的发展。
二维斑点追踪成像技术的进展及其分析软件的不断完善,使得超声医师可根据超声心动图对主动脉瓣反流患者左室功能改变进行研究。此研究建立在二维灰阶超声图像的基础上,实时跟踪心肌各层组织空间运动,并对角度无依赖性,且不受心脏自身的摆动和牵拉运动影响,经工作站系统对逐帧图像进行运动比较,最终反映出左室长轴和短轴方向的心肌应变、旋转及扭转运动。因此,本研究对轻度、中度及重度主动脉瓣反流患者左室功能进行评价,为反映左室形变及收缩功能改变提供全面手段[9~15],可为临床需求提供帮助。
研究表明,心室扭转受心内膜与心外膜下肌纤维的走行夹角、心肌收缩力及心室几何形态等多个因素的影响[16]。本研究数据显示,轻度AR组左室旋转及扭转运动与正常对照组相比,差异无统计学意义。中度AR组左室旋转及扭转运动较正常对照组增强,这可能是左室收缩功能尽管受前负荷影响,但为了维持正常功能状态,则与反流造成的容量负荷相平衡。随着病情进展,左室生成新的肌小节,逐渐出现舒张末期容积代偿性扩大与心肌离心性肥厚[17],这些改变代偿性增加了左室心内膜下心肌纤维的反向旋转幅度,从而使左室扭转角度增加,这也可能是主动脉瓣反流患者常可数年保持无症状期的原因之一。重度AR组旋转及扭转运动较正常对照组明显减低,患者逐渐出现充血性心力衰竭。这可能是由于随着反流加重,原本正常斜行的心肌纤维在病理状态下向水平方向发展,致心脏射血及抽吸功能减弱所致[18]。有研究显示,当发生心力衰竭时,正常心肌15%缩短却只能引起左室30%的射血分数;正常人心脏肌纤维走向横行时,射血分数为30%,如走向斜行时,射血分数可增加至60%,从左室中间段到心尖段的变形能力可随之增加。而基底环和心尖环的心肌纤维走行方向为横向和斜向,随着主动脉瓣反流加剧可导致左室心肌扩张,心尖环也会因此增宽,使得心室由正常的锥体几何结构扩大为球形结构,心尖环斜行肌纤维结构走向趋于横行,导致心尖与基底环肌纤维走形方向一致[19]。牵拉并扩张的心脏失去原有正常的螺旋形结构,使得基底环和心尖环的正常位置关系失去平衡。当心尖扩张成为球形时,左室扭转模式亦发生改变,原本斜行走向的心尖环改变了走行方向,这使得射血所需要的扭转运动减弱,舒张期抽吸作用亦减弱。病变左室自身的扩张与变薄,会导致左室抽吸作用的减弱甚至丧失,这使得左室内压力降低,不足以完成其自身的充盈状态,由此则加重了心力衰竭症状和出现各种心律失常,导致外科手术效果与患者预后不佳。
综上所述,本研究结果显示超声二维斑点追踪成像技术可对主动脉瓣轻、中、重度反流患者左室扭转运动进行分析,轻度AR组患者左室心肌收缩功能无明显损害;中度AR组患者旋转及扭转角度增大,左室心肌收缩功能处于代偿状态;重度反流时,左室心肌及收缩功能有明显损害。超声二维斑点追踪成像技术可作为此类患者收缩功能评价的良好手段。
[1]Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvlar regurgitation with two-dimensional and doppler echocardiography. Journal of the American society of echocardiography.2003; 16:777-802.
[2]李冬蓓,黄云洲. 超声心动图评价主动脉瓣反流程度. 中国医学影像技术,2010,26(7):1383-1385.
[3]Dujardin KS, Enriquez-Sarano M, Schaff HV, et al. Mortality and morbidity of aortic regurgitation in clinical practice: a long-term follow-up study. Circulation.1999; 99:1851-1857.
[4]Turina J, Milincic J, Seifert B, et al. Valve replacement in chronic aortic regurgitation: true predictors of survival after extended follow-up. Circulation. 1998; 98:100-106.
[5]Corti R, Binggeli C, Turina M, et al. Predictors of long-term survival after valve replacement for chronic aortic regurgitation: is M-mode echocardiography suff i cient? Eur Heart J. 2001; 22:866-873.
[6]Chaliki HP, Mohty D, Avierinos JF, et al. Outcomes after aortic valve replacement in patients with severe aortic regurgitation and markedly reduced left ventricular function. Circulation. 2002; 106:2687-2693.
[7]姚泰, 主编. 生理学. 第6版. 北京:人民卫生出版社, 2004, 95-96.
[8]Duarte IG, Murphy CO, Kosinski AS, Jones EL, Craver JM, Gott JP,Guyton RA. Late survival after valve operation in patients with left ventricular dysfunction. Ann Thorac Surg 1997; 64:1089–95.
[9]Perk G, Tunick PA, Kronzon I. Non-Doppler two-dimensional strain imaging by echocardiography–from technical considerations to clinical applications. J Am Soc Echocardiogr, 2007, 20(3):234-243.
[10]Ingul CB, Torp H, Aase SA. Automated analysis of strain rate and strain: feasibility and clinical implications. J Am Soc Echocardiogr, 2005, 18(5):411-418.
[11]Modesto KM, Cauduro S, Dispezieri A, et al. Two-dimensional acoustic pattern derived strain parameters closely correlate with on-dimensional tissue Doppler derived strain measurements. Eur J Echocardiogr, 2006, 7(4):315-321.
[12]Serri K, Reant P, Lafitte M, et al. Global and regional myocardial function quantification by two-dimensional strain:application in hypertrophic cardiomyopathy. J Am Coll Cardiol, 2006, 47(6):1175-1781.
[13]Langeland S, Wouters PF, Claus P, et al. Experimental assessment of a new research tool for the estimation of twodimensional myocardial strain. Ultrasound Med Biol, 2006, 32(10):1509-1513.
[14]Langeland S, D’hooge J, Wouters PF, et al. Experimental validation of a new ultrasound method for the simultaneous assessment of radial and longitudinal myocardial deformation independent of insonation angle. Circulation, 2005,112(14):2157-2162.
[15]Korinek J, Wang J, Sengupta PP, et al. Two-dimensional strain-a Doppler-independent ultrasound method for quantitation of regional deformation: validation in vitro and in vivo. J Am Soc Echocardiogr, 2005, 18(12):1247-1253.
[16]Taber LA, Yang M, Podszus WW. Mechanics of ventricular torsion [J]. J Biomech, 1996, 29(6):745-752.
[17]McCarhty PM. Aortic valve surgery in patients with left ventricular dysfunction. Semin Thorac Cardiovasc Surg 2002;14:137–43.
[18]高长青,主编. 室壁瘤外科治疗学. 第1版. 北京:科学出版社, 2006. 222.
[19]Buckberg GD, Coghlan HC, Torrent-Guasp F. The structure and function of the helical heart and its buttress wrapping.V.Anatomic and physiologic considerations in the heslthy and failing heart. Semin Thorac Cardiovasc Surg, 2001, 13(4):358-385.
