细胞外信号调节激酶信号途径及其与动物肌肉生长发育的关系
2012-09-11李欣蔚朱宇旌邵彩梅
张 勇 李欣蔚 朱宇旌 邵彩梅
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.辽宁禾丰牧业股份有限公司,沈阳 110164)
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号转导系统是细胞外信号引起核反应的细胞信息传递的共同途径。MAPK是一族在细胞内广泛分布、含有丝氨酸/苏氨酸残基的蛋白激酶,包括细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)、c-jun 氨基末端激酶(c-jun N-terminal kinases,JNK)和 p38 丝裂原激活蛋 白 激 酶 (p38 mitogen-activated protein kinases,p38)3个主要成员。它们普遍存在于多种生物中,如原核生物和哺乳动物细胞。其中ERK主要被生长因子、多肽类激素以及神经递质激活,控制细胞增殖、分化、生存和凋亡[1-2]。其信号转导是涉及调节细胞生长、发育及分化的信号网络的核心,细胞内多种信号分子最终通过磷酸化ERK发挥生物学效应。
1 ERK的分子生物学特性及其信号途径
1.1 ERK的分子生物学特性
ERK在20世纪90年代初期得到分离鉴定,ERK1、ERK2相对分子质量分别为44×103和42×103,也称为 p44 MAPK、p42 MAPK,有 90%的同源性[3]。ERK具有MAPK家族2个显著特征,即:1)通过区域Ⅷ丝氨酸、苏氨酸双位点磷酸化活化;2)是脯氨酸导向丝氨酸/苏氨酸蛋白激酶。
ERK1和ERK2是目前研究较多的EPK,根据美国蛋白质数据库(protein data bank,PDB)的资料显示,ERK1和ERK2亚型具有显著相似的氨基酸序列,其中编码ERK1的基因为1 759 bp,晶体结构见图1。鼠类、原核生物以及人各个组织中的ERK序列分析结果表明,各组织中的ERK具有高度同源性,共性包括:子域1中的主要的共有基元GXGXXGXV(甘氨酸31至缬氨酸38)可以用来锚定非可移动的ATP磷酸盐的位置;子域2中不变的赖氨酸53以及临近区域(缬氨酸50至丝氨酸56),它们的功能是根据ATP的最大活性来结合ATP并确定其结合方向;组氨酸144至精氨酸151的催化环;用以被激活的对偶磷酸化的保守子域(苏氨酸178至苏氨酸180);丝氨酸/苏氨酸蛋白激酶的不变残基[4]。ERK的保守子域用以与其激活物、抑制剂以及特异性磷酸化底物进行对接,由于其位置位于靠近ERK分子的C端,与催化结构域相毗邻,故被称为CD子域。这段CD子域与MAPK家族中其他成员的保守子域结构相似,这解释了MAPK家族在功能上的相似性。CD子域中含有一些保守的天冬氨酸残基,这些残基在与其底物的对接的过程中发挥了重要作用,人类ERK2中CD子域的氨基酸序列为:311LEQYYDPSDEPIA324,其中编码CD子域的基因位点位于255~1 457 bp。
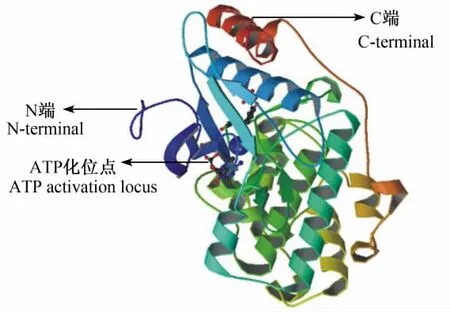
图1 ERK1晶体结构Fig.1 The crystal structure of ERK1
ERK作为MAPK家族的一员,其基本的信号传递步骤遵循MAPK的3级酶促级联反应,即Ras- Raf- MAPK 激 酶(mitogen-activated protein kinase kinase,MEK)-ERK途径。受体酪氨酸激酶(receptor tyrosine kinase,RTK)、G 蛋白偶联受体(G protein-coupled receptor,GPCR) 和某些细胞因子受体均可激活ERK信号途径[5]。多数信号因子对ERK的活化都始于对Ras的激活,活化的Ras可进一步与Raf的N端结合并使其激活。Raf可磷酸化激活MEK1和MEK2,进而高度选择性活化ERK1和ERK2。G蛋白偶联受体也可以通过一系列复杂的级联反应影响ERK活化。此外某些细胞因子受体可通过激活双面神激酶(Janus kinase,JAK)、磷酸化Src同源性和胶原蛋白(Shc),进而激活ERK[6]。而负反馈调节则是保证MAPK不持续活化的重要机制,MAPK可以诱导产生3种不同的蛋白磷酸酶以抑制MAPK活化,分别为二元特异性磷酸酶、苏氨酸磷酸酶和酪氨酸磷酸酶[7]。
除此以外,钙离子、蛋白激酶C(protein kinase C,PKC)以及伪狂犬病病毒衣壳蛋白均可以影响ERK信号途径的活性。其中,蛋白激酶C是通过不同的机制调节ERK的活性的,并且这种调节作用是具有细胞类型特异性的。而伪狂犬病病毒衣壳蛋白则是通过限制MAPK-ERK信号途径在核膜上的靶因子活性来限制ERK信号途径的[8]。
1.2 Ras-Raf-MEK-ERK信号途径概述
Ras-Raf-MEK-ERK 是从细胞表面受体到转录因子的一组级联转导信号,用以调控基因的表达,途径见图2[9]。这些级联的信号会调控许多细胞凋亡基因的表达。作用方式有染色体异位、细胞因子受体基因(如 Flt-3、Kit、Fms)突变以及野生型基因的过度表达或者受体突变等。Raf-MEK-ERK途径作用于细胞凋亡基因[如 Bad、Bim、Mcl-1、半胱天冬酶9(caspase-9)以及尚有争议的B细胞淋巴瘤2(Bcl-2)]翻译后的磷酸化,对细胞凋亡具有深远的影响。同时,该途径对细胞周期的进程也存在多种方式的影响[10]。
Ras作为 Raf-MEK-ERK 途径的上游蛋白,是最早发现的小G蛋白,为原癌基因Ras的产物,具有活化态的GTP结合构象与失活态的GDP结合构象。2种构象可以相互转变,在信号转导过程中发挥开关作用。
当细胞内外的各种刺激激活Ras后,Ras利用高亲和力和Raf N端的2个区域(Ras结合域、半胱氨酸富集域)结合,将Raf从胞质转移到胞膜,在胞膜上Raf丝氨酸/苏氨酸发生磷酸化而被激活。Raf被激活后,它的C端催化区能与MEK结合,并使其催化区区域Ⅷ中2个精氨酸位点磷酸化,从而使MEK激活。MEK属于少有的双重特异性激酶,使酪氨酸和苏氨酸2个调节位点磷酸化而激活ERK。
1.3 ERK信号途径的功能特点
ERK信号途径具有以下特点:1)活化的ERK通过转位方式进入细胞核,激活其下游底物的表达,主要是一些编码核转录因子的早期反应基因(如原癌基因 c-Fos、c-Myc、c-Jun 和 Erg-1 等);调控细胞生长反应,导致次级反应基因(如ANF、MHC、Mlc-2等)的异常表达,影响细胞功能。2)ERK可将多个不同受体系统(如G蛋白偶联受体和受体酪氨酸激酶)介导的信号加以整合,起着多种信号交汇点或共同途径的作用。ERK信号途径是涉及调节细胞生长、发育及分化的信号网络的核心,细胞内多种信号分子最终通过磷酸化ERK发挥生物学效应。在细胞分化、细胞增殖前期,细胞需要保证合成蛋白质、DNA、核糖体RNA以及膜物质等所需的代谢原料。有报道指出,这些代谢物质的合成调节均与ERK信号途径息息相关[11]。
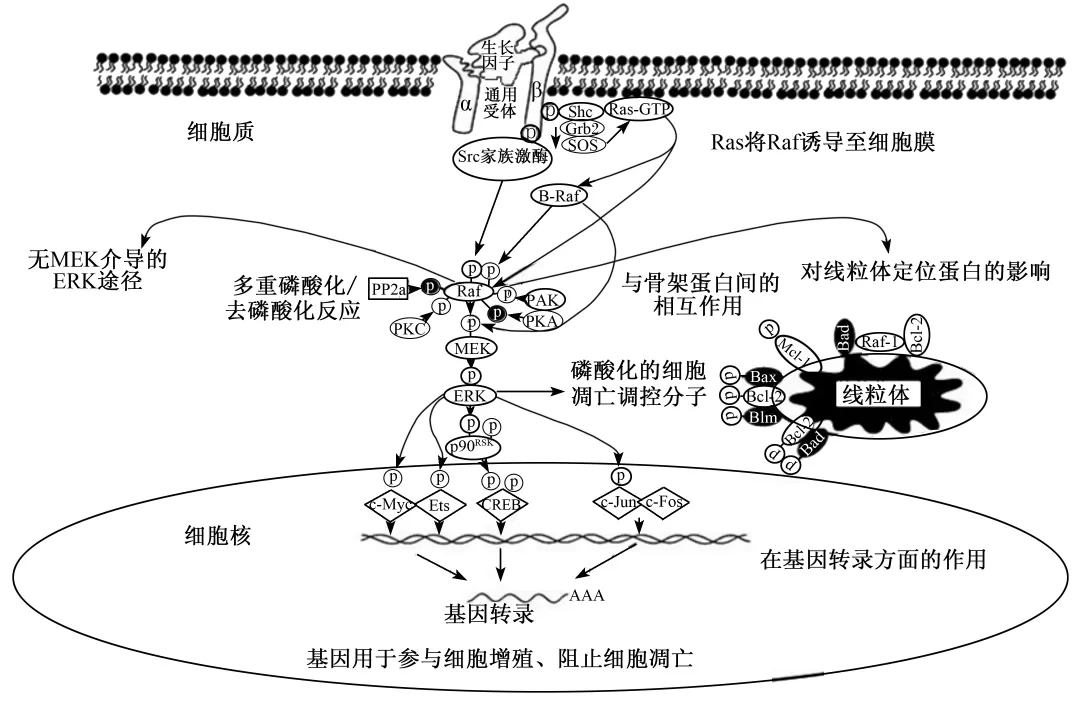
图2 Ras-Raf-MEK-ERK信号途径Fig.2 Ras-Raf-MEK-ERK signaling pathway[9]
2 ERK信号途径与细胞凋亡
ERK对细胞凋亡的影响非常复杂。第一,ERK能够活化核转录因子 -κB(nuclear factorkappa B,NF-κB),进一步诱导抗凋亡基因(如Bcl-2、Bcl-xL)的表达,促进凋亡抑制蛋白 Bcl-2 磷酸化激活[12]。第二,可以通过降低促凋亡蛋白Bad磷酸化,及促进Bad、Bim降解,发挥抗凋亡作用[13]。第三,NF-κB 本身亦可对细胞凋亡产生抑制作用[14]。第四,抗肥胖药来普汀(瘦素,leptin)能够以剂量依赖的方式通过活化ERK抑制前列腺癌细胞DU145和PC3的凋亡[15],而MEK抑制剂可以促进细胞凋亡或增敏细胞凋亡,在黑素瘤细胞中,应用MEK抑制剂能够激活促凋亡蛋白,促进线粒体释放凋亡诱导因子,激活半胱天冬酶3(caspase-3),促进细胞凋亡[16]。第五,ERK 的磷酸化能够使 Bad、Bim和 caspase-9等促凋亡蛋白磷酸化,发挥促凋亡作用;有报道表明,组蛋白脱乙酰酶抑制剂可以通过增加ERK磷酸化而促进肿瘤细胞的凋亡[17];阿伐他汀{(3S,5S) -7-[2-(4-氟苯基)-3-苯基-4-(苯基氨基甲酰基)-5-异丙基吡咯-1-基]-3,5-二羟基庚酸,atorvastatin}能够增加 ERK磷酸化,活化的ERK增加 Bim裂解,进而增加caspase-9 和 caspase-3 的 活性[18]。活化 的 ERK在不同的微环境中发挥的作用不同,可能是与其他途径共同作用、相互影响的结果。
而动物被屠宰后,细胞内产生了凋亡信号,很有可能诱发肌细胞强制性死亡[14]。Ouali等[19]曾推断,动物宰后应该有一个细胞凋亡的过程。因此可以认为,ERK可以通过对肌细胞凋亡的调控,进而对宰后肌细胞骨架和结构蛋白的降解进行调控。
3 ERK信号途径与肌肉发育
肌细胞生成(myogenesis)主要是指在胚胎发育过程中,体节细胞经过一系列的增殖、迁移和分化,最终形成肌肉的过程,还包括成熟细胞的维持与组织再生等[20]。骨骼肌的生长速度最终取决于骨骼肌细胞的数量、肌肉蛋白质合成和降解速度[21]。大量研究表明,肌细胞类型是决定肉品质的重要因素[22]。Murgia 等[23]研究发现,去除神经支配后,慢型肌球蛋白重链(MyHC)被持续活化的Ras诱导,比目鱼肌肉中肌细胞组成发生改变。Roth 等[24]研 究表明,MAPK 途 径 中 的 Ras-Raf-MEK-ERK信号途径可以上调慢型纤维MyHC的基因表达同时抑制快肌亚型表达。进一步研究表明,MAPK磷酸酶-1(MKP1)促使核内的MAPK去磷酸化而失活,可以有效地促进慢肌向快肌的转化。而Shi等[25]则发现,ERK能够优先活化快肌细胞。通过抑制ERK可以提升慢肌细胞特异的启动子活性,并抑制快肌细胞表型相关的基因的表达,反之亦然。小鼠和大鼠中富含Ⅱb或Ⅱx型肌纤维的肌肉过表达MKP1后,检测到有新生成的Ⅰ和Ⅱa型肌细胞。Chen等[26]采用RNA干扰技术研究发现人类肿瘤样本中钙蛋白酶与钙蛋白酶抑制蛋白的比例(calpain/calpastatin)的增加与磷酸化的ERK活性增强有关。Rao等[27]在研究阿尔茨海默病(AD)时发现,钙蛋白酶抑制蛋白基因表达沉默时,小鼠脑组织中钙蛋白酶2蛋白活性增强,同时ERK信号途径被激活。Figueiredo等[28]用转基因小鼠证明,在神经组织中钙蛋白酶1和钙蛋白酶抑制蛋白发挥作用与MAPK信号途径密切相关。
4 ERK信号途径与宰后肌肉变化
4.1 宰后肌肉变化的信号级联反应
普遍认为宰后冷藏过程中,肉品成熟嫩化的主要原因是组成细胞膜骨架的蛋白质的降解以及网状结构的消失。肌细胞膜表面,存在一类细胞表面受体分子家族——整联蛋白(integrins),可使细胞黏附于胞外基质并介导来自基质的机械信号和化学信号,识别细胞外基质(extracellular matrix,ECM)蛋白,具有激活胞浆激酶、维持生长因子的生物活性、实现细胞外基质-整联蛋白-肌细胞内的信号转导的功能,调节肌细胞生长、分化、黏附等生理活动。
整联蛋白信号系统由细胞内发出信号,调节细胞外整联蛋白活性,或由细胞外基质发出结合信号转导至细胞内(图3)。该途径可对肌细胞骨架多聚体进行组装,诱导肌细胞骨架变化[29];肌细胞骨架变化产生的机械作用力可调节核内基因的转录和表达,最终调节肌细胞的生长和分化功能。

图3 整联蛋白调节肌细胞生长的信号途径Fig.3 Signaling pathway of integrin adhesion complex regulates growth of muscle cells
4.2 由ERK启动整联蛋白信号系统的肌细胞调节
当对生猪进行屠宰时,应激激活了下丘脑-垂体-肾上腺轴,导致垂体分泌的促肾上腺激素(ACTH)含量增加,同时,促肾上腺激素促进肾上腺分泌皮质醇,从而导致体内的一些内环境、免疫机能发生变化,机体通过这种变化来抵抗应激[30]。与此同时,位于海马区的与恐惧调节相关的谷氨酸能信号会立即触发大量信号途径,这些信号中的一部分将会汇聚到共激活剂——ERK[31]。继而,由ERK进一步调节其多种下游底物(图4)[32]:细胞膜上的离子通道,神经纤维网上的细胞骨架蛋白[33]、下游90 ku核糖体 S6激酶(ribosomal S6 kinase,RSK)以及细胞核内的丝裂原和应 激 活 化 蛋 白 激 酶 (mitogen-and stress-activated protein kinase,MSK)。RSK和 MSK被认为是早期c-Fos基因的主要激活物[34]。这样,通过MSK和RSK间接地激活基因表达,海马区的ERK信号途径就可以介导恐惧记忆的长期储存,当再次受到刺激时,产生条件反射来抵抗应激。
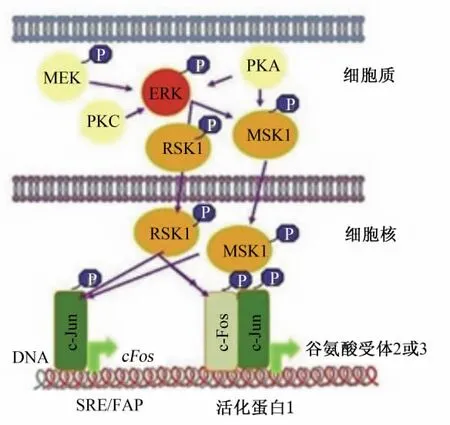
图4 应激时ERK的激活Fig.4 The activation of ERK under stress[32]
Raf-MEK-ERK 常规途径被激活以后,存在多种机制对ERK信号途径进行调节,新的一项研究指出:亚细胞定位作为一个与物理相关的调节方式,是ERK活性调节的主要途径,动物受到应激刺激后,激活的ERK会移动到细胞核间隔中激活整联蛋白系统[35],进而触发整联蛋白信号系统对肌细胞骨架多聚体进行组装,诱导肌细胞骨架变化。据此可以推测,动物屠宰后ERK信号途径启动后可能通过激活整联蛋白信号系统,从而完成对动物宰后肌肉嫩化过程的调节。
5 小结
ERK及其信号途径广泛存在于多种组织细胞中,激活后参与多种因子的转录调控以及细胞活动的调节,同时由于其信号途径的复杂性和多样性,又具有使多条信号途径汇聚并介导、触发其他信号途径的作用。因此,在屠宰后肌肉蛋白质降解、肌肉嫩化过程中,ERK及其信号途径很可能发挥重要作用。而目前对ERK及其信号途径的研究大部分停留在人类和动物的疾病预防及治疗手段方面,在动物肉品质改良方面研究甚少。随着ERK及其信号途径的激活和抑制机制的逐渐明朗,ERK信号途径对肌肉纤维的组成以及肉品嫩度的候选基因的影响也有了报道。所以,深入研究ERK及其信号途径在动物肉品质方面的调控机理,便可以通过激活或抑制ERK及其信号途径的活性来进一步调节和改善肉品质,可以说,在动物营养领域的研究中,ERK及其信号途径极具研究前景。
[1]LI C,SCOTT D A,HATCH E,et al.Dusp6(Mkp3)is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development[J].Development,2007,134:167 - 176.
[2]YUANTAI W,TIANCAI W,QIU Z.PD98059 inhibits expression of pERK1 protein and collagen alpha1(Ⅰ)mRNA in rat pancreatic stellate cells activated by platelet-derived growth factor[J].Journal of Molecular and Cell Cardiology,2005,24:100-103.
[3]张丽志,翟全新.ERK信号转导通路对肿瘤细胞生物学行为的调控[J].医学综述,2011,17(6):836 -838.
[4]RAY D,DUTTA S,BANERJEE S,et al.Identification,structure,and phylogenetic relationships of a mitogen-activated protein kinase homologue from the parasitic protest Entamoeba histolytica[J].Gene Section Evolution Genomics,2005,346:41-50.
[5]JEFFREY K L,CAMPS M,ROMMEL C,et al.Targeting dual-specificity phosphatases:manipulating MAP kinase signaling and immune responses[J].Nature Reviews Drug Discovery,2007,6(5):391-403.
[6]JEFFREY K L,BRUMMER T,ROLPH M S,et al.Positive regulation of immune cell function and inflammatory responses by phosphatase PAC-1[J].Nature Reviews Immunology,2006,7(3):274-283.
[7]OWENS D M,KEYSE S M.Differential regulation of MAP kinase signaling by dual-specificity protein phosphatases[J].Oncogene,2007,26(22):3203 -3213.
[8]KANG M H,BANFIELD B W.Pseudorabies virus tegument protein Us2 recruits the mitogen-activated protein kinase extracellular-regulated kinase(ERK)to membrances through interaction with the ERK common docking domain[J].Journal of Virology,2010,84(17):8398-8408.
[9]JAMES A M,LINDA S,STEELMAN L S,et al.Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochimica et Biophysica Acta,2007,1773:1263 -1284.
[10]STEELMAN L S,POHNERT S C,SHELTON J G,et al.JAL/STAT,Raf/MEK/ERK,P13K/Akt and BCR-ABL in cell cycle progression and leukemogenesis[J].Leukemia,2004,18:189 - 218.
[11]CHAMBARD J C,LEFLOCH R,POUYSSEGUR J,et al.ERK implication in cell cycle regulation[J].Biochimica et Biophysica Acta,2007,1773:1299-1310.
[12]ALEJANDRO E U,JOHNSON J D.Inhibition of Raf-1 alters multiple downstream pathways to induce pancreatic beta-cell apoptosis[J].The Journal of Biology Chemistry,2008,283(4):2407-2417.
[13]HOWIE H L,SHIFLETT S L.Extracellular signal regulated kinase activation by Neisseria gonorrhoeae downregulates epithelial cell proapoptotic proteins Bad and Bim[J].Infection and Immunity,2008,76(6):2715-2417.
[14]张勇,崔岩.NF-κB在细胞凋亡中的调节作用和应用前景[J].动物营养学报,2011,23(5):715-719.
[15]HODA M R,POPKEN G.Mitogenic and anti-apoptotic actions of adipocyte-derived hormone leptin in prostate cancer cells[J].British Journal of Urology International,2008,102(3):383 -388.
[16]WANG Y F,JIANG C C,KIEJDA K A,et al.Apoptosis induction in human melanoma cells by inhibition of MEK is caspase-independent and mediated by the Bcl-2 family members PUMA,Bim,and Mcl-1[J].Clinical Cancer Research,2007,13(16):4934-4942.
[17]PARK H,KIN J.Effects of apicidin,a histone deacetylase inhibitor,on the regulation of apoptosis in H-ras-transformed brease epithelial cells[J].International Journal of Molecular Medicine,2008,21(3):325-333.
[18]APRIGLIANO I,DUDAS J,RAMADORI G,et al.Atorvastatin induces apoptosis by a caspase-9-dependent pathway:an in vitro study on activated rat hepatic stellate cells[J].Liver International,2008,28(4):546-557.
[19]QUALI A,HERRERA-MENDEZ C H,COULIS G,et al.Revisiting the conversion of muscle into meat and the underlying mechanisms[J].Meat Science,2006,74(1):44-58.
[20]张勇,孙璀.钙调磷酸酶-活化T细胞核因子信号途径在骨骼肌生长和发育中生理作用的研究进展[J].动物营养学报,2011,23(4):536 -541.
[21]张勇,邓科.骨骼肌特异性钙蛋白酶与蛋白质降解[J].动物营养学报,2011,23(4):542 -545.
[22]张勇,陶亮,崔岩,等.饲粮蛋白质水平对肥育猪肌肉嫩度及背最长肌钙调磷酸酶-活化T细胞核因子信号途径的影响[J].动物营养学报,2011,23(7):1153-1160.
[23]MURGIA M,ANTONIO L S,ELISA C,et al.Ras is involved nerve-activity-dependentregulation of muscle genes[J].Nature Cell Biology,2000(2):142-147.
[24]ROTH R J,LE A M,ZHANG L,et al.MAPK phosphatase-1 facilitates the loss of oxidative myofibers associated with obesity in mice[J].The Journal of Clinical Investigation,2009,119(12):3817 -3829.
[25]SHI H,SCHEFFLER J M,PLEITNER J M,et al.Modulation of skeletal muscle fiber type by mitogenactivated protein kinase signaling[J].Journal of the Federation of American Societies for Experimental Biology,2008,22(8):2990-3000.
[26]CHEN H L,LIBERTINI S J,WANG Y,et al.ERK regulates calpain2-induced androgen receptor proteolysis in CWR22 relapsed prostate tumor cell lines[J].The Journal of Biological Chemistry,2010,285(4):2368-2374.
[27]RAO M V,MOHAN P S,PETERHOFF C M,et al.Marked calpastatin(CAST)depletion in Alzheimer’s disease accelerates cytoskeleton disruption and neurodegeneration:neuroprotection by CAST over expression[J].The Journal of Neuroscience,2008,28(47):12241-12254.
[28]FIGUEIREDO C,PAIS T F,GOMES J R,et al.Neuron-microglia crosstalk up-regulates neuronal FGF-2 expression which mediates neuroprotection against excitotoxicity via JNK1/2[J].Journal of Neurochemistry,2008,107(1):73-85.
[29]黄帅,陈晓娟,杨倩.骨骼肌细胞整联蛋白研究进展[J].畜牧与兽医,2008,40(6):95 -98.
[30]柴进,熊琪,彭建,等.宰杀方式对猪血液成分以及肉质的影响[J].华中农业大学学报,2009,28(5):583-586.
[31]AHI J,RADULOVIC J,SPIESS J.The role of hippocampal signaling cascades in consolidation of fear memory[J].Bahavioural Brain Research,2004,149:17-31.
[32]GUDEA A L,SCHRICK C,GUZMAN Y F,et al.ERK-associated changes of AP-1 proteins during fear extinction[J].Molecular and Cellular Neuroscience,2011,47:137-144.
[33]SACKS D B.The role of scaffold proteins in MEK/ERK signaling[J].Biochemical Society Transactions,2006,34:833-836.
[34]HA S,REMOND L.ERK mediated activity dependent neuronal complexity via sustained activity and CREB-mediated signaling[J].Development Neurobiology,2008,68:1565-1579.
[35]BHARADWAJ S,VASABTH G,MASUELLI L,et al.Inhibition of nuclear accumulation of phosphorylated ERK by tropomyosin-1-mediated cytoskeletal reorganization[J].Journal of Cancer Molecular,2008,4(5):139-144.
