家禽脂肪酸代谢及其在禽蛋中的沉积和营养调控
2012-09-11林映才张罕星马现永
陈 伟 林映才 张罕星 马现永 阮 栋 王 爽
(广东省农业科学院畜牧研究所,农业部华南动物营养与饲料重点实验室,畜禽育种国家重点实验室,广州 510640)
蛋中除了含有丰富的理想蛋白质(11.4%)外,还含有高达10.54%的脂肪。蛋中脂肪酸具有重要的生理功能:一方面,脂肪酸是受精蛋胚胎各阶段发育的主要能量来源,对维持家禽胚胎的正常发育具有重要的作用[1-2];另一方面,脂肪酸作为蛋加工产品(如咸蛋)的重要风味物质,很大程度上影响到加工蛋的口感、风味和品质。因此,近年来,关于蛋中多不饱和脂肪酸的沉积与健康的研究成为关注热点,而脂肪酸沉积成为蛋品质营养调控的重要目标之一。本文阐述了家禽体内脂肪酸的来源、运输和沉积等生理过程及机制,以及其代谢和沉积过程中的营养调控,为蛋品质营养调控中脂肪酸的沉积提供参考。
1 禽蛋中脂肪酸的成分
禽蛋中脂类沉积的主要部位是卵黄,并在卵黄营养成分中占了较大比例。以70 g的鸭蛋为例,1枚蛋中卵黄占全蛋重的23%,总脂肪约占卵黄重量的30%[3],蛋中脂肪主要为甘油三酯,其含量是蛋白质重的3倍[4]。卵黄中各类脂肪酸占总脂肪的比例大致相同,其中饱和脂肪酸(C14∶0、C16∶0和 C18∶0)含量占总脂肪酸的31.8%,单不饱和脂肪酸(C16∶1和C18∶1)占总脂肪酸的36.1%,多不饱和脂肪酸占总脂肪酸的31.8%[5]。
2 家禽中脂肪酸的来源
2.1 外源获取的脂肪酸
饲粮中脂肪和油(主要成分为甘油三酯)是动物体重要的能量来源之一。由于脂肪和油具有较大体积的分子结构,不能被小肠完整吸收,因而,需要通过小肠中脂肪酶的作用才能完成其消化过程。脂肪首先与胆汁盐形成复合物,当辅脂肪酶与其结合后,脂肪酶再与复合物作用,从而水解甘油三酯。1分子甘油三酯可被水解生成2分子游离脂肪酸和1分子2-单酰甘油。需要指出的是,长链脂肪酸的甘油三酯消化过程需要胆汁酸和脂肪酶的参与,而中短链脂肪酸(如椰子油、棕榈酸油和乳汁中脂肪酸)甘油三酯的分解无需胆汁酸的参与[6]。
家禽机体中脂肪酸吸收部位主要在小肠,但因种类不同其主要吸收位点有所差异。火鸡主要在十二指肠,肉鸡主要在十二指肠与空肠前部之间[7],鸭尚无报道。肠腔中由甘油三酯脂解所产生的游离脂肪酸,一方面可通过自由扩散的方式进入肠细胞;另一方面同氨基酸一样,依赖转运载体的参与介导其转运。目前已经发现的负责长链脂肪酸转运的蛋白家族包括:脂肪酸转运蛋白[8]、脂肪酸结合蛋白和小窝蛋白[9]。小肠细胞中,通常在脂肪酸结合蛋白的协助下,游离脂肪酸与2-单酰甘油被转运到滑面内质网中重新合成甘油三酯;随后进入到高尔基体中,与载脂蛋白 A-I(Apo A-I)作用形成乳糜微粒,并经载脂蛋白B48(Apo-B48)的加工,使得乳糜微粒发生糖基化,最终形成成熟的乳糜微粒。成熟的乳糜微粒在肠细胞基底膜上通过胞吐作用进入到血液循环中[10]。由于家禽小肠淋巴细胞的发育相对不完善,脂蛋白被分泌后直接进入门静脉系统(哺乳动物主要通过淋巴系统),在肝脏被修饰后(甘油三酯被重新组装成VLDL)重新进入血液循环,并运输到靶组织中沉积。
2.2 内源合成的脂肪酸
以蛋鸡为例,1只1.6 kg的蛋鸡平均每天从饲粮中可获取约3 g的脂肪,而卵黄中需要的沉积脂肪为 5 ~ 6 g[11],其脂肪缺口为 3 g,蛋鸭(每天可摄入4.8 g脂肪,卵黄脂肪为8 g)与蛋鸡相似[3]。可见,除了从饲粮中外源获取的脂肪酸外,产蛋禽还必须依赖自身脂肪酸的从头合成才能满足蛋中脂肪酸沉积需要。与哺乳动物不同的是,家禽肝脏负责机体中60%脂类生成[12],而脂肪组织并不参与脂肪酸的从头合成。产蛋禽中脂类合成具有规律性,往往在排卵前几天大量发生,从而为卵黄中的脂类沉积做准备[13]。
肝脏中脂类的生成是由葡萄糖(或氨基酸代谢的中间产物)转化为甘油三酯的过程。葡萄糖经糖酵解生成丙酮酸,并经过柠檬酸循环后得到乙酰辅酶A(CoA),在羧化酶作用下形成丙二酰CoA,最后由脂肪酸合成酶参与碳链的延长,形成16C的棕榈酸。棕榈酸一方面可在延长酶的作用下合成不超过24C的长链脂肪酸,另一方面可在脱饱和酶(如△-9脂肪酸脱饱和酶)的作用下形成不饱和脂肪酸,从而完成脂肪酸的从头合成过程[14]。该过程受到雌激素[15]和胰岛素[16]的刺激。胞液中合成的长链脂肪酸同甘油结合形成甘油三酯,在肝脏中短暂性停留后,同固醇、磷脂等脂类以及载脂蛋白B100(Apo-B100)形成VLDL,同时,一种脂蛋白脂酶的抑制蛋白——Apo-VLDL-Ⅱ(含有二硫键的同源二聚体蛋白,分子质量为95 ku)结合在VLDL颗粒表面,并被运送到其他靶组织(如脂肪组织、心肌、骨骼肌和卵巢)(图1)。脂肪和肌肉组织在摄取VLDL时,需要脂蛋白脂酶的参与,而卵母细胞对脂类的吸收则依赖于VLDL的内吞作用。
3 VLDL介导的脂肪酸转运
机体中少量的游离脂肪酸以与血清蛋白结合的形式在血液中被运送,而绝大部分脂肪酸与甘油结合形成甘油三酯,并在载脂蛋白的作用下被转运到靶组织。乳糜微粒和VLDL是参与甘油三酯转运的2种重要脂蛋白。其中,乳糜微粒是摄食后短时间内(约1 h后)小肠中合成的脂蛋白,负责外源摄取的甘油三酯转运。大多情况下,血液循环中甘油三酯的转运需要通过VLDL才能完成。
3.1 载脂蛋白的生理功能
载脂蛋白是负责脂蛋白颗粒转运的主要蛋白,对脂肪酸靶向运输起着十分重要的作用。VLDL是呈球状的脂蛋白颗粒,其颗粒直径35~70 nm,主要由中间层的甘油三酯和胆固醇,以及外层的磷脂和载脂蛋白构成(图2),其中甘油三酯和胆固醇分别占脂蛋白成分的80%和20%。研究报道,家禽中的VLDL颗粒大小与哺乳动物相似[17],且其代谢关系也表现出与哺乳动物相同的特点[18]。
目前,在动物中已发现 Apo A-Ⅰ、A-Ⅱ、A-Ⅳ、B48、B100、C-Ⅰ、C-Ⅱ、C-Ⅲ、C-Ⅳ和 E[8]。其中,Apo-B100是肝脏中参与组装甘油三酯、胆固醇和磷脂形成VLDL的重要载脂蛋白(每个VLDL颗粒中只组装1个载脂蛋白B),而Apo-B48是参与小肠中VLDL颗粒组装的主要载脂蛋白。家禽小肠中既不表达 Apo-B48 mRNA,也不分泌 Apo-B48[19]。Apo-B100能识别位于细胞表面的受体——低密度脂蛋白(LDL)受体,并介导脂蛋白和胆固醇的吸收,从而成为VLDL转运和沉积的重要载脂蛋白。可见,Apo-B的主要功能是参与VLDL的结构组成,并介导脂类的转运和吸收。Apo A-Ⅰ和Apo A-Ⅱ是在小肠中合成的载脂蛋白,主要作用是参与乳糜微粒的形成。其他载脂蛋白的功能参考Kaneko等[10],本文不作详述。
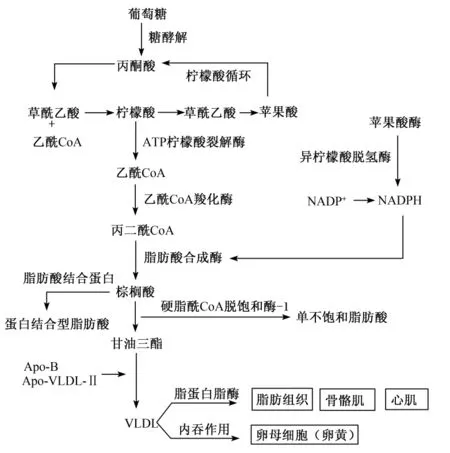
图1 肝脏中脂类的生成与转运Fig.1 Synthesis and transportation of lipid in liver
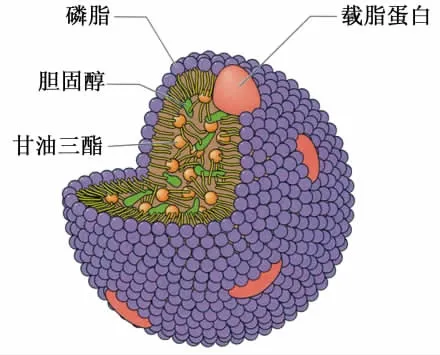
图2 VLDL颗粒结构示意图Fig.2 Scheme for the structure of VLDL particles
3.2 VLDL介导的脂肪酸转运
随着排卵的发生,肝脏中合成的VLDL在雌激素的刺激下进入血液循环并转运到卵母细胞中沉积[20]。哺乳动物中,由于外周组织中富含高活性的脂蛋白脂酶,血液循环中VLDL的甘油三酯易被水解,因而,哺乳动物机体中合成的VLDL不具有稳定性。而家禽肝脏中Apo-VLDL-Ⅱ能结合在VLDL颗粒表面(每个VLDL可结合23个Apo-VLDL-Ⅱ),一方面维持VLDL结构的稳定性;另一方面可防止转运途中甘油三酯被脂蛋白脂酶水解[21-23]。研究发现,家禽肝脏中 Apo-VLDL-ⅡmRNA表达受到雌激素的诱导[24],其表达表现出在产蛋高峰期显著上升的特点[25]。由此可见,家禽VLDL颗粒中脂蛋白所具有的特殊物理结构和生化特点有助于肝脏合成的脂肪酸顺利找到靶组织——卵巢。
综上所述,Apo-VLDL-Ⅱ对 VLDL 的转运具有重要的影响。基于其作用,小肠和肝脏分别合成体积较大和较小的2种VLDL,并表现出不同的生理特点。小肠中合成的VLDL体积较大,不能进入肝脏中修饰而被直接分泌进入血液循环。由于没 有 Apo-VLDL-Ⅱ 的 保 护(与肝 脏来 源 的VLDL相反),易被外周组织(如脂肪组织)脂蛋白脂酶水解利用,仅有少量的VLDL沉积到卵黄中。而在肝脏中合成的VLDL能在Apo-VLDL-Ⅱ的保护作用下顺利到达卵母细胞。
4 卵母细胞中脂肪酸的跨膜沉积
营养物质沉积依赖于卵母细胞的发育成熟,因而,作为脂类和其他蛋白的沉积物——卵黄前体物在卵母细胞中的沉积在时间上晚于卵母细胞的发育。成熟卵母细胞受到多层连接组织的包裹,从外到内包括:血管化连接组织、外膜和内膜、基膜或基底膜、类上皮单层颗粒细胞和透明带。VLDL与肝脏合成的卵黄生成素作为卵黄的主要前体物,须穿过外层的连接组织才能顺利到达卵母细胞完成沉积过程。卵黄生成素是肝脏中合成并在卵母细胞中沉积的另一重要脂蛋白,约占卵黄干物质的24%;卵黄生成素和VLDL共同组成卵黄前体物[20]。
4.1 卵母细胞的发育与排卵
禽类卵母细胞发育过程同哺乳动物相似,概括为:原始干细胞→卵原细胞→卵母细胞[26]。禽类卵母细胞需要经历3个阶段才能最终发育成熟[27]:第1阶段,大量的卵母细胞发生增长(需要数月时间),细胞直径大小从60 μm增加到2~3 mm,但此时没有卵黄沉积[28]。第2阶段,卵母细胞进入生长减慢阶段,直径达到6~7 mm,在此阶段,绝大部分(75%)卵母细胞可能发生闭锁(重吸收)或进入最后发育期。最后阶段,卵母细胞发生为期7 d的急速生长,并在此阶段从血液中摄取营养物质,沉积卵黄(体积约为14 mL)[29]。当卵母细胞的直径达到约30 mm时开始排卵,其排卵间隔周期为25 h。在整个卵母细胞发育的过程中,通常卵巢中有5~8个体积增长最快的卵母细胞(最大的5个卵母细胞按体积大小依次命名为F1~F5)。当最大卵母细胞(F1)发生排卵后,卵巢以一种尚不清楚的机制刺激下一个卵母细胞快速生长[30]。排卵后的卵母细胞,在受精条件下可在输卵管伞部与精子结合,随后卵母细胞的卵黄周围沉积卵白蛋白、水分,逐渐形成蛋壳膜和蛋壳,最终形成完整的蛋,整个时间持续约25 h。
4.2 卵母细胞中脂类的跨膜沉积
经过上述3个阶段的相对成熟发育后,家禽卵母细胞开始从血液中吸收营养物并形成卵黄。血液循环中VLDL和卵黄生成素所提供的脂类占卵黄中的比例较大(大于30%)。VLDL和卵黄生成素可为每个卵母细胞提供约5 g的甘油三酯和230 mg 的胆固醇[31]。
基于卵母细胞的外周连接组织的特殊结构,到达卵巢的卵黄前体物需经历以下过程才能进入卵母细胞:通过膜层上有孔的毛细血管(第1步),并以自由扩散的方式通过基底膜(第2步)、颗粒细胞的缺口和透明带,进入卵母细胞的质膜中(第3步),最后通过膜上的受体介导的内吞作用摄取卵黄前体物(第4步),从而完成了家禽肝脏中脂类合成、包装、转运和最终在卵泡中沉积的过程[29,32](图3)。当脂类等其他营养物质沉积到一定体积后,卵母细胞同透明带一起从卵泡中释放(即排卵),而排卵后的卵泡、基膜和外膜的颗粒细胞仍然保留[31]。
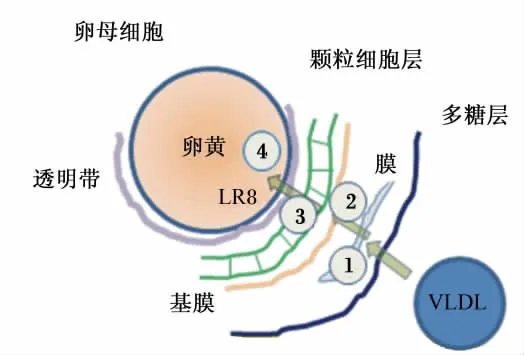
图3 卵母细胞中VLDL的跨膜沉积过程Fig.3 Multistep scheme for VLDL deposition in oocyte
VLDL颗粒体积大小直接影响脂类在卵母细胞中的沉积。正常体积(直径为25~40 nm)的VLDL可以顺利穿过卵泡的基底膜、颗粒细胞的内缺口以及透明带等“卵母细胞屏障”[31],最终与卵母细胞膜上的Apo-B特异性受体——LR8(LDL receptor 8)结合[12],经内吞作用进入卵母细胞。VLDL中的脂类发生沉积后,载脂蛋白Apo-B随即被组织蛋白酶D水解,回收和再次利用[32]。而当VLDL(如小肠合成的VLDL)的体积超过卵母细胞外层颗粒基层容纳的极限范围时,则不能穿过颗粒层与卵母细胞的受体结合。此外,体积较小的VLDL颗粒抗脂蛋白脂酶水解能力强,而较大体积的VLDL易被外周组织中高活性的脂蛋白脂酶所水解[14]。由此可见,VLDL颗粒的体积大小决定着脂肪酸在蛋中的顺利沉积与否。值得注意的是,与VLDL结合的Apo-VLDL-Ⅱ可防止VLDL体积组装过大,从而决定着该脂蛋白结构的体积[33]。
5 营养状况对家禽脂肪酸代谢及其在禽蛋中沉积的影响
脂肪酸在蛋中的沉积涉及到脂肪酸合成、组装、转运和跨膜内吞等一系列生理过程,其每一个中间环节的改变都可能影响到最终蛋中脂肪酸的沉积。
5.1 营养状况影响肝脏中脂肪酸的合成代谢
如前所述,家禽肝脏中脂肪酸的从头合成是卵黄中脂肪酸沉积的重要途径,外源性营养物质是脂肪酸从头合成的主要外源性底物。因此,机体营养状况决定着家禽肝脏中脂肪酸的合成能力,并最终影响到蛋中脂肪酸的沉积。研究发现,肉鸡饥饿条件下,肝脏中脂肪酸合成相关基因的mRNA表达显著下降,如固醇反应元件结合蛋白1(SREBP-1)、脂 肪 酸 合 成 酶 (FAS)、苹 果 酸 酶(MAE)、硬脂酰辅酶A脱饱和酶 -1(SCD-1),而其mRNA表达在摄食后又表现出上升的特点[34]。上述研究结果提示:机体营养充足时,促进家禽肝脏中脂肪酸及胆固醇的生物合成;营养缺乏时,则受到抑制。饲粮的成分也决定着肝脏中脂肪酸的合成。研究报道,提高家禽饲粮中蛋白质浓度能促进肝脏中胆固醇的合成,但同时抑制脂肪酸的合成[35]。其他动物试验表明,含高碳水化合物的饲粮可促进肝脏中脂肪酸的从头合成,而高脂肪饲粮却表现出相反的效应[36]。营养物质一方面作为底物影响脂肪酸的从头合成;另一方面可通过作用血液循环中激素,间接调控脂肪酸合成关键酶的表达与活性。体外试验已经证实,葡萄糖对家禽肝细胞中FAS和MAE的转录促进作用依赖于三碘甲状腺原氨酸(T3)的存在[37]。尽管众多研究证实了营养对脂肪酸从头合成的调控作用,但目前仍缺乏相关研究证明肝脏中脂肪酸的合成与蛋中沉积的直接关系。
5.2 营养状况影响脂肪酸的转运
Apo-B 和 Apo-VLDL-Ⅱ是肝脏中 VLDL 组装和靶向运输的重要蛋白,决定着脂肪酸在卵黄中的沉积能力。研究表明,营养限制降低了血液循环中VLDL颗粒的甘油三酯含量,并能改变VLDL 颗粒的大小[38],但肝脏中 Apo-VLDL-Ⅱ和Apo-B mRNA 表达丰度没有发生变化[39]。这表明营养状况虽然对肝脏中脂类“运输工具”没有产生影响,但却影响到“原料”的生成。
饲粮中特异性脂肪酸也是参与脂类运输调控的重要因素。研究发现,饲粮中共轭亚油酸(CLA)的添加降低血液中的甘油三酯、VLDL和LDL 水平[40],并降低肝细胞中 Apo-B100 的合成与甘油三酯的分泌[41]。因而,饲粮中CLA可能通过降低家禽肝脏中脂类的输出,最终减少卵黄中脂类沉积[42]。
5.3 营养状况影响禽蛋中脂肪酸的沉积
外源性能量底物的充足供给是蛋中脂肪酸沉积的重要前提。但能量过度摄入并非以甘油三酯等能量底物的形式贮存在蛋中,相反,过高能量摄入会造成产蛋性能的下降。研究报道,产蛋鸡摄入正常营养浓度的1.5倍长达3周后改变血浆中脂蛋白的组成,如血浆中VLDL浓度降低,高密度脂蛋白和中密度脂蛋白浓度上升,并促进血浆中VLDL体积增加,不利于甘油三酯的沉积,最终造成卵黄沉积失败,引发卵泡的重吸收[43]。可见,营养状况可通过作用脂蛋白的代谢,进而影响蛋中脂肪酸的沉积。
饲粮成分是影响蛋中脂肪酸沉积的直接因素,其中多不饱和脂肪酸可能是蛋中脂肪酸的成分,但对脂肪酸成分的作用结果并不一致。研究发现,饲粮中高含量n-3多不饱和脂肪酸(3.5%鱼油)可显著提高卵黄中n-3脂肪酸和二十二碳六烯酸含量[44]。饲粮中不同来源的多不饱和脂肪酸(如鱼油、亚麻籽等)影响到卵黄中脂肪酸的沉积,且粉碎的亚麻籽提高了卵黄中亚麻酸的水平,但全亚麻籽降低了卵黄中亚麻酸的水平[45]。其原因可能与亚麻籽外皮在肌胃的消化有关。Van Elswyk等[46]发现饲粮中添加鱼油可降低血浆中甘油三酯水平和卵黄的重量。其原因很可能是多不饱和脂肪酸具有促脂肪氧化功能,并可下调脂肪酸从头合成[47],从而对蛋中甘油三酯的沉积产生负调控效应。蛋中不饱和脂肪酸组成的改变可能会影响到蛋的风味。研究报道,饲粮中添加2%鲱鱼油长达30周,可降低各阶段的平均蛋重,并影响蛋的风味[48]。
此外,饲粮中添加CAL改变了卵黄中脂肪酸的组成。研究报道,添加CLA提高了卵黄中CLA与饱和脂肪酸的含量[49-50],但降低了卵黄中单不饱和脂肪酸含量[46]。而另有研究报道发现,饲粮中CLA的添加增加了卵黄中饱和脂肪酸的含量,降低了单不饱和脂肪酸含量,但并未影响到多不饱和脂肪酸成分[51]。近年研究表明,其他含有不饱和脂肪酸的饲料原料对蛋中脂肪酸成分也具有调节作用,如菜籽油[52]、大豆油[53]、欧鼠尾草[54]等,而关于其他营养素对蛋中脂类调节的报道目前还较少,有待进一步研究。
6 小结
蛋中脂肪酸的沉积主要是卵黄中脂肪酸的沉积过程,概括为:甘油三酯的形成、组装、运输及跨膜内吞和最终沉积等过程。因而,蛋中脂肪酸的沉积过程与胆固醇相似。到目前为此,虽然科学研究已经阐明脂肪酸的产生到沉积的生理过程,但仍有诸多问题有待揭示。首先,VLDL来源的甘油三酯在卵黄或外周组织中的分配机制,以及Apo-VLDL-Ⅱ和 Apo-B 在其靶向分配过程中的作用尚不明确。其次,饲粮中能量底物与脂肪酸的靶向沉积关系仍未阐明。再次,多项研究证实饲粮中多不饱和脂肪酸对蛋中脂肪酸沉积的调节,但其参与调控的可能环节(如脂肪酸组装、转运、沉积)及确切机制尚不清楚。因此,以上问题的解决将有助于揭示禽蛋中脂肪酸沉积的确切机制,并为脂肪酸沉积的营养调控手段提供更深入的理论支持。
[1]MORAN E T,Jr.Nutrition of the developing embryo and hatchling[J].Poultry Science,2007,86(5):1043-1049.
[2]KUKSIS A.Yolk lipids[J].Biochimica et Biophysica Acta,1992,1124(3):205-222.
[3]石天虹,黄保华,魏祥法,等.不同饲料添加剂对鸭蛋成分、蛋品质和蛋黄着色效果影响的研究[J].饲料工业,2010,31(21):7 -11.
[4]AYERZA R,COATES W.Dietary levels of chia:influence on yolk cholesterol,lipid content and fatty acid composition for two strains of hens[J].Poultry Science,2000,79(5):724-739.
[5]SUKSOMBAT W,SAMITARYOTINS,LOUNGLAWAN P.Effects of conjugated linoleic acid supplementation in layer diet on fatty acid composition of egg yolk and layer performances[J].Poultry Science,2006,85(9):1603-1609.
[6]王镜岩.生物化学[M].北京:高等教育出版社,2003:230-238.
[7]SKLAN D.Site of digestion and absorption of lipids and bile acids in the rat and turkey[J].Comparative Biochemistry Physiology,1980,65(1):91-95.
[8]POHL J,RING A,HERMANN T,et al.Role of FATP in parenchymal cell fatty acid uptake[J].Biochimica et Biophysica Acta,2004,1686(1/2):1-6.
[9]HUI T Y,BERNLOHR D A.Fatty acid transporters in animal cells[J].Frontiers in Bioscience,1997(2):D222-D231.
[10]KANEKO J J,HARVEY J W,BRUSS M L.Clinical biochemistry of domestic animals[M].6th ed.London:Elsevier’s Science and Technology,2008.
[11]GRIMINGER P.Lipid metabolism[M].4th ed.New York:Springer Verlag,1986.
[12]SAADOUN A,LECLERCQ B.Comparison of in vivo fatty acid synthesis of the genetically lean and fat chickens[J].Comparative Biochemistry and Physiology,1983,75(4):641-644.
[13]KLASING K C.Comparative avian nutrition[M].Wallingford:CAB International,1998.
[14]周顺伍.动物生物化学[M].3版.北京:中国农业出版社,2001:126-133.
[15]DASHTI N,KELLEY J L,THAYER R H,et al.Concurrent inductions of avian hepatic lipogenesis,plasma lipids,and plasma apolipoprotein B by estrogen[J].Journal of Lipid Research,1983,24(4):368-380.
[16]RADENNE A,AKPA M,MARTEL C,et al.Hepatic regulation of fatty acid synthase by insulin and T3:evidence for T3genomic and nongenomic actions[J].Endocrinology and Metabolism,2008,295(4):E884-E894.
[17]CHAPMAN M J.Animal lipoproteins,chemistry,structure,and comparative aspects[J].Journal of Lipid Research,1980,21(7):789 -853.
[18]BEHR S R,PATSH J R,FORTE T,et al.Plasma lipoprotein changes resulting from immunologically blocked lipolysis[J].Journal of Lipid Research,1981,22(3):443-451.
[19]TARUGI P,ALBERTAZZI L,NICOLINI S,et al.Absence of apolipoprotein B-48 in the chick,Gallus domesticus[J].Journal of Lipid Research,1990,31(3):417-427.
[20]SPEAKE B K,MURRAY A M,NOBLE R C.Transport and transformations of yolk lipids during development of avian embryo[J].Progress in Lipid Research,1998,37(1):1-32.
[21]WISKOCIL R,GOLDMAN P,DEELEY R G.Cloning and structural characterization of an estrogen-dependent apolipoprotein gene[J].The Journal of Biological Chemistry,1981,256(18):9662-9667.
[22]WISKOCIL R,BENSKY P,DOWER W,et al.Co-ordinate regulation of two estrogen-dependent genes in avian liver[J].Proceedings of the National Academy of Sciences of the United States of America,1980,77(8):4474-4478.
[23]SCHNEIDER W J,CARROLL R D,SEVERSON D L,et al.Apolipoprotein VLDL-Ⅱ inhibits lipolysis of triglyceride-rich lipoproteins in the laying hen[J].Journal of Lipid Research,1990,31(3):507-513.
[24]DING S T,YEN C F,WANG P H,et al.The differential expression of hepatic genes between prelaying and laying geese[J].Poultry Science,2007,86(6):1206-1212.
[25]YEN C F,JIANG Y N,SHEN T F,et al.Cloning and expression of the genes associated with lipid metabolism in Tsaiya ducks[J].Poultry Science,2005,84(1):67-74.
[26]WASSARMAN P M,JOSEFOWICZ W J.Oocyte development in the mouse:an ultrastructural comparison of oocytes isolated at various stages of growth and meiotic competence[J].Journal of Morphology,1978,156(2):209-235.
[27]SCHNEIDER W J.Yolk precursor transport in the laying hen[J].Current Opinion in Lipidology,1995,6(2):92-96.
[28]SCHJEIDE O A,GALEY F,GRELLERT E A,et al.Macromolecules in oocyte maturation[J].Biology of Reproduction,1970,2(Suppl.2):14-43.
[29]PERRY M M,GILBERT A B,EVANS A J.Electron microscope observations on the ovarian follicle of the domestic fowl during the rapid growth phase[J].Journal of Anatomy,1978,125(Pt.3):481-497.
[30]BUJO H,HERMANN M,LINDSTEDT K A,et al.Low density lipoprotein receptor gene family members mediate yolk deposition[J].The Journal of Nutrition,1997,127(Suppl.5):S801-S804.
[31]SCHNEIDER W J.Receptor-mediated mechanisms in ovarian follicle and oocyte development[J].General and Comparative Endocrinology,2009,163(1/2):18-23.
[32]NIMPF J,RADOSAVLJEVIC M,SCHNEIDER W J.Specific postendocytic proteolysis of apolipoprotein-B in oocytes does not abolish receptor recognition[J].Proceedings of the National Academy of Sciences of the United States,1989,86(3):906-910.
[33]WALZEM R L,HANSEN R J,WILLIAMS D L,et al.Estrogen induction of VLDLy assembly in egglaying hens[J].The Journal of Nutrition,1999,129(Suppl.2):S467-S472.
[34]WANG P H,KO Y H,CHIN H J,et al.The effect of feed restriction on expression of hepatic lipogenic genes in broiler chickens and the function of SREBP1[J]. Comparative Biochemistry and Physiology,2009,153(4):327-331.
[35]YEH S J,LEVEILLE G A.Cholesterol and fatty acid synthesis in chicks fed different levels of protein[J].The Journal of Nutrition,1972,102(3):349-357.
[36]GIRARD J,PERDEREAU D,FOUFELLE F,et al.Regulation of lipogenic enzyme gene expression by nutrients and hormones[J].The FASEB Journal,1994,8(1):36-42.
[37]HILLGARTNER F B,CHARRON T.Glucose stimulates transcription of fatty acid synthase and malic enzyme in avian hepatocytes[J].The American Journal of Physiology,1998,274(3):E493-E501.
[38]LIEN T F,JAN D F,CHEN K L.Lipoprotien profiles and components in Tsaiya ducks under ad libitum feeding and fasting[J].Comparative Biochemistry and Physiology,2005,142(3):325-330.
[39]RICHARDS M P,POCH S M,COON C N,et al.Feed restriction significantly alters lipogenic gene expression in broiler breeder chickens[J].The Journal of Nutrition,2003,133(3):707-715.
[40]LEE K N,PARIZA M W,NTAMBI J M.Conjugated linoleic acid decreases hepatic stearoyl-CoA desaturase mRNA expression[J].Biochemical Biophysical Research Communications,1998,248(3):817 -821.
[41]AYDIN R,COOK M E.The effect of dietary conjugated linoleic acid on egg yolk fatty acids and hatchability in Japanese quail[J].Poultry Science,2004,83(12):2016-2022.
[42]GAO Y C,CHARTER E A.Nutritionally important fatty acids in hen egg yolk from different sources[J].Poultry Science,2000,79(6):921-924.
[43]WALZEM R L,DAVIS P A,HANSEN R J.Overfeeding increases very low density lipoprotein diameter and causes the appearance of a unique lipoprotein particle in association with failed deposition[J].Journal of Lipid Research,1994,35(8):1354-1366.
[44]CHERIAN G.Egg quality and yolk polyunsaturated fatty acid status in relation to broiler breeder hen age and dietary n-3 oils[J].Poultry Science,2008,87(6):1131-1137.
[45]BOTSOGLOU NA,YANNAKOPOULOS AL,FLETOURIS D J,et al.Yolk fatty acid composition and cholesterol content in response to level and form of dietary flaxseed[J].Journal of Agricultural and Food Chemistry,1998,46(11):4652-4656.
[46]VAN ELSWYK M E,HARGIS B M,WILLIAMS J D,et al.Dietary menhaden oil contributes to hepatic lipidosis in laying hens[J].Poultry Science,1994,73(5):653-662.
[47]SAMPPATH H,NTAMBI J M.Polyunsaturated fatty acid regulation of genes of lipid metabolism[J].Annual Review of Nutrition,2005,25:317-340.
[48]GONZALEZ-ESQUERRA R,LEESON S.Effect of feeding hens regular or deodorized menhaden oil on production parameters,yolk fatty acid profile,and sensory quality of eggs[J].Poultry Science,2000,79(11):1597-1602.
[49]CHERIAN G,HOLSONBAKE T B,GOEGER M P,et al.Dietary CLA alters yolk and tissue FA composition and hepatic histopathology of laying hens[J].Lipids,2002,37(8):751-757.
[50]CHERIAN G,GOEGER M P,AHN D U.Dietary conjugated linoleic acid with fish oil alters yolk n-3 and trans fatty acid content and volatile compounds in raw,cooked,and irradiated eggs[J].Poultry Science,2002,81(10):1571-1577.
[51]RAES K,HUYGHEBAERT G,DE SMET S,et al.The deposition of conjugated linoleic acids in eggs of laying hens fed diets varying in fat level and fatty acid profile[J].The Journal of Nutrition,2002,132(2):182-189.
[52]ROWGHANI E,ARAB M,NAZIFI S,et al.Effect of canola oil on cholesterol and fatty acid composition of egg-yolk of laying hens[J].International Journal of Poultry Science,2007,6(2):111-114.
[53]MUANGKEOW N.Effects of feeding soybean and palm blended oil on laying performance and egg quality[J].Walailak Journal of Science and Technology,2011,8(1):51-61.
[54]AYERZA R,COATES W.Omega-3 enriched eggs:the influence of dietary α-linolenic fatty acid source on egg production and composition[J].Canadian Journal of Animal Science,2001,81:355-361.
