枇杷蜜中脱落酸、多酚的测定及其指纹图谱的研究
2012-09-11孙崇臻吴希阳黄才欢
孙崇臻,吴希阳,黄才欢
暨南大学理工学院食品科学与工程系,广州 510632
枇杷蜜是我国南方特有蜜种,不仅蜜质细腻、营养丰富,而且具有润肺、化痰、止咳的功效,受消费者和制药厂家的喜爱[1]。目前国内对枇杷蜜的系统研究较少,仅在蜂蜜抗氧化性研究中有少数报道[2,3]。脱落酸作为一种植物激素,其含量变化与植物的种类及生长环境密切相关[4]。将脱落酸的检测与蜂蜜蜜源识别相结合的研究国外已有报道[5-8],国内则较少[9]。酚类作为微量活性物质在不同植物中分布差异较大,可以利用其差异来进行植物来源的判别,目前国内外对蜂蜜中酚类的研究相对比较成熟[10-15]。蜂蜜指纹图谱就是应用现代分析技术对蜂蜜中的糖类、蛋白质及微量活性物质等化学成分信息以图形(图像)的方式进行表征并加以描述,利用它可以对蜂蜜的种类进行识别[16-19],同时为蜂蜜的掺假检测提供依据。
本研究采用高效液相色谱-二极管阵列检测技术同时对我国的10种枇杷蜜中的脱落酸及13种酚类进行检测,制定了枇杷蜜的HPLC指纹图谱,并通过掺入油菜蜜的实验对标准图谱进行了验证。枇杷蜜酚类与脱落酸的分析及其指纹图谱的建立对枇杷蜜的掺假检测及功能性研究提供了依据。
1 材料与方法
1.1 样品采集
从各大超市购买的来自广东、广西、浙江、福建、江西五省的10个知名品牌的枇杷蜜(标记为P1-P10),湖北、浙江的油菜蜜(标记为G1、G2),用于酚类及脱落酸的测定(表1)。
1.2 化学试剂
没食子酸、原儿茶酸、槲皮素、芦丁、3,4-二甲氧基肉桂酸、Amberlite XAD-2吸附树脂(Sigma公司);咖啡酸、α-儿茶酸、p-香豆酸、阿魏酸、柚皮素、木犀草素、山奈酚、芹菜素(成都生物技术有限公司);脱落酸(上海佳和生物科技有限公司)。甲醇(色谱级,霍尼韦尔)、乙醚、甲酸(分析纯,天津市大茂化学试剂厂);水为超纯水、蒸馏水两种。
1.3 主要仪器
LC-20AT型高效液相色谱仪,配备SPD-M20A二极管阵列检测器,CBM-20A系统控制器(日本岛津公司);Welch XtimateTMC18(250 mm × 4.6 mm,5 μm,上海月旭科技有限公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪予华仪器厂);ZFQ-85A旋转蒸发仪(上海医械专机厂);B-260型恒温水浴锅(上海亚荣生化仪器厂);无菌注射器(广东康尔美医疗器械有限公司);0.45 μm微孔滤膜(天津津腾实验设备有限公司)。
1.4 色谱条件
Welch XtimateTMC18色谱柱(250 mm ×4.6 mm,5 μm);检测温度为35℃;检测波长为260 nm、285 nm、320 nm;流动相为甲醇与5%甲酸水溶液(5:95);洗脱梯度:时间为0-5-10-30-40-41-54-54.5-55-60 min,对应甲醇含量为5-20-30-45-60-65-70-100-5-5%;流速为 0.8 mL/min;进样量为 10 μL。
1.5 样品处理
对Yao[12]等报道的多酚提取条件进行改进:准确称取100 g蜂蜜样品与500 mL pH为2的盐酸水溶液混合,磁力搅拌3 min,混匀后通过滤布除去溶液中的固体颗粒。将滤液与150 g Amberlite XAD-2树脂(孔径9 nm,粒度0.3 ~1.2 mm)混合,磁力搅拌10 min,使多酚物质被充分吸附。将树脂颗粒装入玻璃柱(55×3.0 cm)中,依次用250 mL盐酸溶液(pH=2)与300 mL蒸馏水冲洗柱子,除去糖类物质及其他杂质。用400 mL甲醇将酚类物质洗出,并将洗脱液在45℃下真空旋转蒸干,残留物用5 mL水溶解,再用15 mL乙醚分三次萃取。乙醚提取物混合后在30℃条件下去除乙醚,干渣用1 mL甲醇复溶,0.45 μm滤膜过滤后置于4℃冰箱保存待测。
1.6 标准溶液的配制
分别称取各标准品10 mg置于10 mL棕色容量瓶中,加入甲醇溶解并定容至刻度,配成浓度为1.0 mg/mL的标准储备液,并置于4℃冰箱中避光保存,其它浓度标准品由储备液稀释得到。
2 结果与讨论
2.1 色谱条件的优化
2.1.1 检测波长的选择
用二极管阵列检测器对14种标准品在200~400 nm波长范围内进行扫描,得出各组分的最大吸收波长,主要集中在 260、280、285、320、360 nm 五个波长。在这5个波长下对60 μg/mL的混合标准品进行检测,发现在260、285及320 nm波长下的分离效果最好,干扰最小,故选择这三个波长作为检测波长。
2.1.2 洗脱梯度的选择
参考本课题组前期研究[9]的洗脱条件,在35℃检测条件下,用甲醇与5%甲酸水溶液作流动相,以0.8 mL/min的流速对样品进行分析。当进样量是20μL时,发现各物质洗脱时间的间隔较大,并且最后两种物质未被完全洗出,分析原因是所用柱子不同对物质的吸附能力不同所致,故对洗脱梯度进行了调整,时间为 0-5-10-30-40-41-54-54.5-55-60 min时,对应甲醇含量5-20-30-45-60-65-70-100-5-5%。在此洗脱梯度下,样品中的14种物质在50 min内得到较好分离效果。
2.1.3 进样量的选择
在2.1.2 的洗脱条件下,对浓度为60 μg/mL 的混合标准品进样20 μL,发现在260 nm波长下1号峰出现双峰,分析主要原因有:一是标准品溶液的固有浓度过高;二是进样量偏大。于是在同样的条件下对浓度为20 μg/mL的混合标准品进样20 μL,发现双峰并未消失,因此排除固有浓度高的原因。然后对浓度为60 μg/mL的混合标准品进样10 μL,发现双峰情况消失,可以说明双峰的出现确实是因为进样量过高,确定最终进样10μL。
2.2 色谱条件的确定
由上述实验确定分离14种物质的最终检测条件为:检测波长 260、285、320 nm,进样量 10 μL,流速0.8 mL/min,柱温35℃,洗脱梯度为0-5-10-30-40-41-54-54.5-55-60 min时,对应甲醇含量5-20-30-45-60-65-70-100-5-5%。在此条件下对浓度为60 μg/mL的混合标准物进行检测,结果如图1所示。

图1 波长260 nm下标准品图谱Fig.1 HPLC-DAD chromatogram of the 14 mixed standards at 260 nm
由图1可知,14种物质在50 min内得到较好分离,出峰时间分布均匀,这与前期研究方法[9]相比,分析时间明显缩短。
2.3 标准曲线的建立
取标准储备液适量,配制质量浓度为1.5、5、20、76、110、150、230、300 μg/mL 的混合标准溶液。在已确定的色谱条件下,对不同浓度的混合标准品进样分析,平行测定三次,根据平均峰面积与标准物质的含量关系进行线性回归,相关系数在0.9990到0.9999 之间,表明在 1.5 μg/mL 到300 μg/mL 的浓度范围内,各对照品质量浓度与峰面积相关性良好。
2.4 精密度试验及加标回收试验
取浓度为60 μg/mL的混合标准品,日内重复进样6次,求得各色谱峰保留时间的RSD在0.05%~1.87%之间,峰面积的RSD 在2.02% ~3.37%之间,色谱峰的个数及特征没有明显变化,精密度较好。
取已知含量的样品P1三份,各100 g,加入0.2 mL质量浓度为110 μg/mL的混合标准品溶液,按照样品处理方法1.5进行处理,在1.4的色谱条件下进行测定。结果表明,除没食子酸、原儿茶酸外,其余12种物质加标回收率均高于85%,表明在确定的实验条件下回收率良好。
2.5 样品的测定
根据已确定的色谱条件对不同产地的枇杷蜜进样分析,测定各物质的含量,结果见表1及图2。同时对湖北、浙江两省的油菜蜜进样分析,结果见表2及图2。
由表1可知,14种检测组分在枇杷蜜中的分布不同,其中α-儿茶酸、芦丁、脱落酸含量最高,三者平均占总组分含量的68.9%,而3,4-二甲氧基肉桂酸、芹菜素含量则较低,这与本课题组的前期研究[9]结论一致;就总酚而言,不同产地枇杷蜜的总酚含量不同,其中广东、浙江两省相对较高,分别平均为420.2、476.7 μg/100 g 蜂蜜;广西、江西两省的总酚含量则较低;就酚酸与黄酮的分布而言,10个样品的总酚酸含量均显著高于总黄酮含量,这为枇杷蜜的功能性研究提供参考。

表1 不同产地枇杷蜜中脱落酸及13种多酚测定结果Table 1 Concentrations of abscisic acid and 13 phenolic compounds in loquat honey samples from different places

图2 波长260 nm下的蜂蜜图谱Fig.2 HPLC-DAD chromatograms of honey samples at 260 nm F2、F4、F8均为未知物;P2、P4、P8分别为广西、浙江、广东枇杷蜜;G1为湖北油菜蜜
由图2可知,在260 nm下14种标准物质均被检出,但出峰情况有所不同,芦丁、3,4-二甲氧基肉桂酸及脱落酸峰高相对较大,出峰时间比较集中(30.485 ~36.143 min),而柚皮素、木犀草素及芹菜素峰高则较小,出峰时间相对分散(41.813~48.533 min);不同品种的蜂蜜各物质分布不同,油菜蜜中各物质峰高较大,分布比较均匀,而枇杷蜜中各物质的峰高分布差异较大。此外,不同产地枇杷蜜的图谱存在差异,但均含有未知组分F,油菜蜜中则没有,通过波长扫描及峰形分析,可知此组分并非是纯物质,而是混合物。
2.6 掺入油菜蜜试验
将油菜蜜G1与已知含量的枇杷蜜P6以五种不同比例混合(表2:H1-H5),按照确定的实验条件进行处理测定。结果如表2所示。
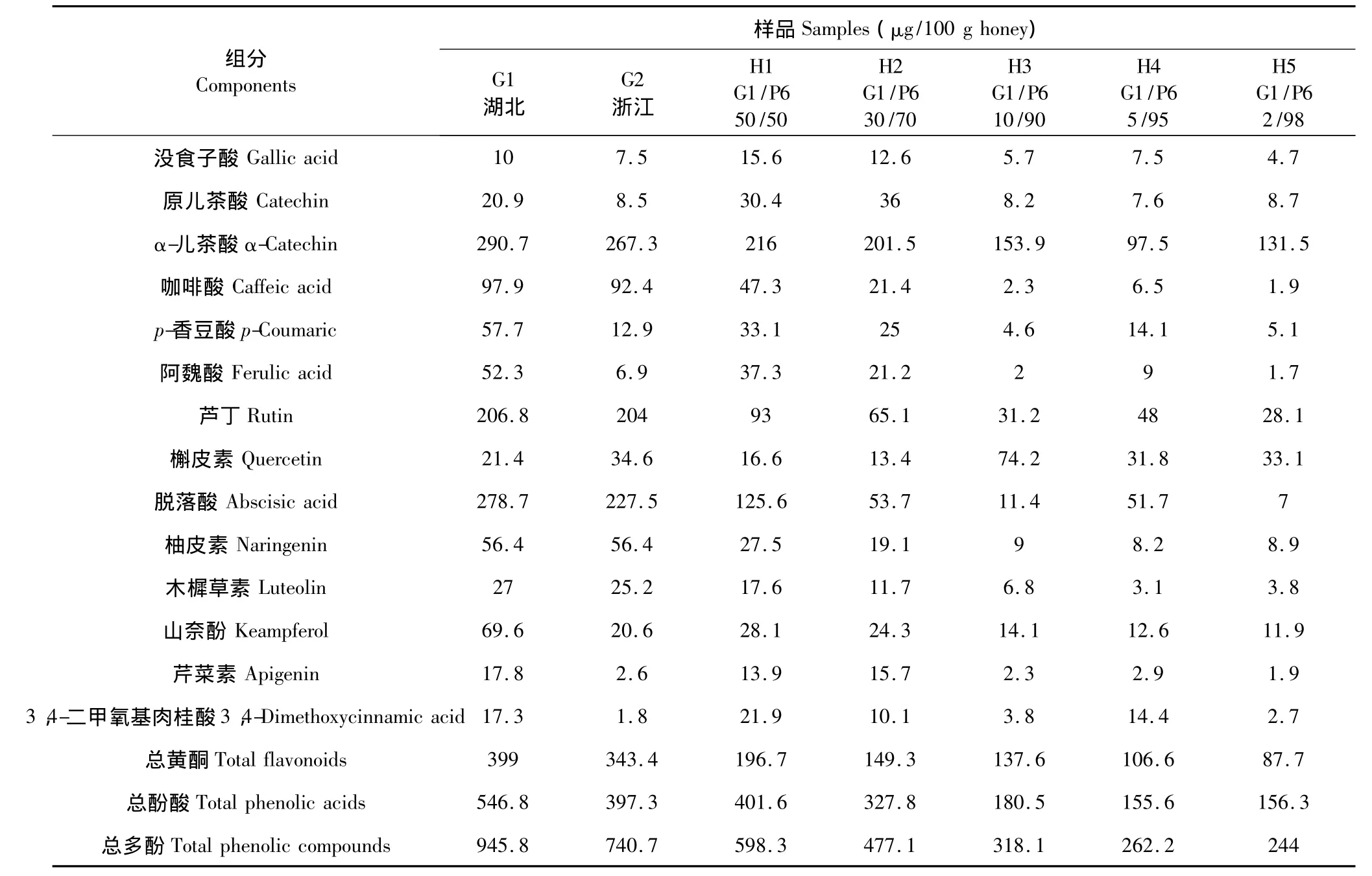
表2 油菜蜜及混合蜜样品中脱落酸及13种多酚测定结果Table 2 Concentrations of abscisic acid and 13 phenolic compounds in rapeseed honey and mixed honey samples
由表2可知,两种油菜蜜的总酚含量均大于700 μg/100 g蜂蜜,其中总酚酸含量平均为472.5 μg/100 g蜂蜜,显著高于总黄酮含量(平均为371.2 μg/100 g蜂蜜);对比表1及表2可知,不同蜜种各物质的含量有明显差异,这与前期研究[9]结论一致。其中油菜蜜中的α-儿茶酸、芦丁及脱落酸显著高于三者在枇杷蜜中的含量分布;不同种类蜂蜜中总酚含量不同,油菜蜜的总酚含量(平均为843.3 μg/100 g蜂蜜)显著高于枇杷蜜的总酚含量(平均为391.2 μg/100 g 蜂蜜)。
此外,掺入不同比例油菜蜜的混合蜜中各物质的含量不同,除没食子酸、槲皮素外,其余12种物质含量从H1到H5呈现减少趋势,这与其在油菜蜜G1及枇杷蜜P6中的含量分布有关;分析总酚的含量可知,不同混合蜜中总酚含量不同,掺入油菜蜜的量越少其总酚含量越接近枇杷蜜P6的固有含量(263.4 μg/100 g),当掺入量为 95%(H4)时其总酚含量与P6的总酚含量基本一致;对比表1及表2可知,掺入量为50%(H1)时,总酚含量(598.3 μg/100 g)接近 G1、P6 总酚含量的平均值(604.6 μg/100 g),掺入10%的油菜蜜总酚含量已有明显差异,因此利用总酚含量可以进行10%以上的掺假鉴别。
2.7 枇杷蜜指纹图谱的制定
根据中药色谱指纹图谱相似度评价系统(2004A版)对10批枇杷蜜的图谱进行处理,设定时间宽度为0.3 min,通过多点校正及自动匹配构造枇杷蜜的指纹图谱,生成含有15个共有峰的对照图谱(图3),计算这15个共有峰在10种枇杷蜜中的相对保留时间。结果显示,相对保留时间的RSD均小于 0.74%。

图3 10种枇杷蜜HPLC图谱与对照指纹图谱(260 nm)Fig.3 HPLC matched chromatograms of 10 batches loquat honey samples and the reference fingerprint at 260 nm
西南大学的王文静[17]利用高效液相色谱技术对洋槐蜜中的黄酮类化合物进行研究,找出7个共有峰,建立了洋槐蜜指纹图谱;吉林农业大学的董蕊[18]利用高效液相色谱技术对椴树蜜、苕子蜜及刺槐蜜中的17种氨基酸进行了分析,并建立了相关指纹图谱。本研究则利用高效液相色谱技术建立了南方特有蜜种-枇杷蜜的脱落酸及酚类指纹图谱,找出15个共有峰。
将15个共有峰与14种标准物质进行保留时间与紫外吸收光谱的对比,可以对11个共有峰进行判定,峰2~6分别为原儿茶酸、α-儿茶酸、咖啡酸、p-香豆酸、阿魏酸;峰8~10分别为芦丁、3,4-二甲氧基肉桂酸、槲皮素;峰13~15则分别对应柚皮素、木犀草素、山奈酚。枇杷蜜指纹图谱的制定扩大了蜜种检测范围,为单花蜜的判别提供依据。
2.8 相似度评价及枇杷蜜指纹图谱的验证
采用中位数法对10个品牌的枇杷蜜进行相似度评价,并将油菜蜜G1、G2及混合蜜H1至H5与枇杷蜜的对照图谱进行相似度分析,从而对指纹图谱进行验证,结果如表3及表4所示。

表3 枇杷蜜所有峰与对照图谱的相似度Table 3 Similarity of loquat honey samples and reference fingerprint
由表3可知,10种枇杷蜜与对照图谱的相似度在0.920-0.997之间,相似度良好,符合构造指纹图谱的要求(0.9 ~1.0)。

表4 油菜蜜、混合蜜所有峰与对照图谱的相似度Table 4 Similarity of rape honeys,mixed honeys and reference fingerprint
从油菜蜜G1、G2与对照图谱的相似度可知,油菜蜜与枇杷蜜的相似度极低(小于0.4),指纹图谱的制定可有效区分这两种蜂蜜;混合蜜H1、H2与对照图谱的相似度均小于0.9,说明本实验的指纹图谱可用于鉴别30%以上的油菜蜜掺假。与利用总酚含量判别掺假程度(10%以上)相比,利用指纹图谱的相似度评价虽然只能判别30%以上的蜂蜜掺假,但是相对更简便,更快速。
西北大学的周梦遥[19]利用HPLC-ECD技术制定了向日葵蜜的多酚类指纹图谱,相似度在0.778至0.978之间,并利用相似度的分析成功鉴别出50%以上的果葡糖浆掺假。本研究制定的枇杷蜜的指纹图谱,相似度均在0.92以上,并能成功鉴别出30%以上的油菜蜜掺假。
3 结论
目前蜂蜜掺假手段日益多样化,使我国的现行标准面临挑战,质量监管遇到困难,尤其是近几年出现的高价单花蜜中添加廉价蜜的掺假现象,使我们的检测更加举步维艰,因此建立快速高效的检测标准变得十分迫切。本研究对不同省份不同品牌的枇杷蜜进行脱落酸及13种多酚的测定,成功的对其进行定性定量分析,制定出枇杷蜜的标准指纹图谱,并通过掺入不同含量油菜蜜的实验对指纹图谱进行了验证,这对枇杷蜜的质量控制及功能性分析有重要意义。实验中发现的混合物F在枇杷蜜中占相当比例,对其需要做进一步的分析研究。此外,高价单花蜜中掺入的廉价蜜除了油菜蜜以外,还有其它蜜种可以掺入,因此,需要对更多的蜜种进行研究。
1 Deng HY(邓晖尤).Loquat source in Sichuan province.J Bee(蜜蜂杂志),2006,2:29-30.
2 Lou M(娄敏),Zheng P(郑鹏),Li X(李霞),et al.Determination of naringin in pear loquat syrup by HPLC.Chin J Experi Tradit Med Formulae(中国实验方剂学杂志),2007,13:9-10.
3 Cao W(曹炜),Chen WJ(陈卫军),Song JR(宋纪蓉),et al.The antioxidant activities and total phenolic contents of ten different types of Chinese honey-especially buckwheat honey.Food Sci(食品科学),2005,26:352-356.
4 Liu HJ(刘红娟),Liu Y(刘洋).Progress of research on the influence of abscisic acid in plant resistance.Biotec Bul(生物技术通报),2008,6:7-9.
5 Federico F,Paula A,Francisco A.Natural occurrence of abscisic acid in heather honey and floral.Agric Food Chem,1996,44:2053-2056.
6 Yao LH,Jiang YM,SinganusongR,et al.Phenolic acids and abscisic acid in Australian Eucalyptus honeys and their potential for floral authentication.Food Chem,2004,86:169-177.
7 Izabela JM,Anna P,Malgorzata D.Phenolic compounds and abscisic acid as potential markers for the floral origin of two Polish unifloral honeys.Food Chem,2011,131:1149-1156.
8 Jasan B,Mojca K,Terezija G.LC-DAD-ESI/MS analysis of flavonoids and abscisic acid with chemometric approach for the classification of Slovenian honey.Food Chem,2011,127:296-302.
9 Sun CZ(孙崇臻),Wang C(王超),Wu XY(吴希阳).Determination of flavonoids,phenolic acids and abscisic acid in eight honeys by HPLC.Food Sci(食品科学),received.
10 Isabel E,Melinda K,Eva D.Using flavonoids,phenolic compounds and headspace volatile profile for botanical authentication of lemon and orange honeys.Food Res Inter,2011,40:1504-1513.
11 Mustafa K,Mouna A,Mohd RM.Ellagic acid,phenolic acids and flavonoids in Malaysian honey extracts demonstrate in vitro anti-inflammatory activity.Nutri Res,2010,30:650-659.
12 Yao LH,Jiang YM,Singanusong R,et al.Flavonoids in Australian Melaleuca,Guioa,Lophostemon,Banksia and Helianthus honeys and their potential for floral authentication.Food Res Inter,2004,37:166-174.
13 Lsabel M,Moncef C,Federico F,et al.Flavonoid composition of Tunisian honeys and propolis.J Agric Food Chem,1997,45:2824-2829.
14 Li J(李菁),Zhu Q(朱青),Huang WY(黄婉玉),et al.Determination of three phenolic components in acacia honey by high performance liquid chromatography.Apic Chin(中国蜂业),2009,60(12):10-12.
15 Guo XL(郭夏丽),Luo LP(罗丽萍),Leng TT(冷婷婷),et al.Chemical compositions and antioxidant activities of seven honeys from different floral sources.Nat Prod Res Dev(天然产物研究与开发),2010,22:665-670.
16 Luo XL(罗显来),Liu Y(刘吟),Huang W(黄文).Study on the fingerprint of rape honeys produced in Hubei province.Apic Chin(中国蜂业),2010,61(4):10-13.
17 Wang WJ(王文静).A study on the HPLC fingerprint of Robinia honeys produced in China.Chongqing:Southwest Univ(西南大学),MSc.2008.
18 Dong R(董蕊).On the infrared spectra fingerprint and antioxidant activities of vetch honey,linden honey and acacia honey.Jilin:Jilin Agric Univ(吉林农业大学),PhD.2011.
19 Zhou MY(周梦遥).Determination of phenolic compounds and study on fingerprint of honey.Shaanxi:Northwest Univ(西北大学),MSc.2011.
