生长素和脱落酸在草莓果实发育过程中的作用
2017-03-21贾海锋赵密珍王庆莲
贾海锋+赵密珍+王庆莲
摘要:草莓果实是非呼吸跃变型果实,关于其发育成熟的机理研究较少。以八倍体草莓甜查理为试材,分析了果实发育过程中脱落酸ABA和生长素IAA的含量,同时用ABA和IAA处理转色期的草莓果实,发现ABA能加速果实着色软化,抑制IAA的积累;相反IAA抑制果实着色软化,抑制ABA的积累。进一步分析表明ABA能降低IAA合成代谢路径中基因的表达水平,而IAA能降低ABA合成代谢路径中基因的表达水平。ABA能促进果实成熟相关基因的表达,包括与果实上色有关的基因如查尔酮合酶等,和与果实软化有关的基因如伸展蛋白基因等;但IAA表现为抑制。果实上色与软化直接影响草莓成熟进程。这些结果说明ABA和IAA协同调控了草莓果实的发育进程,为以后草莓果实品质的改善和育种提供了思路。
关键词:草莓果实;脱落酸;生长素;基因表达
中图分类号:S668.404;S482.8 文献标志码:A
文章编号:1002-1302(2016)11-0173-04
草莓(Fragaria×ananassa Duch.)是一种重要的鲜食和加工水果,具有可口的风味和丰富的营养成分[1]。草莓在成熟过程中无特定的呼吸峰和乙烯峰,由于其有体积小、易于传代、营养生长期短和果实生长迅速(果实成熟只需要1个月左右)的特点,草莓因此成为研究非呼吸跃变型果实成熟机理的模式植物[2-3],也是大规模的番茄成熟机理研究之后把大量有关成熟基因用于基因功能分析和转基因研究的又一重要的水果种类[4-5]。目前大多数研究认为,草莓属于典型的非呼吸跃变型果实[6-7]。植物激素脱落酸(abscisic acid,ABA)不仅能促进草莓果实对糖的吸收[8-9],而且在草莓果实成熟调控过程中发挥重要的作用[6,10-12]。ABA在其他非呼吸跃变型果实中也起着核心作用,比如在樱桃果实成熟过程中,ABA参与了果实的生长发育与成熟;柑橘成熟过程中积累了大量的ABA;并且越来越多的研究也表明,ABA参与果实发育和成熟过程的调控[13]。与大量的关于ABA对果实成熟调控的报道不同,作为一个经典的植物激素——生长素(auxin,IAA)的作用并未在果实发育过程中有过多的研究。IAA与ABA作用相反,能延迟植物的衰老死亡。很多的证据表明,在果实的后熟过程中,果实全熟前IAA的含量持续下降直到最低水平为止。陈昆松等分析认为猕猴桃果实中内源IAA的含量随着果实的成熟呈下降趋势,随着IAA含量的下降,开始出现乙烯跃变峰[14]。用IAA处理猕猴桃果实能促进内源IAA的积累,使ABA水平下降,推迟ABA峰值出现,最后延迟果实的软化成熟。在许多果实中,成熟总是伴随着IAA含量的下降。田建文等研究柿子中激素含量的变化也得出了同样的结果[15]。因此,他们认为果实在完全成熟前,IAA必须先经过氧化以降低在果实中的含量,果实才能成熟。周丽萍等的研究也认为IAA水平的下降可以导致细胞对乙烯更为敏感[16];IAA可使呼吸跃变型果实延迟成熟,果实开始全熟是由于IAA失去了激素的作用所致,但其机理并不清楚。
本研究通过对甜查理草莓果實成熟过程中内源ABA和IAA含量的动态变化,外源ABA和IAA处理对草莓果实成熟的影响,对ABA和IAA与草莓果实成熟的关系进行了探讨。
1 材料与方法
1.1 试验材料
试验材料为杜克拉草莓(Fragaria×ananassa‘sweet charlie),于2014年取自江苏省农业科学院试验基地。采集花后7~28 d的果实,参照文献[17],将果实划分为 7个时期:小绿(幼果期,花后7 d)、大绿(大果期,花后14 d)、浅绿(绿熟期,花后18 d)、纯白(白熟期,花后21 d)、始红(始熟期,花后 23 d)、片红(转色期,花后25 d)、全红(成熟期,花后 28 d)。每个时期样品设置3个重复。摘取鲜样后立即用刀片将果肉与种子分离,收集果肉液氮冷冻,贮存于-80 ℃超低温冰箱中待用。
1.2 总RNA的提取及cDNA第一链的合成
用EASYspin植物RNA快速提取试剂盒(北京博迈德科技发展有限公司)提取草莓果实中的总RNA。以提取的总RNA为模板,利用Clontech SMARTTM Library试剂盒(美国Clontech公司)合成cDNA第一链用于扩增基因片段。
1.3 草莓果肉中ABA含量和IAA含量的测定
用酶联免疫法测定果肉中ABA和IAA含量。从冰箱中取各时期果肉,称取0.5~1.0 g样品,加入提取液,于冰浴中研磨匀浆,转入10 mL试管中,分次用2 mL提取液冲洗研钵,一并转入试管中,摇匀置于4 ℃冰箱中浸提4 h后1 000 g离心15 min,收集上清,沉淀中加入1 mL提取液摇匀,4 ℃浸提1 h后1 000 g离心15 min,合并上清并记录体积,弃去残渣,将上清转入5 mL塑料离心管中,氮气吹干,除去甲醇,用样品稀释液定容待测样品。具体测定程序按照中国农业大学出售试剂盒操作说明进行。ABA和IAA含量通过美国BioTek公司生产的ELx800TM通用酶标仪测定,试验重复3次。
1.4 实时荧光定量PCR分析
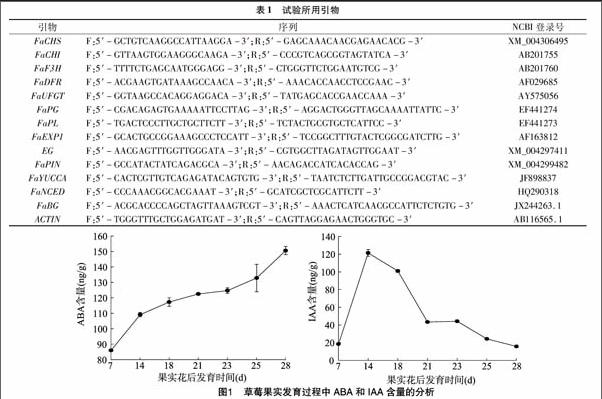
对7个时期样品分别提取总RNA,并加入DNaseⅠ酶去除DNA污染,体系为2 μL DNA酶、45 μL总RNA和5 μL DNaseⅠ酶buffer。37 ℃放置12~15 min,然后用RNA清洁试剂盒纯化RNA(北京博迈德科技发展有限公司),并使用MMLV First cDNA Synthesis Kit(上海生物工程技术服务有限公司)合成第一链cDNA,利用软件Primer 5设计荧光引物。引物序列见表1。
以ACTIN为内参基因,按照SYBR Premix Ex TaqTM试剂盒(宝生物工程有限公司)操作指导,采用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)的方法,检测基因的相对表达量。
对反转录所得的cDNA分别进行5个梯度稀释(1、10-1、10-2、10-3、10-4),实施荧光定量PCR反应,然后绘制相对标准曲线。相关基因和内参ACTIN基因RT-qPCR扩增的总反应体系为20 μL,包括10 μL SYBR Premix Ex Taq混合液、2 μL cDNA、0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、7.2 μL无核酸污染的灭菌水。反应程序为 94 ℃ 2 min;94 ℃ 20 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。每次循环第3步进行荧光采集。最后从60 ℃升温至95 ℃,每隔30 s上升0.5 ℃,总共71个循环。检测其荧光值,绘制熔点曲线。3次重复。
1.5 数据分析
试验数据利用Excel 2000和DPS 6.50软件进行分析,用DPS程序中的Duncans新复极差测验进行差异显著性分析。
2 结果与分析
2.1 草莓果实发育过程中ABA和IAA含量的变化
为了检测IAA和ABA含量在甜查理草莓果实发育中的变化,本试验将草莓果实划分为7个时期。从图1可以看出,果肉中ABA含量在整个草莓果实发育过程中出现2个上升阶段,即从幼果期至白熟期和始熟期至成熟期;二者之间变化不大的是白熟期至始熟期。揭示了ABA含量快速积累不仅伴随着果实的膨大和褪绿,而且伴随着果实的着色,说明ABA含量与草莓果实发育和成熟有密切的关系。与ABA含量变化趋势相反,IAA含量从小绿果到大绿果急剧上升,但是大绿果到纯白果含量急速下降,纯白果到始红果IAA含量变化不大,随后到红果又出现了下降,IAA含量变化趋势与果实成熟进程相反,说明IAA含量与草莓果实发育呈现负相关。
2.2 ABA和IAA处理对果实的影响
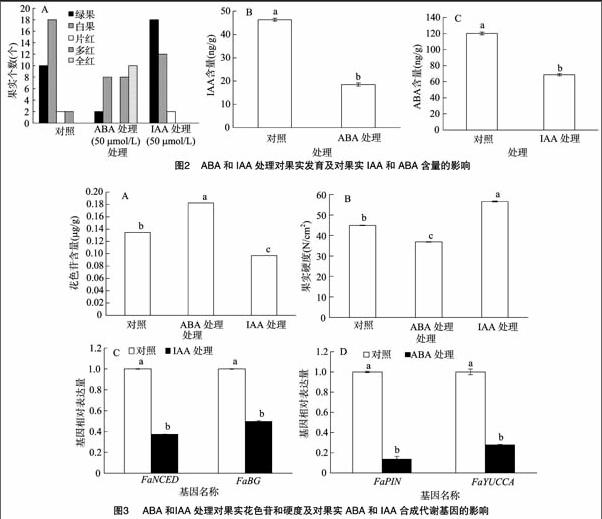
为了进一步证明ABA和IAA在草莓果实中的作用,利用50 μmol/L的ABA和IAA处理大绿果时期的草莓果实,结果(图2)表明,与水处理的果实相比(对照),ABA能促进草莓果实的着色软化,使花色苷含量上升和果实硬度下降,果实内IAA的含量也出现了下降;相反,IAA抑制了果实花色苷的积累和果实的软化,并且降低了ABA的含量,延迟了果实的成熟进程(图3)。
2.3 ABA和IAA的相互作用对成熟相关基因的影响
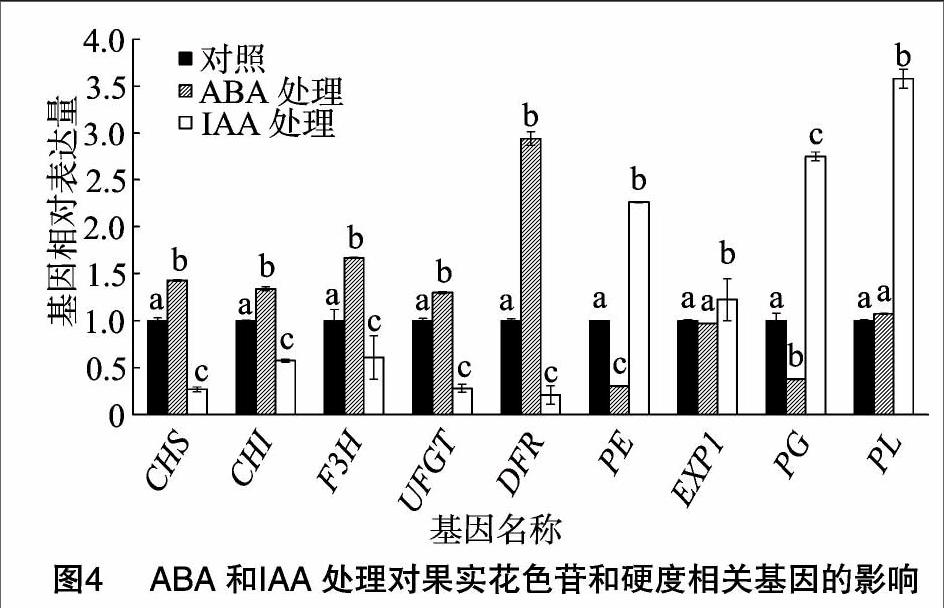
ABA能通过降低IAA合成路径中基因的表达量进而阻止IAA的积累,比如IAA转运基因FaPIN(auxin transporter gene)和合成基因FaYUCCA(flavin monooxygenase gene)。IAA也能使ABA合成路径中基因的表达量降低进而使ABA含量下降,比如FaNCED和FaBG(图3)。ABA和IAA还能诱导或阻止果实成熟相关基因的表达,比如与花色苷合成相关的基因,查尔酮合酶基因CHS(chalcone synthase)、查尔酮异构酶基因CHI(chalcone isomerase)、黄烷酮3-羟化酶基因F3H(flavanone 3-hydroxylase)、UDP葡萄糖-类黄酮-3-O-葡萄糖基转移酶基因UFGT(UDP-glycose flavonoid 3-O-glycosyltransgerase)、二氢黄酮醇还原酶基因DFR(dihydroflavonol-4-reductase)和与果實软化有关的基因,伸展蛋白基因EXP1(expansion)、聚半乳糖醛酸酶基因PG(polygalacturonase)、果胶裂解酶基因PL(pectate lyase)、葡聚糖酶基因EG(endo-1,4-b-glucanase)(图4)。
3 结论与讨论
根据果实成熟的特点,果树果实可分为2个基本类型,即呼吸跃变型果实和非呼吸跃变型果实[18-20]。呼吸跃变型果实成熟的“调控因素”就是植物激素乙烯,如番茄、香蕉、苹果。非呼吸跃变型果实的成熟主要受植物激素ABA的调控,在非呼吸跃变型果实的成熟过程中只有少量的乙烯产生,而且乙烯的峰值一般是在激素ABA的峰值之后,如葡萄、柑橘和草莓。迄今为止人们对乙烯对果实成熟机理的调控研究已取得了很大的进展,但是关于非呼吸跃变型果实的成熟机制仍未阐明。ABA作为一种植物激素,已证实不仅在调控植物休眠衰老和抗逆境胁迫等过程中起着重要的作用,而且是调控果实尤其是非呼吸跃变型果实发育的关键因素[7,21]。本研究发现在甜查理草莓果实中ABA含量是随着果实发育上升的,有2个明显的上升期,第1个是果实褪绿变白期,第2个是果实上色期。果实的生长发育是指从开花到果实衰老的全过程,在这一过程中除受到乙烯和ABA的调控外,还受到其他激素的调控,如IAA、赤霉素(GA)、细胞分裂素(CTK)等激素的影响。IAA是第一种被确认的植物激素,在某些非呼吸跃变型果实的成熟过程中起抑制作用[22-23]。在草莓中,由瘦果(种子)分泌的IAA会抑制肉质花托的成熟[8,24]。随着植株的发育,瘦果和花托的IAA水平会逐渐低于临界水平从而使果实成熟。因此去除瘦果可以促进成熟,而施用外源IAA则会使草莓延迟成熟。本研究也表明,随着果实的发育,IAA含量在小绿果时期很高,但是与ABA含量变化进程相反,在果实褪绿时期,IAA含量急剧下降,在红果时期,含量降到最低点。这说明IAA含量的变化与草莓果实发育呈负相关(图1)。并且本研究结果也表明,在大绿果时期用IAA处理草莓果实,会延迟果实上色,花色苷积累减缓,内源ABA含量降低。而ABA处理后的草莓果实,与对照相比,能提前着色,促进花色苷积累,同时也降低了IAA含量。这说明ABA和IAA互相影响,产生拮抗(图2)。草莓果实成熟是ABA含量升高导致的结果,还是IAA含量降低导致的结果,是因为正的调控因子ABA还是负的调控因子IAA起主要作用,还需要深入研究。
ABA和IAA的拮抗作用是因为二者能互相抑制对方的生物合成代谢途径。草莓果实喷施外源ABA能抑制果实内IAA合成路径中基因的表达,比如IAA合成酶的FaYUCCA基因和IAA转运酶的FaPIN基因。同样IAA也能抑制ABA合成路径中基因的表达,比如FaBG和FaNCED。ABA和IAA除了能互相影响外(图3),它们还能调控与果实成熟相关基因的表达,比如ABA和IAA能促进或抑制与花色苷合成相关基因、与果实软化相关基因的表达(图4)。这说明ABA和IAA能协同调控果实的发育,含量高的ABA能促进果实成熟进程,使果实衰老得更快,但是高的IAA含量能延迟果实衰老,使果实保持新鲜的状态。因此,ABA和IAA含量的调控为果实品质的形成和果实保鲜的研究提供了一个方向。
參考文献:
[1]Zhang J J,Wang X,Yu O,et al.Metabolic profiling of strawberry(Fragaria×ananassa Duch.) during fruit development and maturation[J]. J Exp Bot,2011,62(3):1103-1118.
[2]Perkins-Veazie P.Growth and ripening of strawberry fruit [J]. Hort Rev,2010,17:267-297.
[3]Chai Y M,Jia H F,Li C L,et al. FaPYR1 is involved in strawberry fruit ripening [J]. Journal of Experimental Botany,2011,62(14):5079-5089.
[4]Jenks M A,Bebeli P J. Fruit shelf life and potential for its genetic improvement[M]//Mercado J A,Pliego-Alfaro F,Quesada M A. Breeding for fruit quality. New York:John Wiley and Sons,2011:81-104.
[5]Posé S,García-Gago J A,Santiago-Doménech N,et al.Strawberry fruit softening:role of cell wall disassembly and its manipulation in transgenic plants [J]. Gen Genom Genom,2011,5(1):40-48.
[6]钟晓红,马定渭,黄远飞. 草莓果实发育过程中内源激素水平的变化[J]. 江西农业大学学报,2004,26 (1):107-121.
[7]Coombe B G.The development of fleshy fruits [J]. Ann Rev Plant Physiol,1976,27(1):507-528.
[8]Manning K.Changes in gene expression during strawberry fruit ripening and their regulation by auxin [J]. Planta,1994,194(1):62-68.
[9]Ofosu-Anim J,Kanayama Y,Yamaki S.Sugar uptake into strawberry fruit is stimulated by abscisic acid and indoleacetic acid [J]. Physiol Plant,1996,97(1):169-174.
[10]Kano Y,Asahira T.Roles of cytokinin and abscisic acid in the maturing of strawberry fruits [J]. J Japan Soc Hort Sci,1981,50(1):31-36.
[11]John O A,Yamaki S.Sugar content,compartmentation and efflux in strawberry tissue [J]. J Am Soc Hort Sci,1994,199(5):1024-1028.
[12]Jiang Y M,Joyce D C. ABA effects on ethylene production,PAL activity,anthocyanin and phenolic contents of strawberry fruit [J]. Plant Growth Regulation,2003,39(2):171-174.
[13]Zhang M,Yuan B,Leng P.The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit [J]. Journal of Experimental Botany,2009,60(6):1579-1588.
[14]陈昆松,李 方. ABA 和IAA对猕猴桃果实成熟进程的调控 [J]. 园艺学报,1999,26(2):81-86.
[15]田建文,贺普超. 植物激素与柿子后熟的关系[J]. 天津农业科学,1994(3):30-32.
[16]周丽萍,张维一. 外源激素和病原侵染对采后葡萄呼吸速率及组织内源激素的影响[J]. 植物生理学报,1997,23(4):353-356.
[17]Fait A,Hanhineva K,Beleggia R,et al.Reconfiguration of the achene and receptacle metabolic networks during strawberry fruit development[J]. Plant Physiology,2008,148(2):730-750.
[18]Brady C J.Fruit ripening [J]. Annu Rev Plant Physiol,1987,38:155-178.
[19]White P J.Recent advances in fruit development and ripening:an overview [J]. J Exp Bot,2002,53(377):1995-2000.
[20]Chaves A L S,Farias P C M.Ethylene and fruit ripening:From illumination gas to the control of gene expression,more than a century of discoveries [J]. Genet Mol Biol,2006,29(3):508-515.
[21]Yu X C,Li M J,Gao G F,et al. Abscisic acid stimulates a calcium-dependent protein kinase in grape berry [J]. Plant Physiology,2006,140(2):558-579.
[22]Davis C,Wolf T,Robinson S P.Three putative sucrose transporters are differentially expressed in grapevine tissues [J]. Plant Science,1999,147(2):93-100.
[23]Trainotti L,Tadiello A,Casadoro G.The involvement of auxin in the ripening of climacteric fruits comes of age:the hormone plays a role of its own and has an intense interplay with ethylene in ripening peaches [J]. Journal of Experimental Botany,2007,58(12):3299-3308.
[24]Given N K,Venis M A,Grierson D.Hormonal-regulation of ripening in the strawberry,a non-climacteric fruit [J]. Planta,1988,174(3):402-406.
