亲水色谱法分析白坚木皮醇的研究
2012-09-11姜士宽孟子晖
薛 敏,吕 雉,伍 英,姜士宽,陈 婧,孟子晖*
1北京理工大学化工与环境学院,北京 100081;2云南省热带作物研究所,景洪 666100
白坚木皮醇(L-Quebrachitol)具有很高的药用价值,可治疗糖尿病、癌症、抑制血管增生以及用于抗生素和酶药物的合成[1-4]。在护肤品、香皂中加入白坚木皮醇,可达到去皱和增加弹性的作用,近年来备受生物、医药专家的关注。另外,由于结构上的单一旋光性手性结构单元,可作为手性试剂,是合成肌醇衍生物的重要原料。白坚木皮醇最早在巴西白坚木的树皮中发现,后来证明在银桦、夹竹桃、紫堇等植物中都存在着白坚木皮醇,含量在0.4% ~0.7%左右。在我国云南地区,制胶厂每年都会排放大量的制胶废水,其中白坚木皮醇含量可高达1.2%[5-7],有报道从天然橡胶的制胶废液中提取白坚木皮醇[8-12],所得样品纯度不高,Martina Diaz[13]等人在从胶乳中提取后用1H-NMR对其作了定性,也有从其他植物中提取的,比如 Heikki Kallio[14]等人用5 μm的氨基柱从沙棘果提取液中分离得到白坚木皮醇。
强极性的天然产物水溶性活性成分的色谱分析是当前分析化学以及植物化学领域中的一个挑战,由于其在传统的反相色谱(RPLC)中保留能力较弱,因而难以有效分离。而在以硅胶为固定相的正相色谱(NPLC)中会出现峰形前伸或拖尾、保留时间随进样量改变、以及流动相中微量水的存在会明显影响保留值等问题,另外NPLC常用的非极性流动相也无法为水溶性样品提供足够的溶解度。近年来兴起的亲水色谱(Hydrophilic Interaction Chromatography,HILIC)采用水-水溶性有机溶剂作为流动相,极好地改善了样品在流动相中的溶解性,对强极性和亲水性物质有良好的保留,分离效果优于传统RPLC,因此得到越来越广泛的关注[15,16],并在极性天然产物活性成分的分析中得到了成功的应用[17-19]。
本研究建立了HILIC法测定白坚木皮醇的分析方法,并对比了亲水色谱柱和C18色谱柱在DAD检测器下的检测效果,确定最佳检测条件,对乳清提取物以及制胶废水等实际样品进行了分析测试,效果良好,对分离机理进行了讨论。
1 材料与方法
1.1 仪器与试剂
LC-20AT高效液相色谱(日本岛津公司);SPDM20A型二极管阵列检测器(DAD,日本岛津公司);KH5200型超声仪(昆山禾创超声仪器有限公司)。白坚木皮醇(百灵威科技有限公司);乙腈(MeCN,色谱纯,山东禹王实业有限公司);制胶废水和乳清提取物由云南热带作物所提供;实验用水为超纯水(艾科浦超纯水系统)。
1.2 样品溶液的配制
精确称取40 mg白坚木皮醇标准品,置于10 mL容量瓶中,加入超纯水至刻度,配置成4 mg/mL标准液备用。取10 mL含白坚木皮醇的制胶废水,经0.22 μm 滤膜过滤备用。
1.3 色谱分析
SHISEIDO PC HILIC色谱柱(250 mm ×4.6 mm,5 μm);Agela Venusil MP C18色谱柱(250 mm ×4.6 mm,5 μm);流动相为乙腈-水;流速:1 mL/min;柱温:25℃;DAD检测波长:190 nm。
C18色谱柱检测条件:取配好的4 mg/mL白坚木皮醇标准液,稀释成2 mg/mL用于HPLC检测。色谱柱为Agela Venusil MP C18,流动相为乙腈-水,检测器为二极管阵列检测器(DAD),检测波长为190 nm,进样量为 5 μL。
亲水色谱柱检测条件:取配置好的2 mg/mL白坚木皮醇标准液,色谱柱为SHISEIDO PC HILIC,流动相为乙腈-水,检测器为二极管阵列检测器(DAD),检测波长为190 nm,进样量为5 μL。

图1 白坚木皮醇HPLC-DAD色谱图Fig.1 HPLC-DAD chromatograms of L-quebrachitol with C18column
2 结果与讨论
2.1 C18柱检测白坚木皮醇
从图1可以看出,白坚木皮醇在C18柱中出峰时间约在2.3 min左右,由于C18反相色谱柱填料极性小,而白坚木皮醇极性较大,所以在柱中几乎没有保留。此外,随着流动相中乙腈的含量由20%增加至80%,白坚木皮醇出峰时间没有太大变化,保留因子基本不变,这说明C18色谱柱不适合用来分离鉴定白坚木皮醇这种强极性水溶性化合物。
2.2 HILIC分离模式下流动相配比与保留因子的关系
从图2可以看出,采用SHISEIDO PC HILIC色谱柱、DAD检测器,随着流动相中乙腈含量的减少,水含量的增加,即流动相整体极性的增大,白坚木皮醇同HILIC柱上的极性配体磷脂(PC)作用减弱,导致保留时间变短,出峰更快。

图2 白坚木皮醇HPLC-DAD色谱图Fig.2 HPLC-DAD chromatograms of L-quebrachitol with SHISEIDO PC HILIC column
实验比较了乙腈/水不同配比时待测物的分离效果(图3),根据保留因子(k)确定流动相。保留因子反映了物质在柱中的迁移速率,保留因子越大,保留时间越长,如果过长,则峰展较宽,灵敏度不高;若保留因子过小,则在柱内保留效果差,不利于分离。
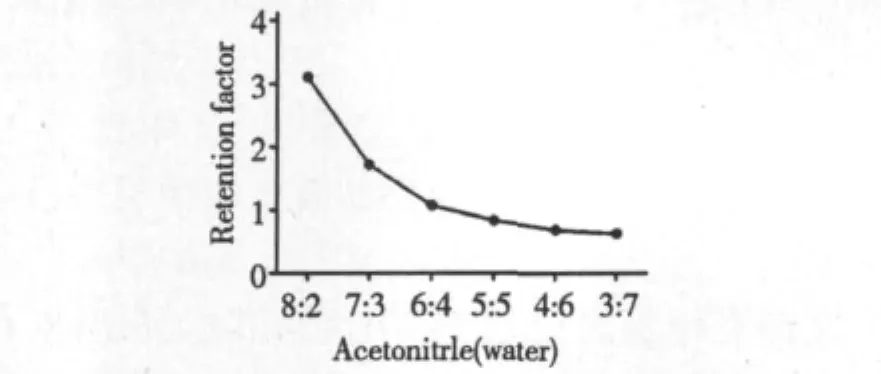
图3 保留因子同流动相中水含量的关系Fig.3 Effects of Acetonitrile/Water ratio on the retention factor of L-quebrachitol
理论上k=0.5~10均能满足分离需求,在0.5~1.5之间为最佳,从图3可以看出,k随着乙腈含量的减小而减小,在流动相比例为6∶4和5∶5时,保留因子都在1左右,均适合本实验,但相比之下,比例为6∶4时出峰时间为4.3 min,可以避免溶剂峰的干扰,峰形更对称,因此本实验选择流动相为乙腈/水(V/V,60/40)。
2.3 标准曲线及检测限
以配制好的4 mg/mL白坚木皮醇标准液为储备液,分别稀释成 2、0.8、0.1、0.08、0.05 mg/mL 的标准溶液,以HPLC分别测定包括储备液在内的6个浓度下白坚木皮醇的峰面积,流动相取乙腈-水(V/V)6∶4,以峰面积积分值(y)对白坚木皮醇浓度(x,mg/mL)做线性回归,得到线性方程,以3倍信噪比(S/N=3)为谱峰值,求出检测限(如表1)。

表1 白坚木皮醇标准曲线与检测限Table 1 Standard curve and detection limit of L-quebrachitol
2.4 用色谱条件检测白坚木皮醇浓缩品
取2 mg/mL乳清提取物溶液,在高效液相色谱检测,色谱柱为SHISEIDO PC HILIC;流动相为乙腈-水(V/V,60/40);检测器为二极管阵列检测器(DAD);检测波长为190 nm;色谱图如图4。

图4 白坚木皮醇浓缩品色谱图Fig.4 HPLC chromatogram of concentrated L-quebrachitol product
从图4可以看出,乳清提取物中虽含白坚木皮醇,但仍有较多杂质,利用本研究建立的亲水色谱法基本可以将白坚木皮醇和其他杂质分开,出峰时间在4.3 min左右。
2.5 制胶废水中白坚木皮醇的检测
将已经过处理的含白坚木皮醇的制胶废水用HPLC检测,色谱柱为SHISEIDO PC HILIC,流动相为乙腈-水(V/V,60/40),检测器选择 DAD,柱温为25℃,所得色谱图在4.3 min左右有一个很明显的吸收峰,白坚木皮醇和杂质没能达到很好的基线分离,但根据相同实验条件下保留时间推算,基本确定此峰为白坚木皮醇。
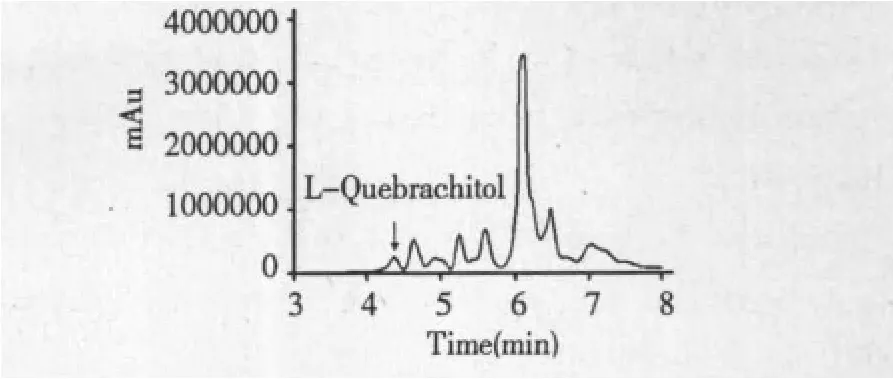
图5 制胶废水色谱图Fig.5 HPLC chromatogram of latex wastewater
2.6 分离机理
根据Alpert的研究[20],强极性样品白坚木皮醇在HILIC中的保留是基于分配理论,当使用水溶性有机相-水为流动相时,亲水性的固定相表面会产生一层富水层,而化合物就溶解入富水层中。Shiseido PC HILIC色谱柱采用的是硅胶表面键合磷酸胆碱(PC)的技术,PC是细胞膜的组成部分,具有三甲胺内脂结构。作为超亲水性基团,PC修饰于硅胶表面,从而使亲水性物质白坚木皮醇在色谱柱内有所保留。实验证明,该色谱柱对水溶性物质具有很好分离性能,同时具有较好的分离的稳定性和高效性。
3 结论
根据白坚木皮醇的水溶性,建立了亲水作用色谱柱测定其含量的HPLC方法。解决了常规C18色谱柱无保留、含量测定不稳定的问题。该方法准确、灵敏度高,可用于对基质复杂的制胶废水中白坚木皮醇的检测,更精确的检测条件将进一步研究。该方法对其他天然产物极性水溶性有效成分的色谱分析也有很好的借鉴作用。
1 Deng YY(邓瑶筠).L-Quebrachitol-a new resource in pharmacy.Guangzhou Chem Ind(广州化工),1996,24:39-40.
2 Ao NJ(敖宁建).High value by-product in latex.J Yunnan Agric Univ(云南农业大学学报),2005,20:467-473.
3 Deng YY(邓瑶筠).A new product in pharmacy-character and development of L-Quebrachitol.Chin Tradit Herb drugs(中草药),1997,28:500-501.
4 De Olinda TM.Quebrachitol-induced gastroprotection against acute gastric lesions:role of prostaglandins,nitric oxide and K-ATP(+)channels.Phytomed,2008,15:327-333.
5 Nobre HV,Cunha GMA,Moraes MO,et al.Quebrachitol(2-O-methyl-L-inositol)attenuates 6-hydroxydopamine-induced cytotoxicity in rat fetal mesencephalic cell cultures.Food Cheml Toxicol,2006,44:1544-1551.
6 Takahashi S,Hishinuma N,Koshino H,et al.Synthesis of ovalicin starting from D-mannose.J Org Chem,2005,70:10162-10165.
7 Tiefenbacher K,Arion VB,Muler J.A Diels-Alder approach to(-)-ovalicin.Angewandte Chem-International Edition,2007,46:2690-2693.
8 Trost BM,Patterson DE,Hembre EJ.Dynamic kinetic asymmetric transformations of conduritol B tetracarboxylates:an asymmetric synthesis of D-myo-inositol 1,4,5-trisphosphate.J Am Chem Soc,1999,121:10834-10835.
9 Kurosawa K,Nagase T,Chida N.Total synthesis of(-)-stevastelin B.Chem Commun,2002,12:1280-1281.
10 Udagawa Y,Tajima Y,Machida M.Detergents containing LQuebrachitol.1990,(Yokohama Rubber Co.Ltd.,Japan).Application:JP.p.3pp.
11 Rhodes E,Wiltshire JL.Quebrachitol:a possible by-product from latex.J Rubber Res Inst Malays,1932:160-171.
12 Gopalakrishnan J,Thomas M,James J.Process for obtaining pure L-quebrachitol from natural rubber latex.IN200700621-4;IN238511-B.
13 Diaz M,Gonzalez A,Castro-Gamboa I,et al.First record of L-quebrachitol in Allophylus edulis.Carbohydr Res,2008:2699-2700.
14 Kallio H,Lassila M,Jarvenpaa E,et al.Inositols and methylinositols in sea buckthorn(Hippophae rhamnoides)berries.J Chromatogr B Analyt Technol Biomed Life Sci,2009,877:1426-1432.
15 Vacek J,Onofrejova L,et al.Application of hydrophilic interaction liquid chromatography in separation of polar compounds.Chem Listy,2009,103:381-385.
16 Guo ZM(郭志谋),Zhang XL(张秀莉),Xu Q(徐青),et al.Stationary phases for hydrophilic interaction liquid chromatography and their applications in separation of traditional Chinese medicines.Chin J Chromatogr(色谱),2009,27:675-681.
17 Liang XM(梁心妙),Jin Y(金玉),Wang YP(王艳萍),et al.Qualitative and quantitative analysis in quality control of traditional Chinese medicines.J Chromatogr A,2009,1216:2033-2044.
18 Valls J,Millan S,Pilar Marti M,et al.Advanced separation methods of food anthocyanins isoflavones and flavanols.J Chromatogr A,2009,1216:7143-7172.
19 Li RP(李瑞萍),Huang JX(黄俊雄).Hydrophilic interaction chromatography and its applications in the separation of basic drugs.Prog Chem(化学进展),2006,18:1508-1513.
20 Andrew JA.Hydrophilic-interaction chromatography for the separation of peptides,nucleic acids and other polar compounds.J Chromatogr,1990,499:177-196.
