一株萘降解菌的筛选及其降解途径
2012-09-11刘兆普隆小华黄玉玲
王 博,刘兆普,隆小华,姚 瑶,黄玉玲
南京农业大学江苏省海洋生物学重点实验室,南京 210095
多环芳烃(PAHs)在环境中分布广泛,是一类化学结构复杂,具有诱变性和致癌性的污染物,它可通过生物链的传递进行富集,对环境和人类造成极大的危害。微生物在PAHs的降解过程中起着重要作用,因此,PAHs的生物降解途径成为国内外的研究热点[1]。筛选对PAHs有较强耐受性和降解性的菌株和菌系,对于污染的治理具有重要的意义。
萘(naphthalene)是PAHs的代表性化合物,为无色片状晶体,熔点80.5℃,沸点218℃,不溶于水,但易于溶于热的乙醇和乙醚,具挥发性。萘广泛存在于油田污染的土壤和水体中,对周围的生态环境和人类健康危害极大,已被美国环保署(EPA)确定为重点污染物,也是我国严格控制的一类污染物[2]。不同于物理和化学方法,萘的微生物治理方法优势明显,低成本,效果佳,无污染,具有显著的经济效益和生态效应[3]。
国内外做了大量的工作不断丰富萘降解菌种,筛选培育高萘降解率菌株,一些菌株的萘降解率可以达到 99.6% 以上[4]。宋昊等[5]研究了一株帕氏氢噬胞菌的萘降解特性,在萘质量浓度为39.8 mg/L时,培养96 h,其萘降解率可达98%,但其底物浓度耐受低,对温度变化敏感,28℃为生长最适温度。蔡宝立等[6]发现的一株假单胞菌,能耐受萘质量浓度为2 g/L,但菌株在pH 6.0下生长受到抑制,此外该菌还能利用一些芳香族化合物为唯一碳源。李文等[7]在滨海湿地红树林中筛选出了4株萘降解菌,萘浓度为100 mg/L的无机盐培养基中培养5 d,萘降解率最高为54.2%。目前为止,已发现的具有萘降解能力的菌种遍布假单胞菌(Pseudomonas)、红球菌(Rhodococcus)、微球菌(Micrococcus)、产碱菌(Alcaligenes)、棒状杆菌(Corynebacteria)以及真菌和藻类等。萘的生物降解途径主要分两种,一种为邻苯二酚途径,萘在编码酶的作用下生成水杨酸,而后转化为邻苯二酚,经间位或者邻位裂解开环,降解为一系列可进入三羧酸循环的小分子物质,其代表菌株为Pseudomonas[8]。另一条途径为龙胆酸途径,萘氧化为水杨酸后,在水杨酸5-羟化酶的作用下,生成龙胆酸,经过一系列的氧化进行降解[9]。本研究从滨海盐碱地受石油污染的土壤中分离到一株萘降解菌W1,经过生理生化以及分子鉴定为沙雷氏菌属,研究了该菌萘降解特性和底物利用的特性,分析了该菌萘降解过程的中间产物,探讨了其可能的萘降解途径,为滨海盐碱土壤中萘以及多环芳烃的污染治理提供理论和实验基础。
1 材料与方法
1.1 实验材料与仪器
石油污染土样采集于胜利油田;萘,环己烷(Cyclohexane,纯度大于99.5%)购于国药集团化学试剂有限公司;透射电镜型号为日立H-7650(工作电压80 kV)。
1.2 主要培养基
无机盐培养基:NH4NO310 g,KH2PO41.5 g,K2HPO43.0 g,加入微量元素液 2 mL,水 1 L,pH 7.5,固体加2%琼脂。
微量元素液:MgSO44 g,CuSO41 g,MnSO41 g,FeSO41 g,CaCl21 g,水 1 L。
萘溶液:5 g萘溶于1 L正己烷,配成5 mg/mL的浓缩液,常温避光保存。
固体含萘培养基:无机盐培养基,加入0.2%微量元素液,1%萘溶液。
菌株驯化培养基:1 L 50 mg/L含萘培养基加入0.05 g酵母膏。
1.3 萘降解菌的筛选与分离
称取10 g的石油污染土样加入到90 mL无菌水中,200 rpm,28℃振荡培养1 h后,静置30 min,吸取10 mL上清液于菌株驯化培养基,在200 rpm,28℃条件下摇床培养5 d。待培养液混浊后,吸取5 mL培养液重新转接入新鲜的与上述相同的菌株驯化培养基中,培养条件保持不变,连续转接驯化培养5次。将第5次摇床培养得到的菌液系列稀释后,取0.1 mL涂布于固体含萘培养基,28℃培养2 d,连续转接培养3次,挑出单菌落,得到能够以萘为唯一碳源的菌株。
1.4 萘降解率的测定[10]
在100 mL含萘水样中接种N7菌液,另设不接菌100 mL含萘水样作为空白对照,经摇床振荡培养3 d后,加入20 mL正己烷萃取,转至分液漏斗,振荡1 min,静置,待分层后分离,收集上层液,再用10 mL正己烷萃取2次下层液体,合并上层液用干燥的无水Na2SO4脱水,45℃旋转蒸发,N2吹干后,用甲醇定容至1 mL,待测。以同步不加菌液摇床振荡的含萘水样为空白对照。Agilent 1100 Series HPLC分析条件:分离柱为 ZORBAX SB-Aq(5 μm,250 mm×416 mm);柱温27 ℃,流速 0.18 mL/min,流动相为乙腈/水=50/50;检测波长218 nm。
降解率的计算公式为:
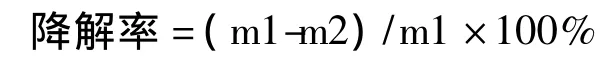
式中,m1为对照组的萘残余质量(mg),m2为样品的萘残余质量(mg)。
1.5 菌种的鉴定
1.5.1 生理生化鉴定
对筛选出的细菌进行形态学观察和生理生化实验鉴定[11],初步鉴定到属。
1.5.2 降解菌株的16S rDNA的鉴定
细菌总DNA的提取方法及PCR操作参考文献[12]。
以总DNA为模板,用16S rDNA的专一性引物F:5’-AGAGTTTGATCCTGGCTCAG-3’和 R:5’-GGT TACCTTGTTACGACTT-3’,目的片段大小为1500 bp左右。用TaqDNA聚合酶进行PCR扩增。PCR产物经克隆至pMD19-T载体,转化大肠杆菌DH5α菌株,DNA测序。
将测得的16S rDNA序列在GenBank中BLAST查找相似的核苷酸序列,用DNAMAN(version 4.0,Lynnon Biosoft)软件进行比对,来推测鉴定菌株。
1.5.3 生长曲线测定
用浊度法测定W1菌株的生长曲线[13]。将W1菌株分别接种于LB培养基和以萘为唯一碳源的无机盐培养基中,分别每隔2 h和6 h,取接菌和不接菌培养基测定其OD600值,绘制生长曲线。
1.6 菌株降解特性分析
将菌种接种于100 mL萘质量浓度为100 mg/L的无机盐培养基中,每次确定一个因素为变量(底物浓度、pH值、盐度、温度),其他因素不变,并设空白对照组,摇床培养3 d测定其萘残留量,计算萘降解率。其中,温度可设为 20、25、30、35、40 ℃;初始pH 值可设为为 5.5、6、6.5、7、7.5、8、8.5;盐度(NaCl)为 0、2、5、10、15、20、30、40 g/L;萘浓度分别为50、100、200、500 和800 mg/L。
1.7 菌株对不同底物的降解效应
以苯酚、甲苯、苯甲酸、1-萘酚、丙酮、辛烷为试验底物,经0.45 μL过滤除菌后以0.01%的量分别加入到100 mL无机盐培养基中。接菌液0.5 mL,并设空白对照,30℃下摇床培养3 d,测定其OD600值。
1.8 菌株对原油各组分的降解效应[14]
在100 mL无机盐培养基中加入0.45 μL滤器过滤除菌的原油0.5%,制成原油培养基。接菌液0.5 mL,并以不接菌的原油培养基作为对照,30℃摇床培养3 d,加入10 mL石油醚(沸程30~60℃)萃取,并将培养液5000 r/min离心10 min,转至分液漏斗,振荡数次,静置分层后,收集上层液,用石油醚洗涤3次后,用无水NaSO4脱水,65℃蒸干,置于干燥器中冷却。将回收得到的残油溶解在石油醚(沸程30~60℃)中,通过GC-MS分析烷烃变化。GCMS(色谱柱 HP-5 M5,30 m ×0.25 mm ×0.25 μm)运行条件:采用分流进样,进样口温度为290℃,检测器温度为300℃,柱温80℃,恒温5 min,以3℃/min升温至290℃,保留10 min;载气为He,流速1 mL/min。
1.9 菌株降解途径的分析
将菌株接种于含萘无机盐培养基中,培养4 d,分别在 0、12、16、20、24、28、32、36、42、48、60、72 和96 h时取样,于4℃、12500 r/min离心20 min,取上清液用Spectrumlab 54紫外可见分光光度计(UVVis)对萘降解中间产物进行分析检测。波长扫描范围为200~500 nm,扫描光谱带宽为2 nm,绘制扫描图谱[15]。
2 结果与讨论
2.1 高效萘降解菌的筛选和鉴定
经过反复的富集筛选,以及初步的萘降解率测定,从石油污染土样中分离到一株高效萘降解菌,命名为W1,其菌落为白色透明,中间略突起,边缘不规则,表面光滑湿润。菌株的透射电镜结果显示,菌体呈椭圆形,具鞭毛(图1)。菌株为革兰氏阳性菌,其部分生理生化特性见表 1。其16S rDNA的BLAST结果显示,该菌与沙雷氏菌属的同源性均在97%以上,综上结果,鉴定该菌为沙雷氏菌属(Serratia sp.)。

图1 菌株W1单菌落形态和电镜照片Fig.1 Shape of individual bacterial colony and transmission electron micrograph of strain W1
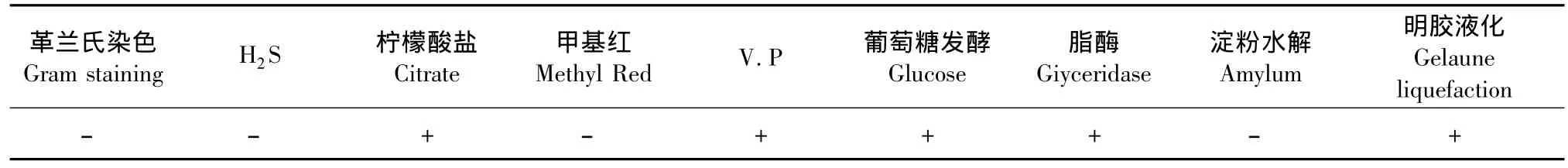
表1 W1菌株的部分生理生化特性Table 1 Physiological and biochemical characteristics of strain W1
2.2 菌株的生长曲线
每隔2 h测定菌株在LB培养基中的生长情况,其生长曲线如图2所示,菌株在0~6 h为迟滞期,6~18 h为对数期,12 h后进入稳定生长期,后续试验,接种时间均取自对数期。每隔6 h测定菌株在萘无机盐培养基中的生长情况,由于萘对菌株的毒害作用,菌株迟滞期持续18 h,而后逐渐适应,46 h时达到最大生长量,在66 h进入明显的衰亡期,其稳定期约持续20 h。
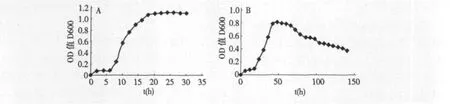
图2 菌株W1在LB培养基(A)和萘培养基(B)中的生长曲线Fig.2 Growth curve of strain W1 on LB medium and naphthalene medium
2.3 菌株降解特性的分析
2.3.1 温度对菌株的影响
菌株受温度的影响结果如图3所示,其在30~35℃时表现出较高的萘降解率,分别达到87.5%和92.8%,而在其他温度下,其降解率也都在40%以上,也具有一定的降解效应,说明菌株的耐受温度范围较宽。
2.3.2 pH值对菌株萘降解率的影响
如图4所示,菌株的最适生长pH值为7~7.5,此时其降解率最高,达93.5%;在pH值为8时,萘的降解率为70.2%,相对pH 7~7.5时低,但仍高于其在酸性环境下的降解率,pH 8.5时,降解率下降到10.3%,降解效应极低。可以看出菌株的pH值耐受范围为7~8,耐碱性高于耐酸性。

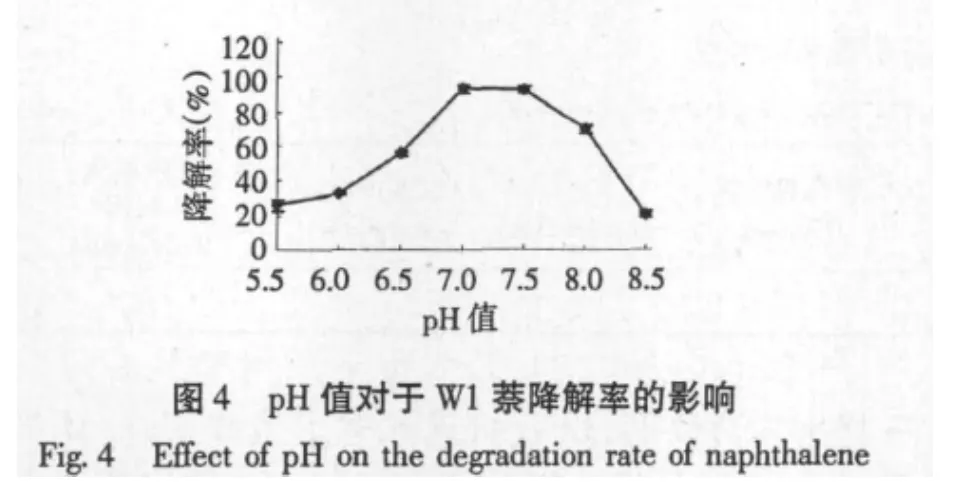
2.3.3 盐度对菌株萘降解率的影响
由图5可以看出,一定的盐度可以促进菌株的降解效应,过高的盐度会抑制菌株的生长,当NaCl含量为40 g/L时,菌株的生长受到严重抑制,其萘降解大幅度下降,仅为30.8%。
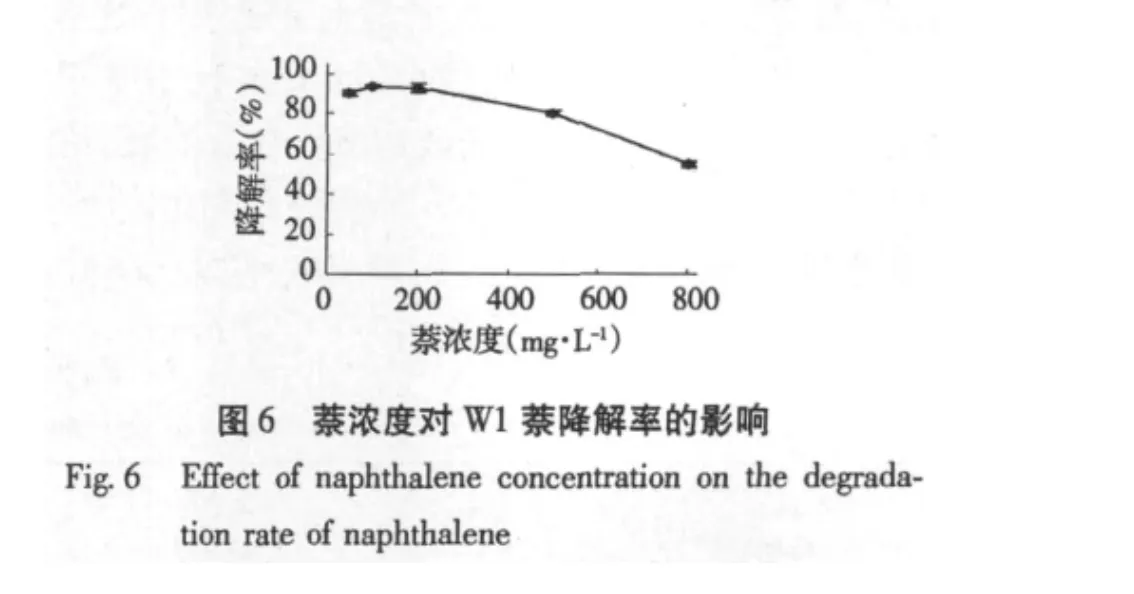
2.3.4 底物浓度对菌株萘降解率的影响
如图6所示,在萘浓度为100 mg/L的培养基中,菌株的降解率最高达到94%,而后随着浓度的增加,萘对于菌株的毒害作用加大,降解率逐渐降低,但在萘浓度为800 mg/L时,菌株仍表现出一定的降解效应,其降解率为15.8%。

2.4 菌株对不同底物的降解效应
由表2可见,菌株在一定浓度的苯酚、甲苯、苯甲酸、1-萘酚、丙酮和辛烷底物环境中均能达到一定的生长量,虽生长量有限,但表明该菌株具有较广的底物利用范围,可以适应复杂的底物环境。

表2 W1菌株降解不同底物的吸光度值Table 2 Biomass production of strain W1 degradating different substrates
2.5 菌株对原油组分的降解效应
不接菌空白与接菌培养后的原油培养基残留组分GC-MS分析,以质谱谱库NIST MS检索结果定性,其结果如图7所示。原油降解后组分发生变化,C20~C23、C33~C36组分含量明显降低,说明该菌株对该范围内的链烃具有较高的降解利用效率。
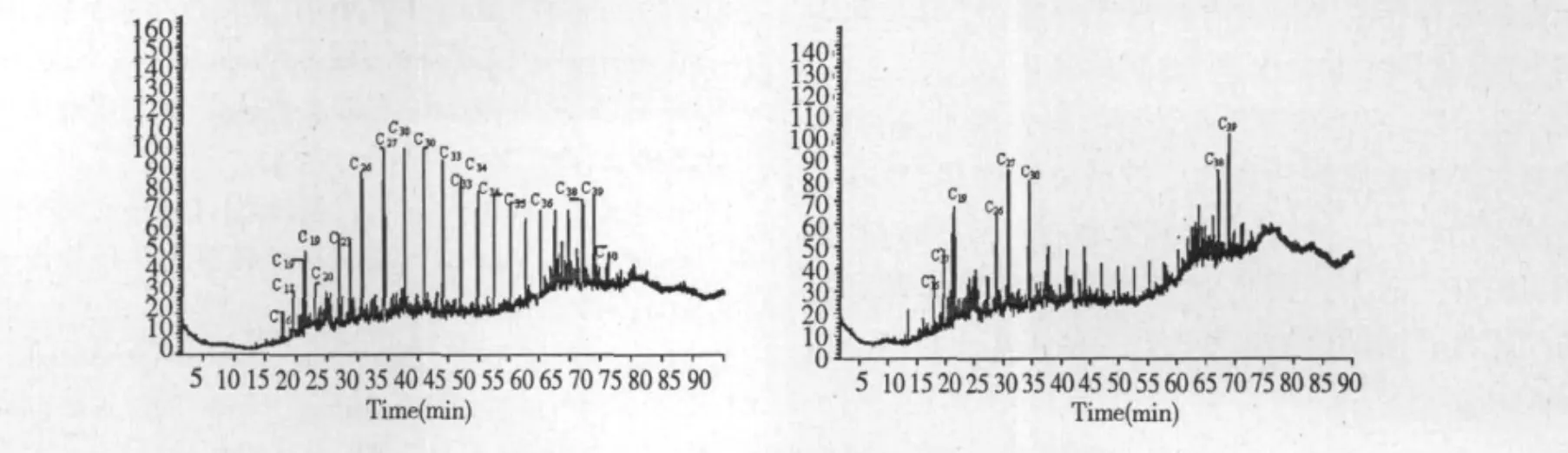
图7 不接菌空白及接菌培养基原油的GC-MS图谱Fig.7 GC-MS of crude oil before and after degradation by stain W1
2.6 菌株降解中间产物的分析
菌株萘降解中间产物的UV-Vis的扫描结果如图8所示,降解0 h时,250~300 nm出现吸收峰,降解12 h以后该吸收峰消失,此处为萘的吸收标志峰。随着降解的进行,在20~28 h时,200~266 nm出现较多吸收峰,为生成的中间产物,312和378 nm处出现2个标志峰,并逐渐增大。36~96 h,312和378 nm处的吸收峰逐渐减小,培养72 h时,218 nm处出现一个吸收峰,96 h时该峰消失。综上分析,312、378和218 nm处吸收峰所代表的物质分别为邻苯二酚、水杨酸和2-羟基粘康酸半醛[16]。
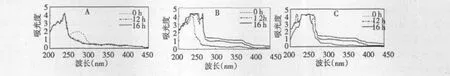
图8 萘降解中间产物的UV-Vis扫描图谱Fig.8 UV-Vis of metabolic intermediates at different degradation stages
3 结论
从石油污染的土壤中分离得到能够以萘为唯一碳源生长的石油降解菌W1,经鉴定为沙雷氏菌属,W1的最适培养条件为35℃,pH为7.5,其生长温度范围较宽,并表现出一定的耐酸耐碱性。特别是W1能耐受30 g/L的盐度,与其他已报道萘降解菌相比,有着明显较高的耐盐能力。在萘底物浓度为100 mg/L时,其降解率可达到94%,虽然随底物浓度的增加其降解作用逐渐减弱,但在萘浓度800 mg/L时仍表现出15.8%的降解率。在底物利用方面,该菌在以一定浓度的苯酚、甲苯、苯甲酸、1-萘酚、丙酮、辛烷为底物时均能表现出一定的、有限的生长量,具有一定的底物利用广度。再者,菌株的石油组分利用较广,GC-MS分析可以看出,W1对原油中的组分C20~C23、C33~C36的直链烃均有较好的降解作用。经初步分析,该菌的萘降解过程为一条典型的萘生物降解途径,萘经双加氧酶催化降解作用,依次生成 1,2-羟基萘,邻-羟基-顺-苯丙酮酸,水杨酸,邻苯二酚,2-羟基粘康酸半醛,最终进入三羧酸循环(TCA)生成二氧化碳和水[17,18],最终的降解过程尚需进一步实验验证。
综上所述,与其他已报道的萘降解菌相比,菌株W1有着一定的优势。首先,其生长温度范围较宽,并表现出较广的耐酸耐碱性,因其为滨海盐碱地土壤中筛得,有着明显较高的耐盐能力,这对于滨海盐碱地的石油污染的治理有着特殊的意义。在底物利用方面,该菌亦存在优点,其对原油中的组分C20~C23、C33~C36的直链烃均有较好的降解作用,同时该菌对多种有机底物均具有广泛的降解作用,具有一定的底物利用广谱性,在治理复杂有机污染时,有着相当的应用潜力。因此,对于该菌的研究为针对性的盐碱地石油污染的生物治理提供了实验和理论基础。
1 Kulik N,Goi A,Trapido M,et al.Degradation of polycyclic aromatic hydrocarbons by combined chemical pre-oxidation and bioremediation in creosote contaminated soil.J Environ.Manage,2006,78(4):382-391.
2 Wen HY(温洪宇),Liao YZ(廖银章),Li XD(李旭东).Degradation of Petroleum hydrocarbons by a Pseudomonas sp.HZ-1.Nat Prod Res Dev(天然产物研究与开发),2005,17:628-631.
3 Ding KQ(丁克强),Luo YM(骆永明).Bioremediation of PAHs polluted soil.Soils(土壤),2001,4:169-178.
4 Zhao X(赵璇),Tao XQ(陶雪琴),Lu GN(卢桂宁),et al.Isolation and characterization of naphthalene-degrading strains.Guangdong Chemical Industry(广东化工),2006,33(156):37-39.
5 Song H(宋昊),Qiu S(邱森),Zhang J(章俭),et al.Study on Hydrogenophaga Palleron ii LH J38 a naphthalene degrading strain with high activity.Environ Prot Chem Ind(化工环保),2006,26(2):87-90.
6 Cai BL(蔡宝立),Li YJ(李永军),Liang J(梁靖),et al.I-solation of naphthalene-degrading Pseudomonas sp.ND24 and bioremediation of naphthalene-contaminated soils.J Food Sci Biotechnol(食品与生物技术学报),2005,24(6):6-9.
7 Li W(李文),Liao BW(廖宝文).Isolation and identification of naphthalene-degrading strains from mangrove wetland soil.J Anhui Agricul Sci(安徽农业科学),2011,39:7663-7664.
8 Wang Y(王艳),Xin JY(辛嘉英),Song H(宋昊),et al.Advances in biodegradation of naphthalene.Chin Biotechnol(中国生物工程杂志),2009,29(9):119-124.
9 Bosch R,Garcia Valdes E,Moore ER.Genetic characterization and evolutionary implications of a chromosomally encoded naphthalene-degradation upper pathway from Pseudomonas stutzeri AN10.Gene,1999,236:149-157.
10 Chen J(陈静),Hu JD(胡俊栋),Wang XJ(王学军),et al.Desorption of polycyclic aromatic hydrocarbons from soil in presence of surfactants.Chin J Environ Sci(环境科学),2006,27:361-365.
11 Dong XZ(东秀珠),Cai MY(蔡妙英).Common Bacterial I-dentification Manual(常见细菌系统鉴定手册).Beijing:Science Publishing House.2001.
12 Huang XL(黄秀梨).Experiment and Guide for Microbiology(微生物学试验指导).Beijing:Higher Education Publishing House.2003.
13 Li QZ(李庆忠),Zhang ZZ(张忠智),Wang HJ(王洪君),et al.Screening,identification and characteristic of a strain of facultative anaerobe metabolizing diesel.Microbiology(微生物学通报),2002,29(3):28-32.
14 Xie DP(谢丹平),Yin H(尹华),Peng H(彭辉),et al.Degradation of crude oil by mixed culture.Chin J Appl Environ Biol(应用与环境生物学报),2004,10:210-214.
15 Tao XQ,Lu GN,Dang Z,et al.A phenanthrene-degrading strain Sphingomonas sp.GY2B isolated from contaminated soils.Process Biochem,2007,42:401-408.
16 Liu H(刘和),Wu JY(吴坚阳),Chen YX(陈英旭).Biodegradation mechanism ofaromaticcompoundsbycomamonas testosteroni ZD4-1 and Pseudomonas aeruginosa ZD4-3.Acta Microbiol Sin(微生物学报),2004,44:107-110.
17 Pinyakong O,Habe H,Supaka N,et al..Identification of novel metabolites in the degradation of phenanthrene by Sphingomonas sp.strain P2.FEMS Microbiol.Lett,2000,191:115-121.
18 Xia Y(夏颖).Studies on microbial ecology toxicity of phenanthrene and isolation,characterization of phenanthrene degrader as well as cloning and expression of degrading genes.Hangzhou:Zhejing University(浙江大学),PhD.2004.
