柔嫩艾美耳球虫Serpin基因真核表达载体的构建及其瞬时表达
2012-09-11李文超顾有方宫鹏涛李建华张西臣
李文超,吕 强,顾有方,宫鹏涛,李建华,张西臣*
(1.安徽科技学院动物科学学院,安徽凤阳233100;2.吉林大学畜牧兽医学院,吉林长春130062)
丝氨酸蛋白酶抑制剂蛋白(Serine protease inhibitor,Serpin)广泛存在于寄生虫中,其在调节外源和内源性蛋白酶过程中均发挥着重要的作用。在球虫中,Serpin通过抑制宿主丝氨酸蛋白酶活性,使虫体在侵入过程中免受宿主蛋白酶的降解,从而逃避宿主的防御体系,有利于虫体在宿主细胞体内存活,Serpin也可以通过控制内源性蛋白酶的活性,参与自身发育过程,尤其是在球虫侵入细胞过程中有着重要的作用[1-2]。研究表明,柔嫩艾美耳球虫(Eimeria tenella)Serpin重组蛋白对球虫感染具有部分免疫保护力[3],因此E.tenella Serpin基因可以作为球虫病疫苗研制的候选分子,用于球虫病的防治研究。本研究以E.tenella Serpin基因为研究对象,构建含有Serpin基因的重组真核表达质粒,并在Hela细胞中进行表达,为深入研究Serpin基因的生物学功能及E.tenella核酸疫苗的研制奠定基础。
1 材料和方法
1.1 虫株、菌株、质粒和细胞株 E.tenella长春株、pVAX1真核表达载体和Hela细胞由本实验室保存;E.coli TOP10购自长春宝泰克生物科技公司;pMD-Serpin载体由本实验室构建保存。
1.2 主要试剂 Bam HⅠ、XhoⅠ、T4DNA连接酶、DL2000购自TaKaRa公司;凝胶回收和质粒提取试剂盒购自Biolux公司;FuGENE HD转染试剂购自Roche公司;抗E.tenella鸡阳性血清由本实验室制备,ELISA检测抗体效价在 1∶12800以上;HRP标记的鼠抗鸡IgG(HRP-IgG)和FITC标记的鼠抗鸡IgG(FITC-IgG)购自武汉博士德生物工程有限公司。
1.3 E.tenella Serpin基因的扩增 根据本实验室构建的含有E.tenella Serpin全长基因的pMD-Serpin序列设计引物,去除Serpin基因信号肽序列后,引物序列引入Bam HⅠ和XhoⅠ酶切位点(下划线),P1:5'-GCGGATCCATGGAGCGTTCAACAATCACC-3', P2: 5'-GCCTCGAGCTTGCCTCCTGTTTGCTTG TAG-3'。引物由上海生工生物工程技术服务有限公司合成。
参照Ex Taq DNA聚合酶反应体系对Serpin基因进行扩增,反应条件:95℃5min;95℃1m in,61℃ 45s、72℃ 45s,35个循环;72℃ 7m in。PCR产物经回收连接pMD18-T载体(命名为pMDSerpin),转化E.coli TOP10感受态细胞,经PCR和双酶切鉴定后的阳性菌株由上海生工生物工程技术服务有限公司测序。
1.4 真核表达重组质粒的构建 将pMD18-T-Serpin和pVAX1质粒用Bam HⅠ和XhoⅠ双酶切,回收后连接,转化E.coli TOP10感受态细胞,PCR和酶切鉴定。鉴定正确的重组质粒命名为pVAX1-Serpin。
1.5 pVAX1-Serpin体外瞬时表达及间接免疫荧光(IFA)鉴定 按照转染试剂盒操作说明书的方法将pVAX1-Serpin转染于生长密度达到80%左右的Hela单层细胞。37℃5%CO2培养42h,固定细胞,以E.tenella阳性血清为一抗,以鼠抗鸡FITCIgG为二抗,进行IFA检测。同时设pVAX1质粒转染Hela细胞及正常Hela细胞作为对照组。
1.6 表达产物western blot分析 胰酶消化转染48h的Hela细胞,同时取pVAX1转染细胞与正常细胞作对照,将细胞裂解物进行SDS-PAGE电泳转膜后,以E.tenella阳性血清为一抗,以鼠抗鸡HRP-IgG为二抗进行western blot鉴定。
2 结果与讨论
2.1 E.tene lla Serpin基因扩增及真核表达重组质粒鉴定 PCR扩增产物经琼脂糖凝胶电泳后,在1200bp左右出现明显的片段(图1)。pMD-Serpin经测序表明,与GeneBank中登录的E.tenella Serpin基因同源性达100%。pVAX1-Serpin经PCR鉴定正确,经Bam HⅠ和XhoⅠ双酶切,产生3000bp和1024bp两条片段,与预期相符。
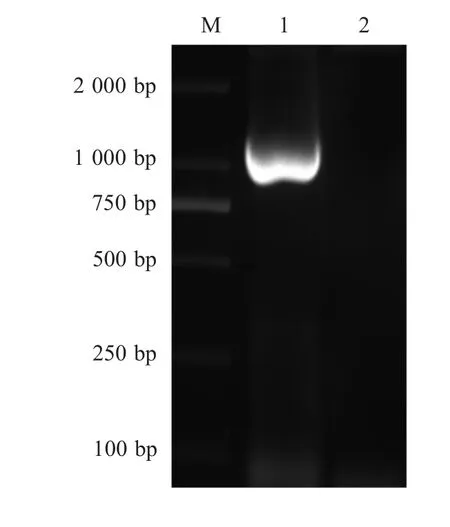
图1 E.tenella Serpin基因PCR扩增Fig.1PCR amplification of E.tenella Serpin gene
2.2 IFA检测E.tenella Serpin在Hela细胞中的表达 IFA结果显示,转染pVAX1-Serpin的细胞中可见明显的绿色荧光(图2),而转染pVAX1质粒或未转染的的细胞中未见荧光,结果表明pVAX1-Serpin基因在Hela细胞中得到了表达。
2.3 Western blot结果 Western blot显示,转染了pVAX1-Serpin的细胞可见一条约47ku的特异性表达条带。而转染了pVAX1的细胞和未转染质粒的正常细胞中未见到明显的条带,显示由pVAX1真核表达载体介导的Serpin蛋白在Hela细胞中得到了有效的表达,其能够被鼠抗鸡E.tenella免疫血清识别,表明表达产物具有良好的反应原性(图3)。
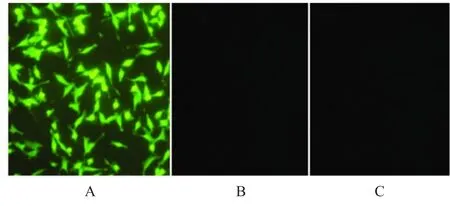
图2 IFA检测E.tenella Serpin蛋白在Hela细胞中的表达Fig.2Identification of the E.tenella Serpin expressed in Hela cells by IFA

图3 表达产物western blot分析Fig.3Western blot analysis of expression products
Serpins能够与生物体内参与调控作用的丝氨酸蛋白酶相互作用,形成一个动态平衡,从而起到调控作用,调节生物体内许多重要的生命活动,是维持体内环境稳定的重要因素,其在宿主体内的定居、虫体的发育过程中均发挥着重要的作用,因而其被认为是新药开发的作用靶标和新型疫苗的候选抗原。
球虫中Serpins的研究较晚,目前已在弓形虫[4]、犬新孢子虫[5]、E.tenella[1]、堆型艾美耳球虫[6]、巨型艾美耳球虫[7]中陆续发现有Serpins基因的存在,但均主要集中在Serpins基因的一些基本特性研究方面。而有关Serpins基因作为球虫保护性抗原的研究的内容更少,并且主要在原核表达方面。姜连连等的研究表明原核表达的Serpin重组蛋白对鸡只在增重、盲肠病变记分方面影响不大,但可以明显降低免疫组的卵囊产量,而且一免后7d鸡体内即可以产生明显的特异性免疫抗体,并且这种抗体水平可以持续到攻虫后7d,表明该重组蛋白具有良好的免疫原性,可以产生对球虫感染的部分免疫保护力[3]。
本研究首先应用PCR技术扩增获得E.tenella Serpin去除信号肽后的序列,与GenBank中相应基因序列的一致性达100%,随后构建了pVAX1-Serpin重组质粒,转染Hela细胞并得到表达。Western blot分析表明该蛋白分子量为47ku,大于表达蛋白理论预测值(44ku),可能是真核表达产物发生了糖基化所致[8],其能够被鼠抗鸡E.tenella免疫血清识别,表明该重组蛋白具有良好的免疫原性,本研究为下一步研究E.tenella Serpin核酸疫苗的免疫活性和动物保护性试验等奠定了基础。
[1]Fetterer R H,M iska K B,Jenkins M C,et al.Identification and characterization of a serpin from Eimeria acervulina[J].JParasitol,2008,94(6):1269-1274.
[2]Morris M T,Carruthers V.Identification and partial characterization of a second Kazal in Toxoplasma gondii[J].Mol Biochem Parasitol,2003,128(1):119-122.
[3]姜连连.柔嫩艾美耳球虫DF-1细胞培养体系的建立及Et-Serpin,EtAMA 1基因功能的初步研究[D].上海:中国农业科学院上海兽医研究所,2011.
[4]Pszenny V,Angel S O,Duschak V G,et al.Molecular cloning,sequencing and expression of a serine proteinase inhibitor gene from Toxoplasma gondii[J].Mol Biochem Parasitol,2000,107(2):241-249.
[5]Bruno S,Duschak V G,Ledesma B,et al.Identification and characterization of serine proteinase inhibitors from Neospora caninum[J].Mol Biochem Parasitol,2004,136(1):101-107.
[6]Fetterer R H,M iska K B,Jenkins M C,et al.Identification and characterization of a serpin from Eimeria acervulina[J].JParasitol,2008,94(6):1269-1274.
[7]董辉.巨型艾美耳球虫早熟株生物学特性及其相关基因研究[D].上海:中国农业科学院上海兽医研究所,2009.
[8]赵群力,闵娟,周怀瑜,等.新型基因佐剂SPreS2真核表达载体的构建及其瞬时表达[J].山东大学学报(医学版),2010,48(9):29-33.
