两株鸭源H5N1亚型禽流感病毒的序列分析及致病性研究
2012-09-11王明芳邓国华杨孝朴施建忠丁晴微罗维玉张文亮陈化兰
王明芳,邓国华,杨孝朴,施建忠,丁晴微,罗维玉,张文亮,陈化兰*
(1.甘肃农业大学,甘肃兰州 730070;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点实验室,黑龙江哈尔滨150001)
流感病毒属于正粘病毒科流感病毒属,其基因组由8个节段的单股负链RNA组成,共编码11种病毒蛋白。依据流感病毒核蛋白(NP)和基质蛋白(M 1)抗原性及基因特性的不同划分为A、B、C型。目前已鉴定出16种HA[1]和9种NA亚型。
1996 年在广东省鹅体内分离到第一株H5N1亚型禽流感病毒(Avian influenza virus,AIV)[2],1999年开始在健康的水禽中分离出多株AIV,随着时间的推移,这些病毒对哺乳动物的感染能力和致病力显著增强[3]。2004年以来国内多个地方爆发高致病性禽流感(HPAI);2005年我国青海湖发生斑头雁等野鸟大规模爆发H5亚型AIV感染和死亡事件[4],此后又多次报道H5亚型AIV导致野鸟大面积死亡的疫情,表明H5亚型AIV生物学特性发生了变化。H5N1亚型HPAI对家禽养殖业造成了严重的危害,同时也对人类的生命健康构成了很大的威胁。本研究对2010年湖北省的两株鸭源H5N1亚型AIV进行了全基因组序列分析及相关生物学特性的研究,初步评价H5亚型AIV对家禽及哺乳动物的致病性,以便为我国禽流感的综合防控提供相关的数据支撑。
1 材料和方法
1.1 病毒株和实验动物 2株H5N1亚型AIV分离株均来自2010年湖北省活禽市场的正常家禽监测样品,由国家禽流感参考实验室分离保存,病毒命名为:A/duck/Hubei/S1495/2010(H5N1)(HuB/495/10);A/duck/Hubei/S1513/2010(H5N1)(HuB/513/10)。11日龄SPF鸡胚及4周龄SPF鸭均购自哈尔滨兽医研究所实验动物中心;6周龄雌性BALB/c小鼠购自北京维通利华实验动物有限公司。
1.2 主要试剂 RNA提取试剂TRIzol LS购自Invitrogen公司;DNA聚合酶和DL2000Marker均购自宝生物工程(大连)有限公司;胶回收试剂盒购自上海华舜生物工程公司;反转录酶(MLV)试剂盒购自无限峰科技有限公司。
1.3 病毒的增殖及鸡胚半数感染量(EID50)的测定2个AIV分离株经有限稀释后用11日龄SPF鸡胚纯化3代,进行病毒扩增;增殖后的H5亚型AIV按10倍倍比稀释,各稀释度经尿囊腔接种4枚11日龄SPF鸡胚,37℃培养,48h后收集尿囊液测其血凝价,根据Reed-Muench法计算EID50。
1.4 全基因组分析 将F3代的病毒鸡胚尿囊液用TRIzol RNA提取试剂,按说明书的步骤进行病毒RNA的提取,应用MLV试剂进行反转录;根据GenBank中H5N1亚型AIV各基因片段序列选择同源性最高的区域设计PCR引物进行目的片段的扩增,琼脂糖凝胶电泳检测结果,用胶回收试剂进行PCR产物纯化后测序;利用DNA Star软件中SeqMan程序拼接序列,MegA lign进行同源性比较;应用Meg5进行进化树的绘制及分析。
1.5 对动物致病性试验
1.5.1对鸭的致病性试验以100μL含有105EID50病毒鼻腔感染4周龄SPF鸭,感染72h后迫杀鸭并采集脑、气管、胸腺和肝脏等11种脏器;第3d、5d、7d采集喉头和泄殖腔拭子,置于1m L含有抗生素的PBS中,用11日龄鸡胚进行组织或拭子病毒含量的滴定。
1.5.2对小鼠的致病性试验将病毒稀释到终浓度为106~101EID50/50μL,鼻腔感染50μL,106EID50组8只,其余各组5只;72h后迫杀3只采集脑、脾、肾、肺4种脏器,脏器匀浆后接种11日龄鸡胚进行组织病毒含量的滴定。其余组连续观察14d,每天记录小鼠体质量变化及死亡情况,根据每组小鼠的死亡数据用Reed-Muench法计算病毒对小鼠的半数致死量(MLD50)。
2 结果
2.1 全基因组遗传进化分析 对HuB/495/10和HuB/513/10病毒株全基因组序列的进化分析显示:2株病毒全基因组核苷酸同源性相对较高(表1),表明2株病毒基因型基本一致,而且在HA蛋白裂解位点341RRRKR345含有多个连续的碱性氨基酸;与2株病毒核苷酸同源性最高的病毒株为A/great crestedgrebe/Qinghai/1/2009(H5N1)(GCG/QH/1/09)和A/blackcrowned night heron/Hong Kong/659/2008(H5N1)(BNH/HK/659/08)(表2);序列比较显示2株病毒的PA基因与2008年香港株的核苷酸同源性较低,分别是94.2%和94.5%;而其他基因同源性较高(图1)。
2.2 病毒对SPF鸭的致病性试验 用105EID50/100μL H5N1病毒感染SPF鸭后,HuB/495/10组第2d开始发病,所有鸭均呈现明显的神经症状,表现为斜颈、颤抖等,在感染后8d内全部死亡;HuB/513/10组第3d开始发病,第4d死亡一只鸭,剩余鸭完全康复;这些数据表明2010年分离的H5N1亚型AIV对鸭的致病力不同,HuB/495/10能够导致感染鸭100%死亡,HuB/513/10致死率仅为 20%(图2-A),结果显示这2株病毒对鸭的致病性有明显差异。
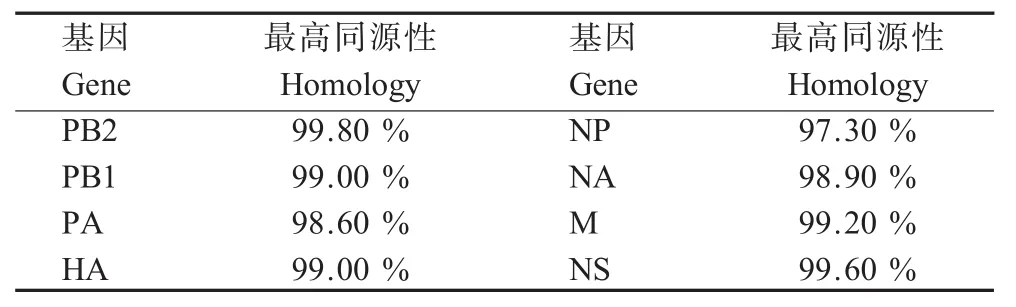
表1 HuB/495/10株与HuB/513/10株的8个基因片段的核苷酸同源性比较Table 1Homology of whole genom ics between HuB/495/10and HuB/513/10viruses
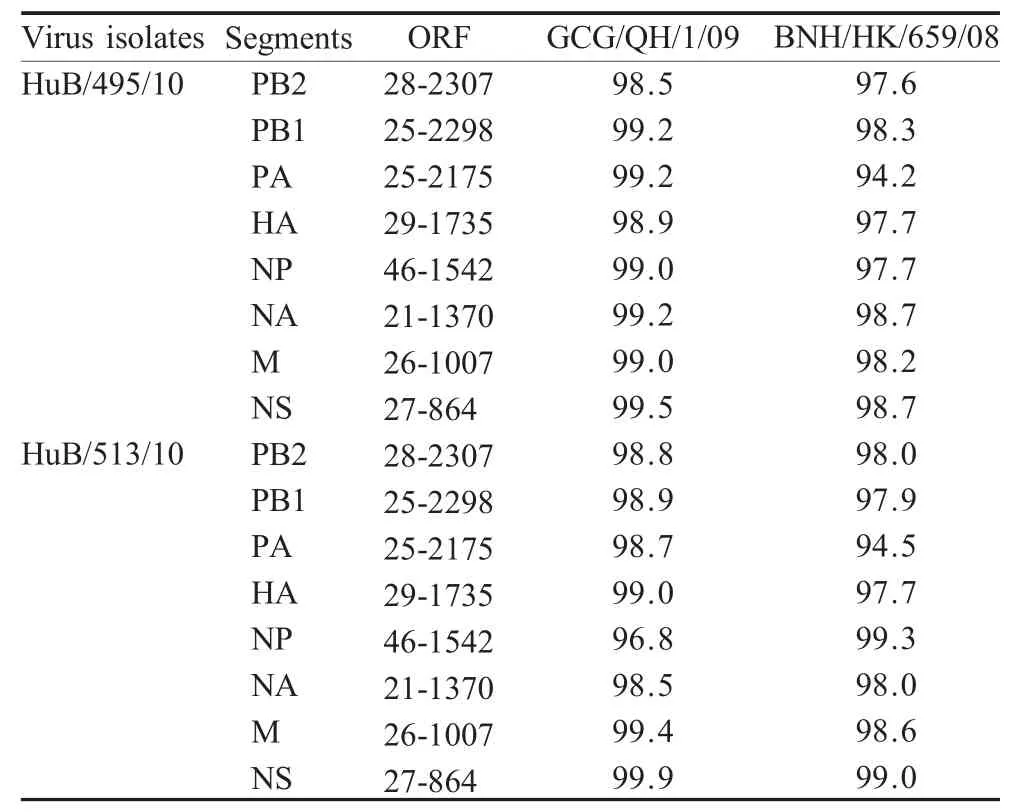
表2 HuB/495/10与HuB/513/10各基因与其他病毒的同源性比较Table 2Homology of HuB/495/10and HuB/513/10comparing w ith other viruses
SPF鸭经鼻腔感染H5N1病毒,72h后采取3只鸭的脏器进行病毒滴定,试验结果表明2株病毒表现出的组织嗜性和在鸭体内的复制情况有一定的差异,HuB/495/10在肺脏中高拷贝复制,HuB/513/10在心脏中高拷贝复制;它们可引起鸭全身性感染,在鸭体内完全复制(图2-B);喉头拭子及泄殖腔拭子滴定结果显示,无论是呼吸道还是泄殖腔,第3d排毒量最高,而第7d基本上不排毒;整体显示呼吸道排毒要比泄殖腔排毒多(图2-C)。
2.3 病毒对BALB/c小鼠的致病性试验 106EID50/50μL病毒在小鼠体内的复制结果显示,2株病毒表现出的组织嗜性和在小鼠体内的复制能力基本一致,在肺脏中高水平复制(105.83EID50/50μL),在小鼠脑、脾、肾中均能够检测到病毒(图3-A);病毒的MLD50结果显示,HuB/495/10和HuB/513/10的MLD50分别为 1.38log10EID50和 1.68log10EID50,对小鼠表现为高致病力(图3-B)。
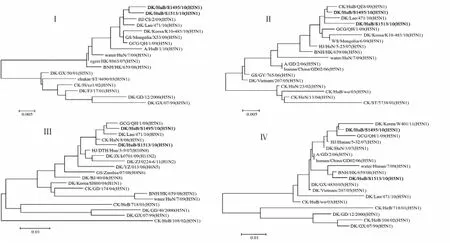
图1 HuB/495/10与HuB/513/10病毒的基因进化关系Fig.1Phylogenetic relation of HuB/495/10and HuB/513/10
A:survival of duck post-infection virus;B:virus titers in differentorgans post-infection virus;C:virus titers of throat and cloacal swabs post-infection virus
图3 小鼠鼻腔感染不同滴度H5N1病毒后脏器病毒复制和存活情况Fig.3The viral replication and pathogenicity to m ice post-infection with HuB/513/10and HuB/495/10
3 讨 论
本研究所涉及的2株H5N1亚型AIV分离于2010年湖北省貌似健康的鸭子,对其进行了序列分析和致病性分析。全基因测序分析显示2株病毒HA蛋白的裂解位点均具有HPAIV典型的分子特征,而且病毒HA蛋白238QSG240含有禽源宿主受体结合位点。核苷酸同源率分析表明这2株病毒的基因与GCG/QH/1/09及BNH/HK/659/08的基因高度同源,可能来源于同一祖先。各基因组进化树显示:两株病毒的8片段基因均来源于近几年在青海、香港等流行的H5N1病毒株;各基因片段在进化树中的位置很近,表明2株病毒的亲源关系很近。目前已有研究证明影响AIV致病性的相关因素很多并涉及多个基因的不同位点,包括M、NS、PA、PB2、HA等[5-11],因此表明了AIV致病性决定因素的多样性。本研究显示PA基因个别位点的变化与已发表文献[7]相似,可能与病毒的致病性相关,具体的分子机制需要进一步实验研究。
野生鸟类和水禽被认为是AIV的自然宿主,近年来研究发现AIV不仅感染禽类,还可以突破种间屏障跨宿主感染,甚至感染人类[12]。以往的研究表明:源自临床健康鸭的H5N1亚型AIV能感染鸭并可通过喉头和泻殖腔向外排毒,但不引起感染鸭发病死亡[3]。近期有研究发现H5N1亚型AIV在实验室环境下能够完全致鸭死亡[13]。本研究结果表明2株病毒均能够感染SPF鸭,但对鸭的致病性具有明显差异,表现为生物学特性的多样性。实验数据显示对鸭具有高致病力的病毒可在鸭体内多个器官高拷贝复制,可能是导致鸭死亡的直接原因。这也证明了H5N1亚型AIV在长期的传播流行过程中逐渐获得了对自然宿主的致死能力,其相关机制有待于进一步研究。
[1]Fouchier R A,Munster V,Wallensten A,et al.Characterization of a novel influenza A virus hemagglutinin subtype(H16)obtained from black-headed gulls[J].J Virol,2005,79:2814-2822.
[2]陈化兰,于康震,步志高.一株鹅源高致病性禽流感病毒分离株血凝素基因的分析[J].中国农业科学,1999,32:87-92.
[3]Chen Hua-lan,Deng Guo-hua,Li Ze-jun,et al.The evolution of H5N1influenza viruses in ducks in southern China[J].Proc Natl Acad Sci USA,2004,101:10452-10457.
[4]Chen Hua-lan,Li Yan-bing,Li Ze-jun,et al.Properties and dissem ination of H5N1viruses isolated during an influenza outbreak in migratory waterfow l in western China[J].J Virol,2006,80:5976-5983.
[5]Fan Shu-fang,Deng Guo-hua,Song Jia-sheng,et al.Two amino acid residues in the matrix protein M 1contribute to the virulence difference of H5N1avian influenza viruses in m ice[J].J Virol,2009,384:28-32.
[6]Jiao Pei-rong,Tian Guo-bing,Li Yan-bing,et al.A singleamino-acid substitution in the NS1protein changes the pathogenicity of H5N1avian influenza viruses in m ice[J].J Virol,2008,82:1146-1154.
[7]Song Jia-sheng,Feng Hua-peng,Xu Jing,et al.The PA protein directly contributes to the virulence of H5N1avian influenza viruses in domestic ducks[J].JVirol,2011,85:2180-2188.
[8]Bussey K A,Bousse T L,Desmet E A,et al.PB2residue 271plays a key role in enhanced polymerase activity of influenza A viruses in mammalian host Cells[J].J Virol,2010,84:4395-4406.
[9]Chen Hua-lan,Bright R A,Subbarao K,et al.Polygenic virulence factors involved in pathogenesis of 1997Hong Kong H5N1influenza viruses in mice[J].Virus Res,2007,128:159-163.
[10]Gabriel G,Dauber B,Wolff T,et al.The viral polymerase mediates adaptation of an avian influenza virus to amammalian host[J].Proc.Natl Acad Sci.USA,2005,102:18590-18595.
[11]Salomon R,Franks J,Govorkova E A.The polymerase complex genes contribute to the high virulence of the human H5N1influenza virus isolate A/Vietnam/1203/04[J].Exp Med,2006,203:689-697.
[12]Reperant L A,Rimmelzwaan G F,Kuiken T,et al.Avian influenza viruses in mammals[J].Rev Sci Tech,2009,28:137-159.
[13]许静,宋家升,苏胜杰,等.H5N1亚型禽流感病毒对鸭的致病性研究[J].中国预防兽医学报,2010,32:301-303.
