gga-m iR-21过表达细胞株对传染性法氏囊病病毒复制的影响
2012-09-11欧阳伟朱向东王永山王永强潘群兴毕振威王笑梅
欧阳伟,朱向东,2,王永山*,王永强,潘群兴,毕振威,王笑梅*
(1.江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室国家兽用生物制品工程技术研究中心,江苏南京210014;2.南京农业大学动物医学院,江苏南京210095;3.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150001)
传染性法氏囊病(Infectious bursal disease,IBD)是由IBD病毒(IBDV)引起的一种侵害雏鸡淋巴组织,特别是中枢免疫器官-法氏囊为主要特征的传染病。该病不但引起患病动物死亡,而且还导致机体免疫抑制,使机体的免疫防御能力降低和疫苗免疫接种失败。由于IBDV的生物学性质稳定、易变异以及多种禽鸟类可携带传播,导致该病毒难以根除,目前仍是危害养鸡业的主要传染病之一[1-2]。
IBDV属双RNA病毒科,基因组包括大(A)小(B)两个节段,编码5种病毒蛋白:VP1、VP2、VP3、VP4和VP5。VP1是病毒的非结构蛋白,由B节段编码的一种依赖RNA的RNA聚合酶(RNA-dependentRNA polymerase,RdRp),VP1与病毒RNA的复制和毒力有关。A节段含有两个部分重叠的开放阅读框(ORF),其中一个大ORF编码多聚蛋白,然后被加工成VP2、VP4和VP3。VP2和VP3是病毒的结构蛋白,构成病毒衣壳,VP2占结构蛋白总量的51%,既是病毒的主要结构蛋白,又是病毒的主要保护性抗原[3]。VP3和病毒RNA组成螺旋状的核蛋白复合物,位于病毒颗粒内部[4]。VP4为病毒自身蛋白酶[5]。另一个小ORF编码VP5,是病毒的非结构蛋白,与病毒的毒力和复制效率有关[6]。
迄今,已对IBDV病原学、生态学以及流行病学等进行了大量研究[7],对IBDV的致病机理研究仍处在临床症状与病理变化的描述以及细胞和体液免疫应答检测分析阶段,缺乏对IBDV与靶细胞相互作用分子机制的深入研究。
基因调控是一个多渠道、多层次、多方式的时空动态过程。其中,在转录后和翻译水平的调控是重要的调控方式之一。M icroRNA(miRNA)是一种21nt~25nt的小分子RNA,广泛存在于真核生物中,是一类非编码RNA分子,本身不具有ORF[8]。细胞内源性m iRNA可以作为一种引导性分子通过碱基配对与靶mRNA结合,从而在转录后水平引起靶mRNA的剪切或翻译的抑制,在不同的调节途径中发挥关键作用,包括发育时序的控制、细胞分化、细胞增殖、细胞凋亡、代谢、激素分泌、肿瘤发生、免疫应答等多种生理和病理过程[9]。
为分析细胞内源性m iRNA对IBDV复制的影响,本实验室前期的研究显示,用IBDV弱毒和强毒分别感染鸡胚成纤维细胞(CEF)和SPF鸡,用m iRNA芯片技术分析IBDV感染24h后细胞miRNA的变化,结果表明,IBDV感染对细胞内源性m iRNA的表达影响显著[10]。
本研究在对IBDV感染细胞miRNA表达差异分析的基础上,选择表达上调的细胞gga-miR-21,采用慢病毒表达系统建立过表达gga-m iR-21的DF-1细胞株,分析过表达gga-m iR-21细胞对IBDV复制的影响及其分子作用机理,为探索新型抗IBDV药物与疫苗设计奠定基础。
1 材料和方法
1.1 主要实验材料 IBDV B87CEF适应株和293FT细胞系均为本实验室保存;慢病毒表达系统由南京农业大学刘红林教授惠赠;SYBR PrimeScript m iRNA RT-PCR试剂盒、M iniBEST质粒纯化试剂盒、DNA凝胶回收试剂盒、限制性内切酶均购自TaKaRa公司;Lipofectam ine2000转染试剂、Blasticidin均购自Invitrogen公司;Hexadimethine bromide(Polybrene)购自Sigma公司;双荧光素酶报告载体(pRL-CMV、pGL3-control)以及DualLuciferaseReporter Gene Assay Kit均购自Promega公司;SuperSignal West Pico化学发光底物购自Thermo公司。
1.2 pri-gga-m iR-21的克隆 从m iRBase数据库(http://www.mirbase.org/)获得成熟gga-m iR-21和pregga-miR-21的序列,用pre-gga-miR-21序列搜索鸡的基因组数据库(http://www.ensembl.org/index.htm l),选择包含22nt成熟gga-miR-21及两侧各250nt侧翼基因组序列共约520nt的pri-gga-m iR-21基因片段片段,设计引物pri-gga-miR-21(F):5'-CGGAATTCG ATTAGCCTAGGGGGGATT-3'(EcoRⅠ)和 pri-ggam iR-21(R):5'-GCGTCGACGAAGTTATACACGAAG CATAC-3'(SalⅠ),引物由Invitrogen公司合成。
从60日龄的来航鸡肝脏组织中提取基因组DNA,通过PCR扩增pri-gga-miR-21基因片段,克隆于pMD18-T载体中构建重组质粒pMD-m iR-21。
1.3 重组慢病毒表达质粒的构建 将pMD-m iR-21和慢病毒表达载体pL-EGFP分别用EcoRⅠ和SalⅠ双酶切,分别回收pri-gga-miR-21和载体pL-EGFP,连接并转化E.coli Stbl3感受态细菌中,用BAC/PAC DNA Isolation Kit质粒纯化试剂盒提取质粒,EcoRⅠ和SalⅠ双酶切鉴定,获得含pri-gga-m iR-21基因的重组慢病毒表达质粒pL-m iR-21(图1)。同时,用AflⅡ和XhoⅠ双酶切鉴定重组质粒pL-m iR-21的5'LTR和3'LTR区域是否发生重排。
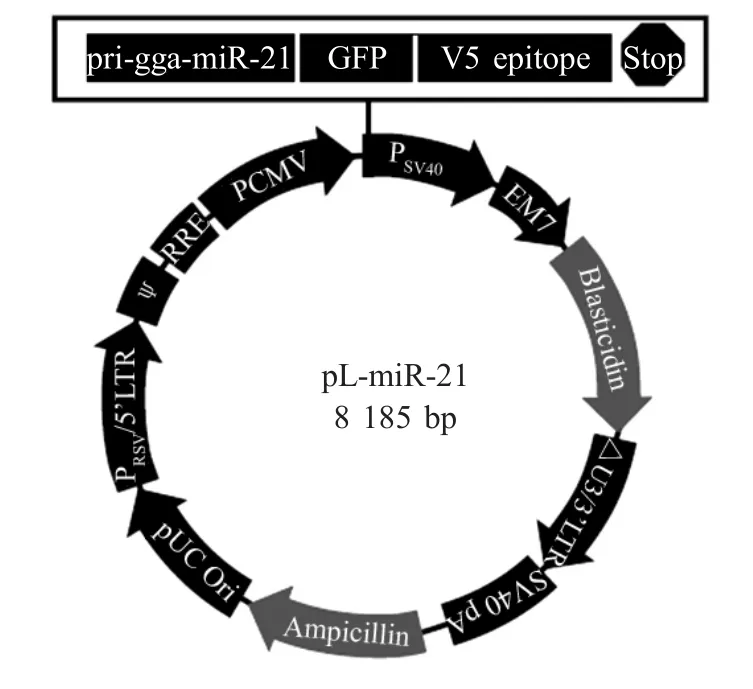
图1 重组慢病毒表达载体的构建Fig.1Schematic presentation of plasm id pL-m iR-21
1.4 重组慢病毒的制备 将pL-miR-21(1μg)和3个包装质粒[pLP1(2μg)、pLP2(1μg)和 pLP/VSVG(1μg)]混合物共转染293FT细胞,转染按Lipofectam ine2000操作说明书进行,37℃培养12h,弃去质粒脂质体混合物,加入2m L含10%胎牛血清的DMEM完全培养液,置37℃继续培养;72h后收集293FT细胞上清液,4℃,4000r/m in离心10m in,除去细胞碎片,获得含gga-m iR-21基因的重组慢病毒,命名为VL+miR-21。
1.5 过表达gga-m iR-21细胞株的建立 将重组慢病毒VL+miR-21接种于DF-1细胞,加入终浓度为8μg/m L的polybrene,37℃培养48h后,在荧光显微镜下观察绿色荧光蛋白(GFP)的表达。用含8μg/m L的杀稻瘟菌素的筛选培养基筛选,每3d更换1次,直至空白对照细胞全部死亡。选取存活的GFP阳性的细胞进行克隆纯化,扩大培养,维持正常抗性压力传代培养,获得过表达gga-m iR-21的DF-1细胞株,命名为DF-m iR-21。以鸡5S rRNA作为内参基因,采用SYBRGreenⅠ荧光定量RT-PCR(qRT-PCR)检测gga-miR-21的表达量,计算方法为 2-△△Ct法。gga-miR-21和5S rRNA的反向引物由SYBR Prime-Scriptm iRNA RT-PCR试剂盒提供,gga-miR-21和5S rRNA的正向引物序列为:gga-m iR-21(F):5'-GC GTAGCTTATCAGACTGATGTTGAA-3'和5S rRNA(F):5'-GTACTTGGATGGGAGACTGCCT-3'。引物由Invitrogen公司合成。
1.6 DF-m iR-21细胞株的稳定性 将DF-m iR-21细胞进行传代培养,连续传15代,每5代鉴定一次,在荧光显微镜下观察GFP的表达,并采用qRT-PCR检测gga-miR-21的表达量,分析DF-miR-21细胞株的稳定性。
1.7 过表达gga-m iR-21细胞株对IBDV复制的影响 制备DF-miR-21细胞单层,待细胞汇合度达到60%时,每孔接种100TCID50的IBDV B87株,分别于24h~96h收集细胞培养上清液,测定IBDV滴度。同步设立正常DF-1细胞感染IBDV对照组。
1.8 gga-m iR-21调控IBDV复制的分子机理
1.8.1双荧光素酶报告系统检测利用生物信息学方法(RNA22和 RNAhybrid2.2)分析 gga-miR-21在IBDV基因组A、B节段中的m iRNA结合位点,IBDV的VP1基因中含有gga-m iR-21靶序列(1713bp~1734bp)(图2),选择IBDV VP1基因中包含ggam iR-21靶点及两侧各250nt侧翼基因组序列的约520nt片段,设计引物,IBDV B(F):5'-CGGGAT CCGCTCTAGTGGTGGACTCATCGTGC-3'(Bam HⅠ)和 IBDV B(R):5'-CGGGATCCACCTACCAACCTC AACGCCTCATAC-3'(Bam HⅠ)。引物由 Invitrogen公司合成。
取IBDV细胞培养物,TRIzol法提取总RNA,用以上引物进行RT-PCR扩增IBDV部分VP1基因(VP1'),将其通过Bam HⅠ酶切克隆至荧光素酶报告载体pGL3-control中,构建重组荧光素酶报告质粒pGL3-VP1'。将pGL3-VP1'和pRL-CMV分别共转染DF-m iR-21细胞和正常的DF-1细胞,检测gga-m iR-21对IBDV VP1'是否具有调控作用。同步设立pGL3-control和pRL-CMV共转染DF-miR-21细胞和DF-1细胞的对照组。
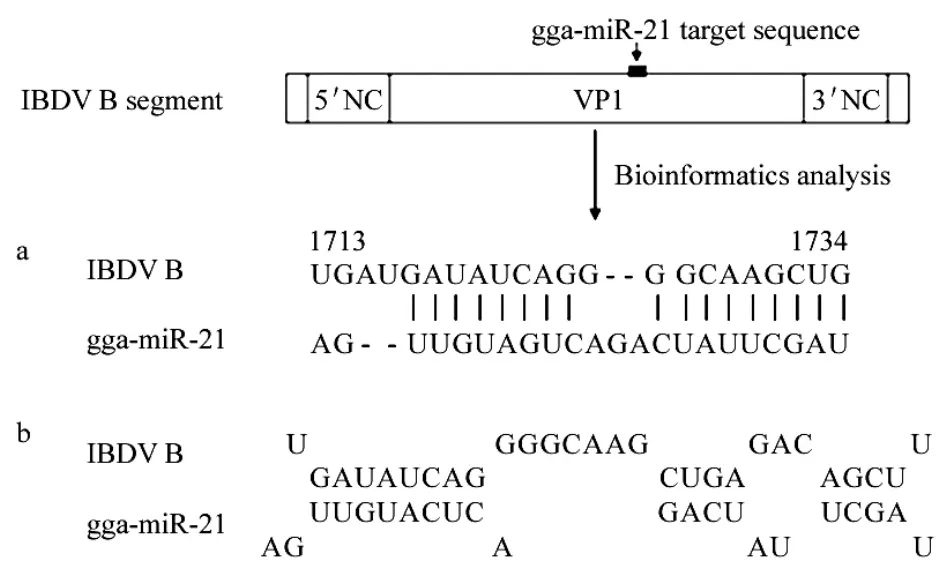
图2 生物信息学分析gga-m iR-21靶点Fig.2Bioinformatics analysis of the target gene of gga-miR-21by RNA22and RNAhybrid2.2
1.8.2Western blot检测收集IBDV感染DF-miR-21后48h的细胞培养物,采用western blot检测VP1蛋白在细胞中的表达水平。同步设立正常DF-1细胞感染IBDV对照组。
1.8.3qRT-PCR检测收集IBDV感染DF-m iR-21后48h的细胞培养物,提取细胞总RNA,用qRT-PCR检测IBDV VP1在细胞中的RNA转录水平。同步设立正常DF-1细胞感染IBDV对照组。
2 结果
2.1 pri-gga-m iR-21的克隆 以鸡的基因组DNA为模板,经PCR扩增显示,pri-gga-m iR-21基因片段约为500bp(图3)。将该序列克隆于pMD18-T质粒中进行测序鉴定,测序结果与预期的pri-gga-miR-21基因片段序列完全一致。
2.2 重组慢病毒表达质粒的构建 将pri-gga-m iR-21基因片段和pL-EGFP载体连接,获得含pri-ggamiR-21基因片段的重组慢病毒表达质粒pL-m iR-21,经EcoRⅠ和SalⅠ双酶切分析,可见2条长度分别约7600bp和500bp的 DNA片段(图 4A);用AflⅡ和XhoⅠ鉴定重组质粒pL-miR-21的5'LTR和3'LTR区域,可见3条长度分别约为3600bp、2400bp和2000bp的片段,与预期大小相符合(图4B)。
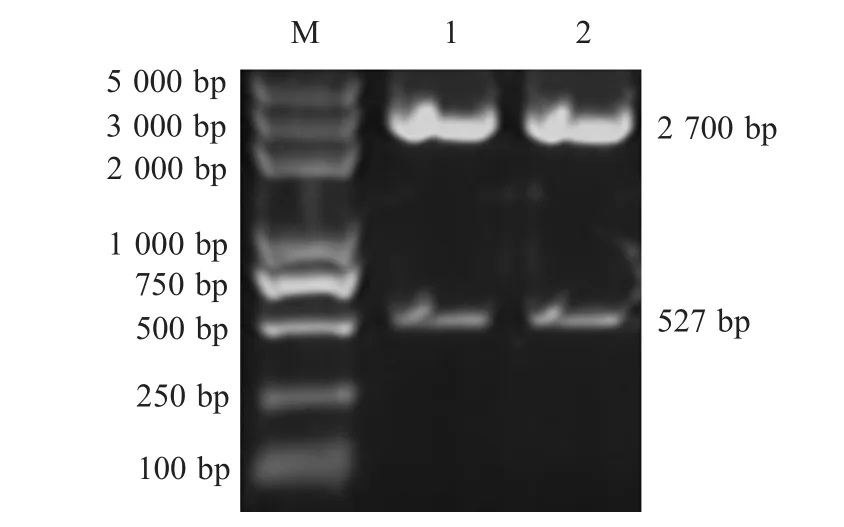
M:DNA Marker;1,2:pMD-miR-21digested w ith EcoRⅠ and SalⅠ
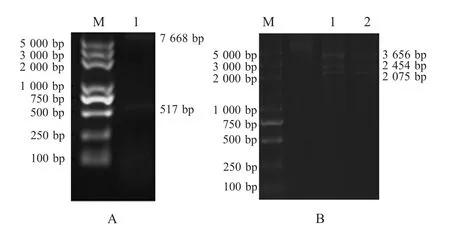
图4 pL-m iR-21的酶切图谱Fig.4Digestion map of pL-miR-21
2.3 重组慢病毒的制备 将重组慢病毒表达质粒pL-miR-21和 3个包装质粒 pLP1、pLP2和 pLP/VSVG混合物共转染293FT细胞,获得含pri-ggamiR-21基因的重组慢病毒,命名为VL+miR-21。
2.4 过表达gga-m iR-21细胞株的建立 将重组慢病毒VL+miR-21接种到DF-1细胞,37℃培养48h,在荧光显微镜下可观察到GFP的表达(图5),间接表明gga-m iR-21在DF-1细胞中获得表达。用杀稻瘟菌素进行筛选,挑选阳性细胞进行克隆纯化,扩大培养,将该细胞株命名为DF-m iR-21。将DF-miR-21细胞进行传代培养,连续传代15代后,细胞生长正常,荧光显微镜下可观察到GFP表达,荧光定量RT-PCR检测其gga-m iR-21能够在DF-m iR-21细胞中稳定表达,比正常DF-1细胞提高约60%(图6)。
2.5 过表达gga-m iR-21细胞株对IBDV复制的影响 将IBDV分别接种DF-miR-21和DF-1细胞单层后,分别于不同时间收集细胞培养上清液,测定病毒滴度。检测结果显示,DF-m iR-21细胞组(最低值为103.75,最大值为106)的病毒滴度(TCID50)在对应的时间点均小于DF-1细胞对照组(最低值为104.25,最大值为 108.75)(图 7)。
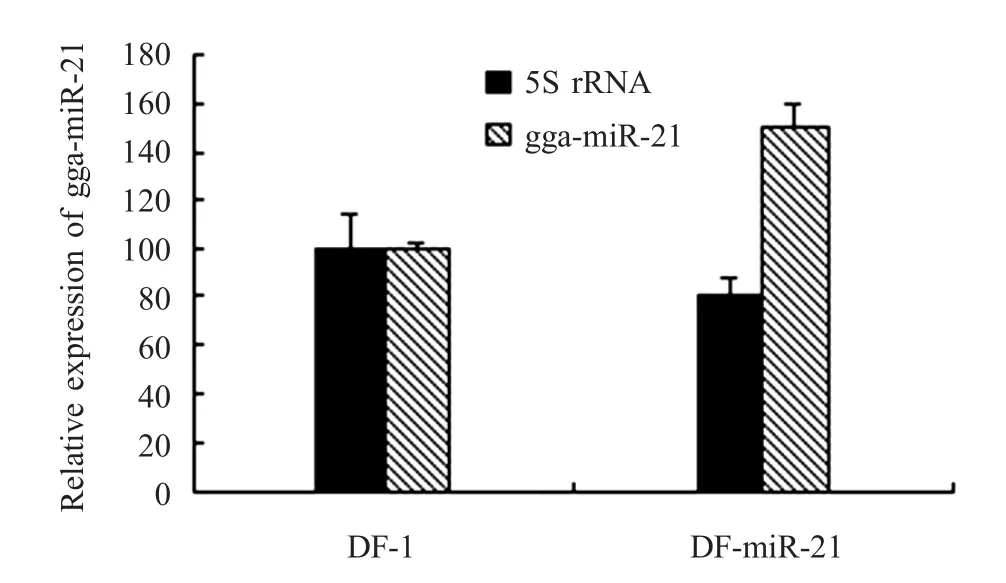
图6 荧光定量RT-PCR检测gga-m iR-21在DF-1细胞中的表达Fig.6Detection of gga-m iR-21in DF-1cells infected w ith VL+miR-21 by qRT-PCR
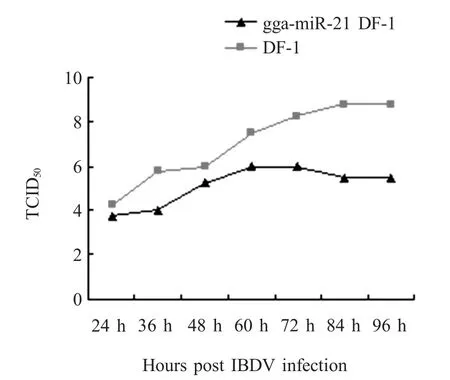
图7 过表达gga-m iR-21对IBDV在DF-1中复制的抑制效果Fig.7Inhibition of IBDV replication by gga-m iR-21in DF-m iR-21cells
2.6 gga-m iR-21调控IBDV复制的分子机理
2.6.1双荧光素酶报告系统检测生物信息学分析结果显示,在IBDV基因组的B节段(VP1基因)中存在gga-miR-21潜在靶序列(1713bp~1734bp)。将含有靶序列的重组质粒pGL3-VP1'和pRL-CMV共转染DF-miR-21细胞,其荧光素酶活性约降低72.05%(相对于对照组:pGL3-VP1'和pRL-CMV共转染DF-1细胞组);pGL3-control和pRL-CMV共转染的DF-miR-21细胞组,其荧光素酶活性与DF-1细胞对照组无显著差异(图8)。
2.6.2Western blot检测采用western blot检测VP1蛋白在DF-m iR-21细胞中的表达水平,DF-miR-21细胞组显著低于DF-1细胞对照组(图9)。
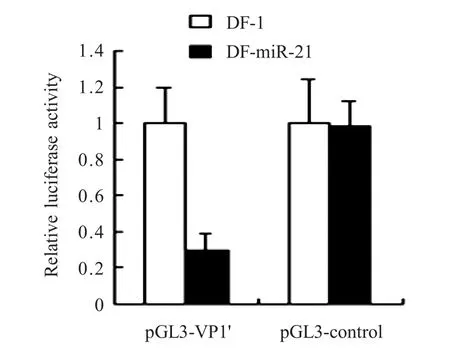
图8 双荧光素酶报告系统分析gga-m iR-21对IBDV VP1'的靶点分析Fig.8Analysis of luciferase activity of pGL3-VP1'by dual-luciferase reporter assay system
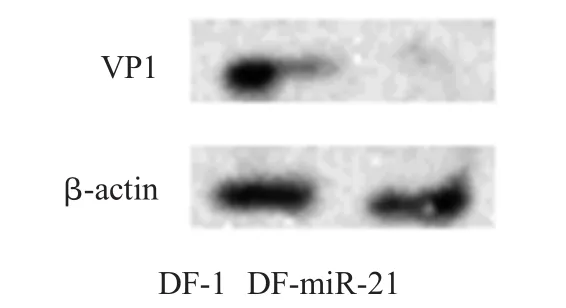
图9 Western blot检测IBDV VP1蛋白在感染细胞中的蛋白翻译水平Fig.9Detection of IBDV VP1expression by western blot
2.6.3qRT-PCR检测采用qRT-PCR检测IBDV VP1基因在DF-m iR-21细胞中的mRNA转录水平,DF-miR-21细胞组与DF-1细胞对照组没有明显差异(图 10)。
3 讨 论
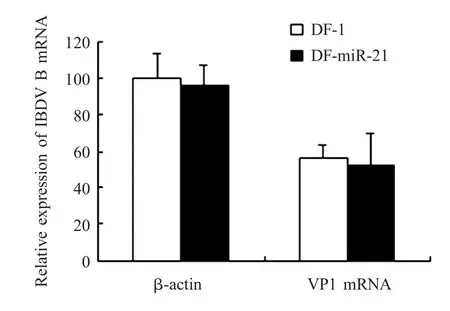
图10 荧光定量RT-PCR检测IBDV VP1基因在感染细胞中的mRNA转录水平Fig.10IBDV VP1mRNA level wasmeasured by quantitative RT-PCR
宿主细胞m iRNA调控着侵染病毒基因的表达,同时病毒也演化了高度复杂的基因沉默机制,以逃避宿主的免疫应答,病毒不仅可以编码miRNA以抵抗细胞的抗病毒应答,甚至能够利用细胞的m iRNA途径帮助病毒复制。Lanford等用一种与m iR-122互补的锁核苷酸修饰的寡核苷酸(SPC3649)处理感染HCV(HCV)的黑猩猩,抑制m iR-122与其靶mRNA结合,结果持续抑制了黑猩猩的HCV病毒血症,并且肝脏活组织检查发现HCV诱导的组织病理变化明显改善,SPC3649可作为一种潜在的HCV治疗药物[11]。Song等利用生物信息的方法预测调控H1N1流感病毒基因组的m iRNA,然后用实验验证,结果发现:细胞m iR-323、m iR-491和m iR-654能够靶向H1N1流感病毒的PB1基因,从而抑制H1N1流感病毒的复制[12]。由此表明,对病毒感染靶细胞miRNA分析是研究病毒致病性及其病毒与宿主相互作用的新途径[13]。
为研究细胞内源性miRNA与IBDV复制的相互作用,本实验室前期对感染IBDV强弱毒株24h后的法氏囊组织和鸡胚成纤维细胞用m iRNA芯片技术进行了定量检测,结果显示IBDV感染对细胞内源性m iRNA的表达影响显著,进一步分析发现,这些上调/下调的m iRNA调控着细胞内多种代谢和信号传导途径[10]。在这些表达差异显著的m iRNA中,gga-miR-21表达显著上调。有研究表明,miR-21在心脏衰竭的心肌成纤维细胞中能够通过抑制Spry1表达来扩张ERK-MAP激酶的活性,降低m iR-21的表达水平,可以抑制间质纤维化和减弱心肌功能障碍[14]。m iR-21在肿瘤组织的表达量要显著高于正常组织,在体外和体内实验表明,降低miR-21的表达能够抑制肿瘤细胞的生长,研究表明其靶基因为肿瘤抑制基因原肌球蛋白1(TPM 1)。进一步试验发现,m iR-21还可以通过靶向多个肿瘤转移抑制基因来抑制肿瘤的侵入和转移[15-16]。
为研究gga-miR-21对IBDV感染复制的影响,本实验采用慢病毒表达系统建立了过表达gga-miR-21的细胞株,病毒感染实验表明,gga-miR-21对IBDV的复制具有显著的抑制作用。为了解析gga-miR-21影响IBDV复制的分子机理,用生物信息学方法分析发现,在IBDV基因组B节段的VP1基因中存在与gga-miR-21结合靶序列,并用双荧光素酶报告系统进行了验证,在此基础上,进一步用westren blot和荧光定量RT-PCR分别定量测定了蛋白质翻译和mRNA转录水平,实验结果表明gga-miR-21不是通过降解VP1mRNA,而是通过抑制其mRNA的翻译来实现了对IBDV复制的抑制。由于IBDV B节段编码VP1蛋白,VP1是一种依赖RNA的RNA聚合酶,VP1与病毒RNA的复制和毒力有关[17],因此可以解释,gga-m iR-21抑制B节段编码的VP1蛋白的合成,使病毒复制减弱,病毒滴度降低。
建立m iRNA过表达细胞株进行m iRNA分子调控功能研究,可以克服脂质体介导的质粒或miRNA转染效率低、脂质体的毒性以及m iRNA表达持续时间短等问题。目前,构建miRNA的过表达细胞株有两种方法:一种是将原始的miRNA(包括成熟的m iRNA序列及其两侧各250nt共约520nt的序列)利用慢病毒表达系统进行表达;另一种是将miRNA前体利用慢病毒表达系统进行表达。本研究选择原始的m iRNA序列插入到慢病毒表达系统进行表达,是因为原始的miRNA包含了成熟m iRNA更长的侧翼序列,更容易被Drosha和Dicer酶识别、加工成与天然结构相接近的成熟miRNA。此外,慢病毒具有可感染分裂细胞及非分裂细胞、不易诱发宿主免疫反应而且具有高效整合、高效表达等优点[18]。
本研究结果不仅阐明了miR-21对IBDV复制的影响及其分子调控机理,而且为进一步认识病毒复制与宿主细胞抗病毒相互作用的分子免疫调控机制、发掘新型抗病毒药物与疫苗分子靶标探索了一条新的技术途径。
[1]Dolz R,Majo N,Ordonez G,et al.Viral genotyping of infectious bursal disease viruses isolated from the 2002acute outbreak in Spain and comparison w ith previous isolates[J].Avian Dis,2005,49(3):332-339.
[2]Wang,Yong-shan,Ouyang Wei,Liu Xiao-juan,et al.Virus-like particles of hepatitis B virus core protein containing five m imotopes of infectious bursal disease virus(IBDV)protect chickens against IBDV[J].Vaccine,2012,30:2125-2130.
[3]王永山,欧阳伟,潘群兴,等.近期引起免疫失败的传染性法氏囊病病毒VP2基因的分子特征[J].中国兽医科学,2008,38(12):919-925.
[4]M irriam G J,Tacken L,Ben P H,et al.Infectious bursal disease virus capsid protein VP3interacts both with VP1,the RNA-dependent RNA polymerase,and w ith viral double-stranded RNA[J].JVirol,2002,76(22):11301-11311.
[5]King A M Q,Adams M J,Carstens E B,et al.Ninth report of the international comm ittee on taxonomy of viruses[M].USA:Elsevier academ ic press,2012,500-503.
[6]Lombardo E,Maraver A,Espinosa I,et al.VP5,the nonstructural polypeptide of infectious bursal disease virus,accumulates within the host plasma membrane and induces cell lysis[J].Virology,2000,277(2):345-357.
[7]Muller H,Islam M R,Raue R.Research on infectious bursal disease-the past,the present and the future[J].Vet M icrobiol,2003,97(1-2):153-165.
[8]Guarnieri D J,Dileone R J.M icroRNAs:a new class of gene regulators[J].Ann Med,2008,40(3):197-208.
[9]Lim L P,Glasner M E,Yekta S,et al.Vertebrate m icroRNA genes[J].Science,2003,299(5612):1540-1549.
[10]欧阳伟,王永山,王永强,等.传染性法氏囊病病毒感染细胞内源性m icroRNA表达差异分析[J].中国兽医学报,2012,32(3):329-336.
[11]Lanford R E,Hildebrandt-Eriksen E S,Petri A,et al.Therapeutic silencing ofm icroRNA-122in primates with chronic hepatitis C virus infection[J].Science,2010,327(5962):198-201.
[12]Song Li-ping,Liu He,Gao Shi-juan,et al.CellularmicroRNAs inhibit replication of the H1N1influenza A virus in infected cells[J].JVirol,2010,84(17):8849-8860.
[13]Grassmann R,Jeang K.The roles of m icroRNAs in mammalian virus infection[J].Biochim Biophys Acta,2008,1779(11):706-711.
[14]Thum T,Gross C,Fiedler J,et al.M icroRNA-21contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[15]Zhu Shuo-m ing,Si M in-liang,Wu Hai-long,et al.M icroRNA-21targets the tumor suppressor gene tropomyosin 1(TPM 1)[J].JBiol Chem,2007,282(19):14328-14336.
[16]Zhu Shuo-m ing,Wu Hai-long,Wu Fang-ting,et al.M icroRNA-21targets tumor suppressor genes in invasion and metastasis[J].Cell Res,2008,18:350-359.
[17]Boot H J,Hoekman A J,Gielkens A L.The enhanced virulence of very virulent infectious bursal disease virus is partly determined by its B-segment[J].Arch Virol,2005,150(1):137-144.
[18]Sena-Esteves M,Tebbets J C,Steffens S,et al.Optim ized large-scale production of high titer lentivirus vector pseudotypes[J].JVirol Methods,2004,122:131-139.
