正硅酸乙酯溶胶-凝胶制备壳聚糖-SiO杂化材料❋2
2012-09-11崔少伟唐正华葛建芳
崔少伟,唐正华,葛建芳
(仲恺农业工程学院 化学化工学院 ,广东 广州 510225)
溶胶-凝胶法(Sol-Gel)是一种制备有机无机纳米杂化功能材料的有效方法,同时能够用低成本、环境友好的天然原料制备有机无机杂化功能材料,从而实现清洁生产.此方法已被研究者所关注[1-3].
壳聚糖(Chitosan)作为材料应用局限性较大,但其结构单元中含有 2个羟基和 1个氨基活泼官能团,很容易和其它化合物上的基团反应,形成的杂化膜具有高弹性、低密度和高韧性等优点.正硅酸乙酯(T EOS)水解缩合反应后生成的 SiO2和壳聚糖之间存在的作用力主要有三种,氢键、离子键和共价键,如图 1所示[4].
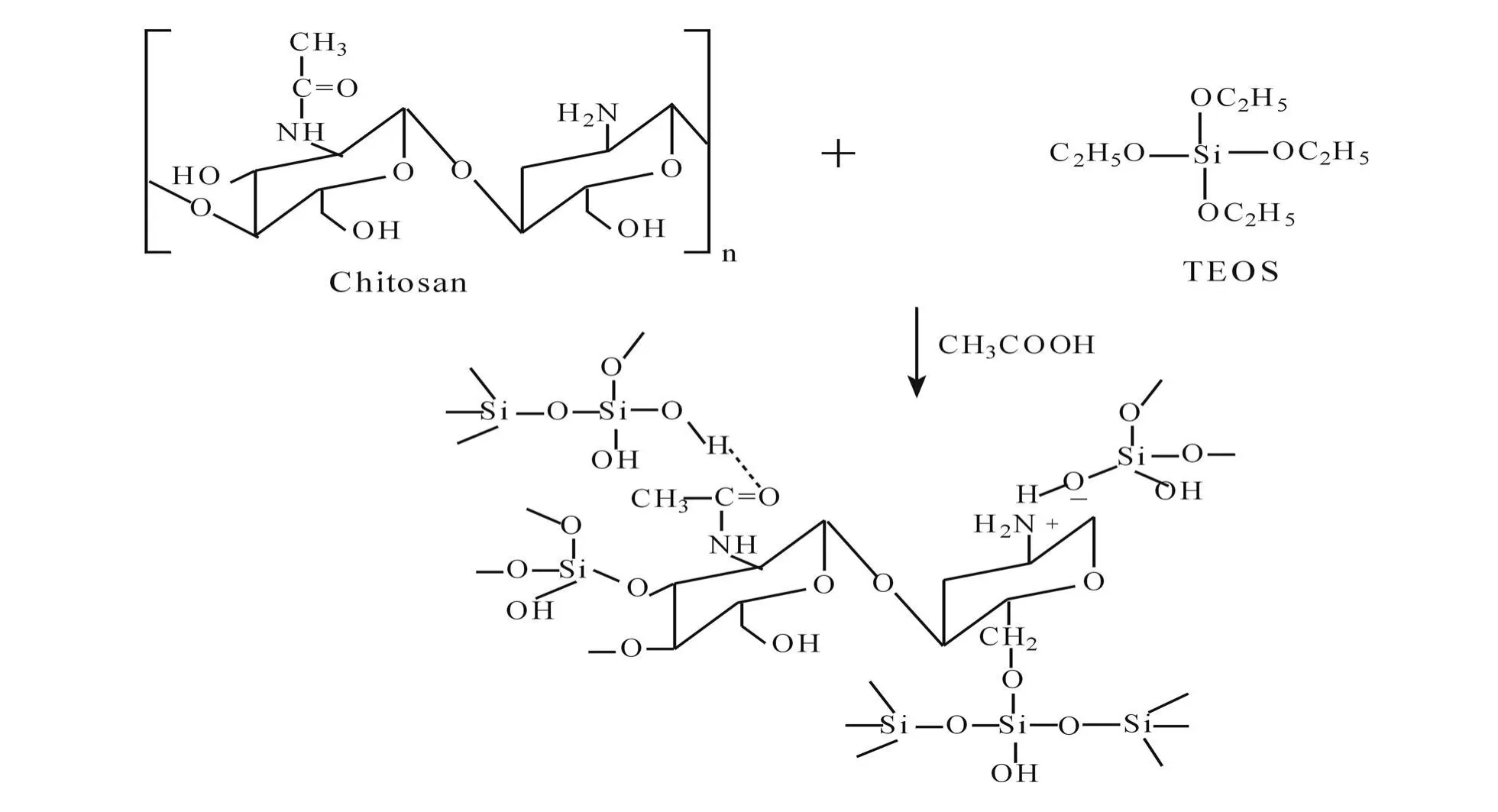
图1 壳聚糖-SiO2杂化材料示意图Fig.1 Synthesis of chitosan-SiO2hybrid materia
部分脱乙酰度的壳聚糖由于含有一定的游离氨基基团,可溶于稀酸溶液中,这样就可用溶胶-凝胶法制备壳聚糖的杂化材料.目前,已有一些研究人员在合成有机无机杂化材料方面做了大量的研究工作[5-8].张军丽[9]等用纳米氧化硅颗粒作为无机前躯体,与合成的 N-酰化壳聚糖通过Sol-Gel过程制备了力学性能优异、热稳定性较高的壳聚糖-纳米 SiO2片状杂化材料.朱爱萍等[10]采用迈克尔加成反应合成了丁酰壳聚糖-甲基丙烯酰氧基丙基三甲氧基硅烷(M PTM S),然后与T EOS水解产物反应制备了透明的壳聚糖-SiO2材料.本研究直接用稀醋酸催化 T EOS溶胶-凝胶SiO2原位杂化法和共混法两种工艺制备了壳聚糖-SiO2杂化材料.
1 实验部分
1.1 药 品
壳聚糖(T0060,脱乙酰度(DAC)为 95%),广州市瑞尔思科学仪器有限公司;正硅酸乙酯(TEOS),工业纯,广州兆舜化工材料有限公司;冰醋酸,分析纯,天津市百世化工有限公司;五水硫酸铜(CuSO4◦ 5H2O),分析纯,荣达化工有限公司.
1.2 主要仪器及设备
万能材料试验机,AGS-J,日本岛津;TGA热重分析仪,HT G-1,北京恒久科学仪器厂;电感耦合等离子体原子发射光谱仪(ICP),美国电热公司;扫描电镜(SEM),LEO1530V P,德国 LEO公司;傅里叶变换红外光谱仪 Spectrum 100,PerkinElmer公司.
1.3 壳聚糖-SiO2杂化材料的制备
将 30 mL的冰醋酸用 100 mL的容量瓶定容,制备 3%(v/v)的醋酸溶液.采用两种方法制备壳聚糖-SiO2杂化材料
1)共混法(用 M表示).取一定量的 TEOS于 60 mL醋酸溶液中,在搅拌下 60℃反应 4 h,然后与 1 g壳聚糖混合,得到粘稠透明的溶胶;涂膜,40℃减压干燥,脱膜,得到光滑透明平整的壳聚糖-SiO2杂化膜;根据加入 TEOS的量 0 g,0.2 g,0.4 g,0.6 g,0.8 g,1 g,2 g,3 g,4 g,将膜依次标记为 M-0,M-0.2,M-0.4,M-0.6,M-0.8,M-1,M-2,M-3和M-4.
2)原位杂化法(用 R表示).称取 1 g壳聚糖,溶于 60 mL醋酸,然后与一定量的 TEOS混合,在搅拌下 60℃反应 4 h,得到粘稠透明的溶胶;涂膜,40℃减压干燥,脱膜,得到光滑透明平整的壳聚糖-SiO2杂化膜;根据加入 TEOS的量0 g,0.2g,0.4 g,0.6 g,0.8g,1 g,2 g,3 g,4g,将膜依次标记为 R-0,R-0.2,R-0.4,R-0.6,R-0.8,R-1,R-2,R-3和R-4.
1.4 耐水性试验
取一定质量(M0)的试样,室温放入蒸馏水中浸泡 48 h,然后取出滤纸轻轻吸干膜表面的水分称重,质量为 M1,计算吸水倍率.
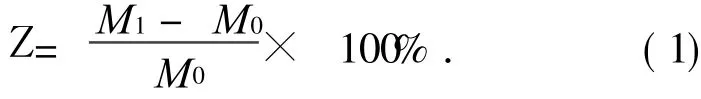
1.5 力学性能测试
用 4 mm×75 mm的裁刀将壳聚糖杂化薄膜剪成哑铃形拉伸试样,在室温下用电子拉伸试验机,拉伸速率 5 mm/min,测得杂化膜的拉伸断裂强度(e)及断裂伸长率(X).拉伸断裂强度(e)和断裂伸长率(X)根据式(2)和(3)计算.
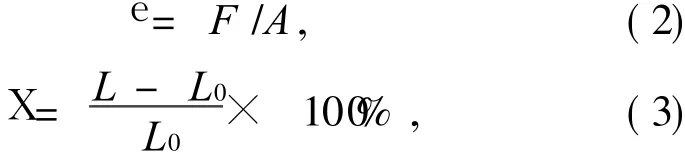
式中:F为试片断裂时的负荷,N;A为试片初始横截面积,m2;L0为试片初始有效长度;L为其断裂时测量线间的距离.
1.6 金属 Cu2+吸附试验
壳聚糖含有羟基(-OH)和游离的氨基(-NH2),其分子结构中每个基本单元都连有一个伯胺基.氮原子上的孤对电子可投入到金属离子的空轨道中,形成配价键结合,因此它可以吸附金属离子,形成稳定的配合物,可将其用于重金属废水的处理、自来水的净化及湿法冶金中金属离子的分离等许多领域[11-12].
将杂化薄膜剪成 1 mm×1 mm的碎片,在室温下取 0.1 g壳聚糖放于 250 mL的锥形瓶中,加入 100 mL 100 ppm Cu2+的溶液,在恒温振荡箱中进行吸附操作.每隔一定时间取 0.5 m L上清液,稀释 10倍,测其金属离子含量.由式(4)计算壳聚糖金属离子的吸附量 q(mg/g).
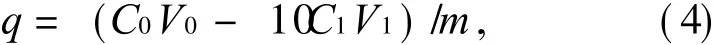
式中:C0,C1分别为初始和测得 Cu2+的浓度,ppm;V0,V1分别为吸附前溶液体积和吸附后溶液体积,L;m为加入壳聚糖杂化薄膜的质量,g.
1.7 TGA测试
在 40 mL/min流速的氮气保护下,先将样品以 20℃ /min速率升温至 780℃,保温 10 min,记录实验数据.
2 结果与讨论
2.1 傅里叶变换红外光谱表征
在图 2的 a中,3000~ 3650 cm-1的宽峰为-OH和 -NH2的伸缩振动峰,2921 cm-1和2887 cm-1左右为 C-H的伸缩振动吸收峰,1538 cm-1处是 -NH2的变形振动峰,1406 cm-1处为 = CH2的变形吸收峰,1151 cm-1处和897 cm-1处是壳聚糖上 U(1-4)糖苷键吸收峰,1058 cm-1处和 1022 cm-1处分别为 C3上二级羟基和 C6上一级羟基的 C-O伸缩振动峰.
在图 2的 b和 c曲线中 ,3000~ 3650 cm-1的-OH和 -NH2的伸缩振动峰和 1538 cm-1处的-NH2的变形振动峰明显变小,这应该是壳聚糖上的 -NH2与 Si-OH形成氢键的缘故.同时,在 b中的 1068 cm-1和 c中的 1062 cm-1处出现宽的 Si-O-Si特征吸收峰;而在b中的 782 cm-1处和c中的779 cm-1处产生新的吸收峰为Si-OSi的无机网络吸收峰[12].这说明 TEOS水解缩合形成了三维网络结构.在 b,c中 1022 cm-1处 C6上羟基 C-O峰强明显变低,并出现蓝移,它们说明C3和二氧化硅分子间主要是很强的氢键作用,而C6上的羟基和二氧化硅分子间已经发生了化学反应,形成新的化学键 C-O-Si.从图 2中还可以看到,1151 cm-1和 897 cm-1(b中蓝移至901 cm-1处,c中蓝移至 902cm-1处)处吸收峰变化不明显,说明壳聚糖 U(1-4)糖苷键没有参加反应.
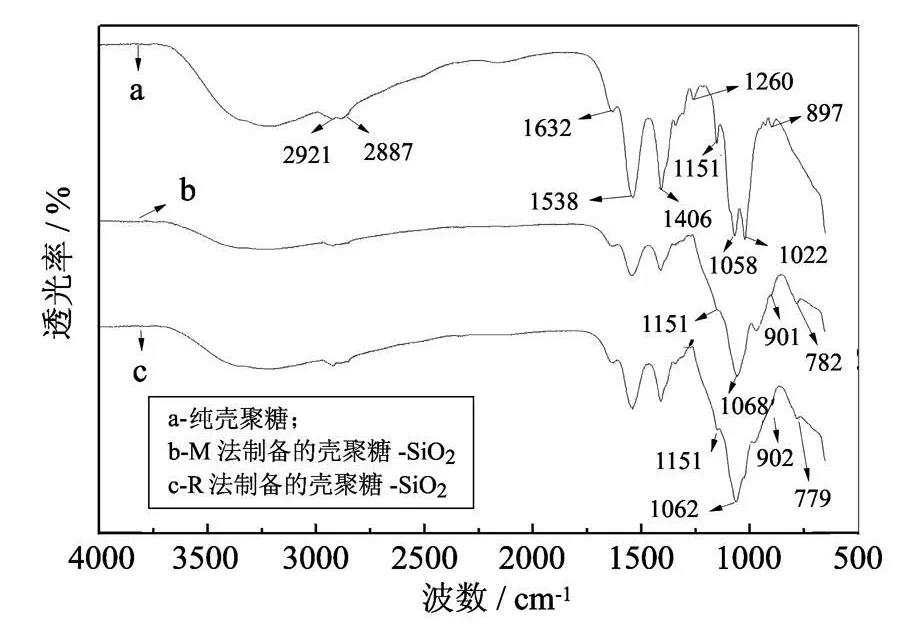
图2 壳聚糖的红外谱图Fig.2 Infrared spectrum of chitosan
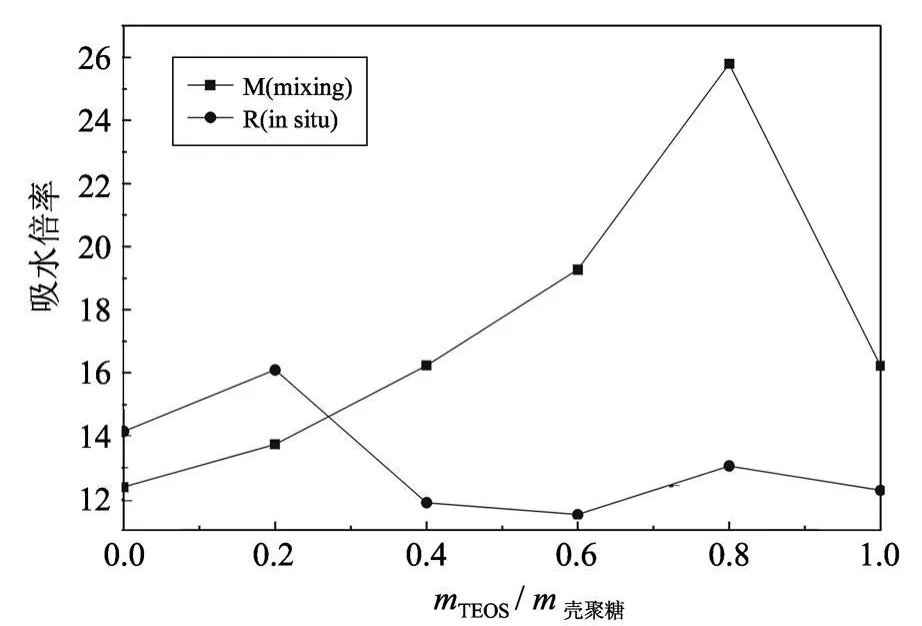
图3 吸水倍率与 mTEOS/m壳聚糖值的关系曲线Fig.3 Absorption rate vs.value of mT EOS/mchitosan
2.2 杂化膜耐水性分析
mTEOS和 m壳聚糖分别表示 TEOS和壳聚糖的质量.由图 3可见,当 mTEOS/m壳聚糖=0.8时,共混法合成的杂化膜吸水倍率达到最高(25.8),比纯壳聚糖的吸水倍率提高了 108.3%;原位杂化法合成的杂化膜的吸水倍率在 mTEOS/m壳聚糖=0.2时达到最高(16.1),比纯壳聚糖的吸水倍率提高了11.1%.说明一定量的纳米 SiO2破坏了壳聚糖原有的晶体结构[14],壳聚糖之间作用力减弱,游离出了更多的羟基和氨基,所以吸水性提高;当纳米 SiO2的量超过某一值时,壳聚糖的吸水性降低,说明壳聚糖表面的羟基和氨基大多和纳米 SiO2成键,再加上交联的网状结构,限制了壳聚糖在水中的膨胀.
当 mTEOS/m壳聚糖<0.2时,原位杂化法合成的杂化膜的耐水性较差,说明原位杂化法中壳聚糖发生降解,分子链变短,羟基变多,吸水性增强;当 mTEOS/m壳聚糖> 0.4时,与共混法相比,原位杂化法合成的杂化膜的耐水性较好,是由于原位杂化法中 SiO2足够多时,其分散均匀,粒径较小,成膜后和壳聚糖形成致密的三维网状交联结构,游离的羟基和氨基数量降低,阻止水进入杂化膜中.
2.3 杂化膜力学性能分析
从图 4中可以看出,mTEOS/m壳聚糖介于 0.2~ 1时,杂化膜的e高于纯壳聚糖,说明 SiO2与壳聚糖的分子相互作用对杂化膜能起到填料补强与增韧的作用.共混法中,随着 mTEOS/m壳聚糖的增加,杂化物膜的拉伸断裂强度先增大后减小,这是由于 TOES越多,合成的 SiO2团聚体粒径就越大,成膜过程中使得壳聚糖链交互缠绕,排列不再规整有序,导致杂化膜强度下降;当 mTEOS/m壳聚糖=0.2时,达到最大为 43.3 N/mm2,比纯壳聚糖膜36.1 N/mm2提高了 19.9%.原位杂化法中,随着mTEOS/m壳聚糖的增加,杂化物膜强度一直增大,当mTEOS/m壳聚糖= 1时,杂 化 物 膜 强 度 为46.9 N/mm2,比纯壳聚糖膜的 39.0 N/mm2提高了20.3%.
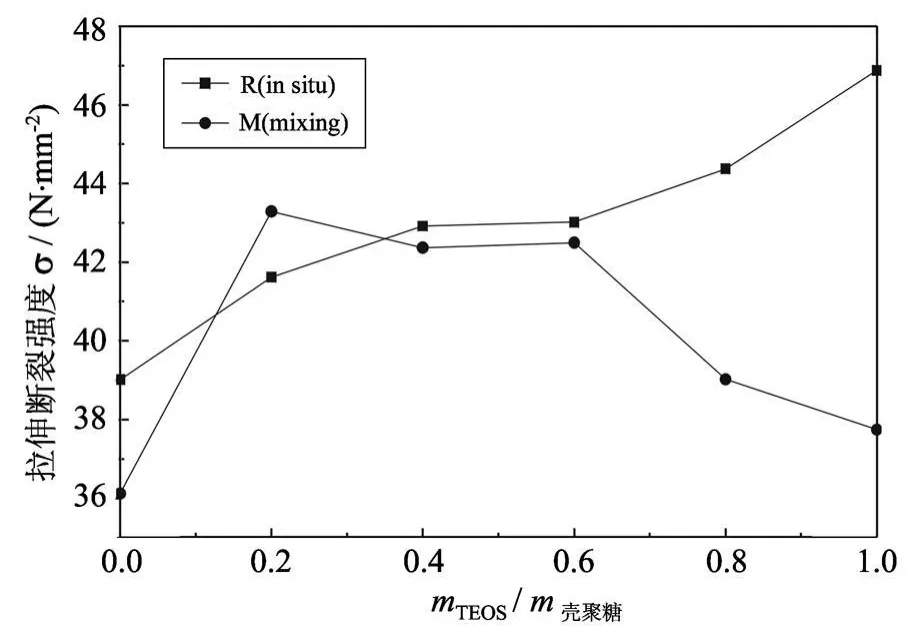
图4 拉伸断裂强度与 mT EOS/m壳聚糖值的关系Fig.4 Tensile strength vs.value of mTEOS/mchitosan
从图 5中发现,随着 mTEOS/m壳聚糖的增加,杂化物的断裂伸长率均减小,这是由于 SiO2粒子和壳聚糖形成的交联结构增加了杂化材料的刚性,断裂伸长率降低;但原位杂化法合成的杂化物断裂伸长率较高.
共混法和原位杂化法相比,原位杂化法合成的杂化物膜拉伸断裂强度和断裂伸长率均较高,这是由于原位杂化法中 SiO2的粒子较小和壳聚糖混合均匀,壳聚糖排列更加整齐紧密规整,交联的网状结构使相互间具有较大的作用力,这和上述实验结果是一致的.
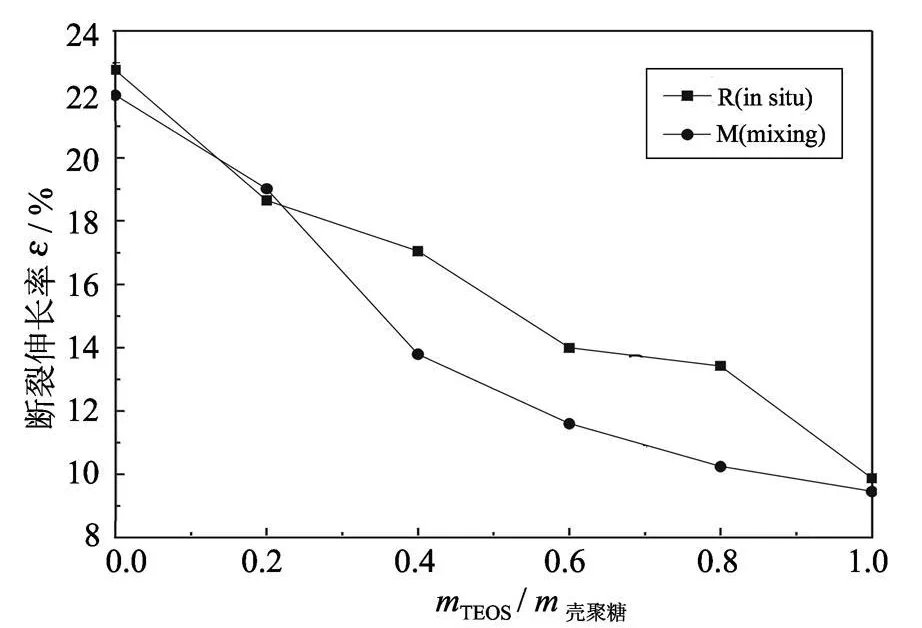
图5 断裂伸长率与 mTEOS/m壳聚糖值的关系Fig.5 Elongation vs.value of mTEOS/mchitosan
2.4 金属 Cu2+吸附分析
从图 6中可以看出,随着时间的增加,壳聚糖杂化膜对 Cu2+的吸附量有所提高,反应前 1 h反应较快,在 2~ 4 h曲线缓慢上升,一般 4 h就可以达到吸附平衡.这是由于开始阶段 Cu2+在不断振荡下,固-液界面上的扩散较为容易,吸附主要发生在杂化膜表面,吸附时间较快;随着吸附的进行,Cu2+的质量浓度逐渐减少,同时溶质逐渐向膜内部扩散,扩散主力逐渐增大,因而吸附速率变小;吸附容量在 4 h后基本接近吸附饱和.因此,实验最佳螯合时间为 4 h.
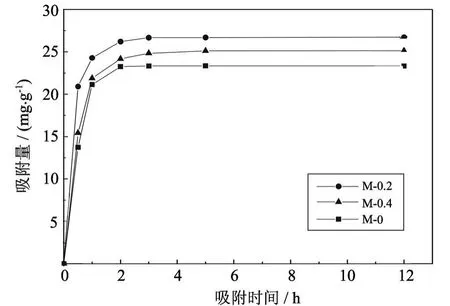
图6 壳聚糖杂化膜吸附 Cu2+曲线Fig.6 Cu2+absorption curves of chitosan hybrid materials
在图 7中,当 mTEOS/m壳聚糖<0.1时,原位杂化法合成的杂化膜吸附 Cu2+的能力较强,这是因为壳聚糖降解,表面有较多的游离氨基;当mTEOS/m壳聚糖>0.1时,共混法合成的杂化膜吸附Cu2+的能力较强,这是由于原位杂化法合成的杂化膜中 SiO2和游离氨基成键和交联的网状结构使得游离氨基更少.
共混法中,随着 SiO2含量的增加,杂化膜吸附 Cu2+的量先增加后减小,当mTEOS/m壳聚糖=0.2时,Cu2+的吸附量达到最大.Cu2+吸附量增加,这是由于共混法中纳米 SiO2粒径较大,在壳聚糖膜中分散性较差,破坏了壳聚糖的结构,有更多的-NH2露在膜的表面,络合能力增强.原位杂化法合成的杂化膜 Cu2+吸附量逐渐减少,一方面是因为杂化膜中壳聚糖量减小时,参与络合吸附的-NH2数也减少;另一方面纳米 SiO2粒径较小,均匀地分散于壳聚糖膜中形成的网状结构,和壳聚糖的作用力较强,有效地限制了壳聚糖链段的运动,表明膜上的 -NH2数目减少,故 Cu2+的吸附量减小.
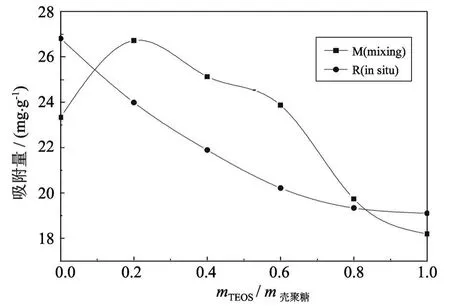
图7 Cu2+吸附量与 mTEOS/m壳聚糖值的关系Fig.7 Cu2+absorption v s.value of mTEOS/mchitosan
2.5 TGA分析
由图 8和图 9可知,共混法和原位杂化法两种方法合成壳聚糖杂化膜,对其耐热性影响较小.杂化膜的热失重(TG)主要分为 2个阶段:40~180℃左右的热失重主要为杂化膜残余水分的挥发和壳聚糖的初级降解,180℃ 以上的快速失重是壳聚糖链的降解及壳聚糖氧化降解引起的.
由图 8和图 9还可以看出,纳米 SiO2颗粒与壳聚糖形成杂化材料后,杂化膜 R-0.2在 40~180℃热失重最快,吸热最大,杂化膜中残余水分较多,说明在室温下的吸湿性最大;同时在180~350℃壳聚糖链的分解温度发生了延迟,最终热稳定性得到提高.但当纳米 SiO2含量较多时,其削弱了壳聚糖链中的分子间氢键作用力,使得杂化材料中壳聚糖链热分解温度有所降低,如杂化膜 R-0.4.杂化膜 R-1中水分挥发最小,说明由于 SiO2含量增加,形成的网状交联结构有利于提高壳聚糖在空气中的耐湿性.T G和 DTA分析结果表明,壳聚糖中引入纳米 SiO2颗粒并未改变壳聚糖的降解机理.
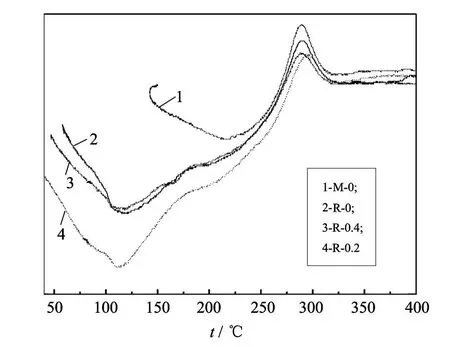
图8 杂化膜的 DT A曲线Fig.8 DTA curv es of chitosan-SiO2hybrid materials
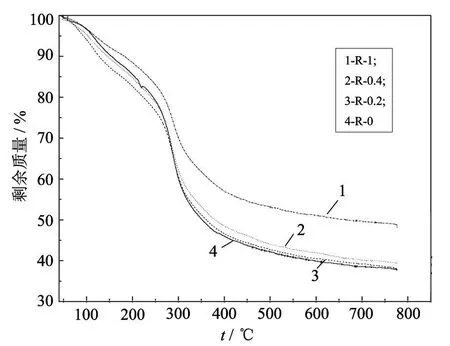
图9 杂化膜的 TG曲线Fig.9 TG curves of chitosan-SiO2hybrid materials
2.6 电镜图分析
图10(a)为纯壳聚糖的 SEM照片,可以看出纯壳聚糖形成的薄膜表面非常光滑平整.从图 10(b)中可以看出,SiO2颗粒分散在杂化膜中,没有明显的相界面,形成了均匀的表面,表明杂化材料微粒为加强化的纳米尺度的无机 SiO2微粒,与壳聚糖有强的界面作用力.
随 SiO2含量的增加,SiO2在杂化膜中有一定的团聚现象.与原位杂化法相比,共混法(图 10(d))合成的壳聚糖杂化膜中,SiO2分散不是很均匀,团聚现象严重.

图10 杂化材料的 SEM照片Fig.10 SEM photog raphs of chitosan-SiO2hybrid materials
3 结 论
1)由共混法合成的壳聚糖杂化膜,吸水倍率随着 SiO2的增加而增大,降低了膜的耐水性.与共混法相比,原位杂化法中加入 SiO2在一定程度上有利于提高杂化膜的耐水性.
2)T EOS水解生成的 SiO2对杂化膜有补强、增韧作用,膜的拉伸断裂强度高于纯壳聚糖,而断裂伸长率变小.原位杂化法合成的杂化物膜拉伸断裂强度和断裂伸长率均比共混法合成的杂化物膜高.
3)壳聚糖对 Cu2+的吸附速度比较快,一般4 h就能达到平衡.两种方法合成的杂化膜对Cu2+的吸附曲线有很大区别,随着 SiO2含量逐渐增加,原位杂化法合成的杂化膜对 Cu2+的吸附能力一直降低,但共混法合成的杂化膜对 Cu2+的吸附能力呈现先增强后逐渐降低.
4)两种工艺合成的壳聚糖膜耐热性基本相同,纳米 SiO2颗粒并未改变壳聚糖的降解机理.
[1]黄剑峰.溶胶-凝胶原理与技术[M].北京:化学工业出版社,2005:4-5.
[2]王大明.溶胶-凝胶法制备碳化硅研究进展 [J].无机盐工业,2009,41(2):6-9.Wang Daming. Progress in preparation ofsiliconcarbide ceramicmaterials by sol-gel method[J].Inorganic Chemicals Industry,2009,41(2):6-9.(in Chinese)
[3]Karatas S.Preparation and characterization of photopolymerizable organic-inorganic hybrid materials by the Sol-Gel method[J].J.Polym.Res.,2010,17:247-254.
[4]Sagheer F A,Muslim S.Thermal and mechanical properties of chitosan/SiO2hybrid composites[J].Journal of Nanomaterials,2010,2010(3):1-7.
[5]谭学才,翟海云 ,李荫,等.基于溶胶-凝胶壳聚糖 /SiO2杂化材料的安培型葡萄糖生物传感器[J].高等化学学报,2004,25(9):1645-1647.Tan Xuecai, Zhai Haiyun, Li Yin, et al.Amperomertric glucose biosensor based on Sol-Gel chitosan/silica hybrid material[J].Chemical Research in Chinese Universities,2004,25(9):1645-1647(in Chinese)
[6]Hsieh S H,Zhang F R,Li H S.Anti-ultraviolet and physical properties of woolen fabrics cured with citric acid and TiO2/chitosan[J]. Journalof Applied Polymer Science,2006,100(6):4311-4319.
[7]陈永平,廖建和.壳聚糖 /SiO2纳米杂化材料的制备[J].热带农业科学,2002,22(2):21-23.Chen Yongping,Liao Jianhe.Study on chitin /SiO2heteropolymer[J]. TropicalAgriculture Science,2002,22(2):21-23.(in Chinese)
[8]Witoon T,Chareonpanich M.Effect of acidity on the formation ofsilica-chitosan hybrid materials and thermal conductive property[J]. J. Sol-Gel Sci.Technol.,2009,51:146-152.(in Chinese)
[9]张军丽,王汉雄,曲黎,等.壳聚糖 /SiO2纳米杂化材料的研究[J].应用化工,2006,35(9):697-699.Zhang Junli,Wang Hanxiong,Qu Li,et al.Study of chitosan/nanosized SiO2hybrid materials[J].Applied ChemicalIndustry,2006,35(9):697-699.(in Chinese)
[10]朱爱萍,严忻,张灿,等.溶胶-凝胶法制备壳聚糖SiO2杂化材料 [J].高等学校化学学报,2001,22(9):2113-2116.Zhu Aiping,Yan Xin,Zhang Can,et al.Preparation of chitosan/SiO2hybrid polymer material via sol-gel process [J]. Chemical Research in Chinese Universities,2001,22(9):2113-2116.(in Chinese)
[11]Hoffmann M R,Martin S T,Choi W,et al.Environmental applications of semiconductor photocatalysis[J].Chem.Rev.,1995,95:69-74.
[12]赵丽,王萍.壳聚糖去除废水中重金属离子的研究[J].净水技术,2005,24(5):27-29.Zhao Li,Wang Ping.Study on removal of heavy metal ions in wastewater by chitosan[J].Water Purification Technology,2005,24(5):27-29.(in Chinese)
[13]李传峰 ,钟顺和.负载型 TiO2杂化陶瓷膜的制备与表征 [J].硅酸盐通报,2002(2):19-22.LiChuanfeng, Zhong Shunhe. Preparation and characterization of TiO2composite ceramic membranes[J]. Bulletin ofThechineseCeramic Society,2002(2):19-22.(in Chinese)
[14]魏铭,谭占鏊.壳聚糖 /二氧化硅纳米杂化膜的制备、结构与性能表征 [J].武汉理工大学学报,2006,28(1):157-160.Wei Ming,Tan Zhanao.The formation,structure and capability of chitosan and silicon dioxide nanocomposite films[J].Journal of Wuhan University fo Technology,2006,28(1):157-160.(in Chinese)
