有机醇胺溶液中H2S气体溶解性能评价
2012-09-09张娇静
张娇静,宋 华,白 冰,王 璐
(东北石油大学化学化工学院石油与天然气化工省重点实验室,黑龙江 大庆 163318)
有机醇胺溶液中H2S气体溶解性能评价
张娇静,宋 华,白 冰,王 璐
(东北石油大学化学化工学院石油与天然气化工省重点实验室,黑龙江 大庆 163318)
以H2S和N2的混合气为模拟天然气,采用自制的小型的气液吸收平衡装置,考察了吸收剂、吸收剂浓度、温度对有机醇胺溶液吸收性能的影响。采用Aspen Hysys和Aspen Plus两大化工工艺流程模拟软件进行模拟计算,发现实验结果与模拟计算结果相吻合。以N-甲基二乙醇胺(MDEA)作萃取剂,吸收剂浓度为2.5 mol/L,吸收剂温度为25 ℃时,吸收剂的吸收负荷为3183.5 mg/L。
有机醇胺;N-甲基二乙醇胺;H2S溶解性;性能评价;Aspen Hysys;Aspen Plus
20世纪是“石油世纪”,而21世纪,可供开采的石油越来越少,但人类对能源的依赖度却越来越高,找到一种能源替代石油迫在眉睫。天然气就是比较好的可以替代石油的清洁绿色能源。
在开采出的天然气中常含有硫化氢(H2S)等酸性含硫化合物。H2S如果进入大气环境会严重危害地球生物生存和人类的健康,各国的环保标准对H2S排放的限制也越来越严格。天然气中的H2S不仅腐蚀设备装置,毒害催化剂,致使工艺过程无法有效运行,而且导致管道穿孔泄露、仪表失灵等装置潜伏安全隐患,威胁生产操作人员的生命和国家财产。另一方面,H2S又是一种重要的硫资源,回收后的H2S可用来生产硫酸和其它硫化合物产品。因此,脱除天然气中的H2S对改善天然气质量、保护环境、减少大气污染、提高天然气的经济和社会效益都具有重要的现实意义。
目前,天然气的脱硫方法主要分为干法、膜法、生物法和湿法四大类[1-3]。湿法也称溶剂吸收法,即采用溶剂(或溶液)来吸收混合气中H2S。溶剂吸收法是一传统的气体分离方法,在分离工程领域占有极其重要的地位[4]。溶剂吸收法除了根据吸收方式可分为化学吸收和物理吸收以外,依据硫产品的最终形式还可分为氧化型工艺和再生型工艺。氧化型工艺的过程是H2S被吸收入溶液后与吸收剂发生氧化反应,H2S被氧化为单质硫,最终产品为固体硫,如ADA法、PDS法、萘醌法、铁基氧化法等。再生型工艺的过程是H2S被吸收入溶剂(或溶液)后与吸收剂发生化学反应,再生时以逆反应释放出H2S,或在高分压下物理性溶解于溶剂中(物理吸收),再在低压下释放出H2S,最终产品为H2S。由于氧化型工艺产生的硫(在液相形成硫溶胶)必须从系统中过滤出来,因此增加了溶液循环阻力,固体硫易在填料和设备中沉积,造成堵塞,只适用于H2S浓度较低的混合气净化[5]。再生型工艺适应性广,目前应用的装置数目远高于其它方法,具有明显的优势。对于再生型物理吸收,由于采用高压吸收,低压解吸过程,在能耗方面比其它方法显示较高经济性,但对于处理常压和低压气流(如尾气等)却无能为力。
作为化学溶剂的有机醇胺溶液在酸性气体净化领域已得到了广泛应用,被广泛应用的有机醇胺有MEA(一乙醇胺)、DEA(二乙醇胺)和MDEA(N-甲基二乙醇胺)等,由于吸收过程伴随化学反应,加强了气体的传质过程,在处理常压、低压气流时显示出极大的优越性,有机醇胺溶液吸收酸性气体一直是气体分离领域研究的热门课题[6]。
此外,由于烷醇胺类的反应活性好且价廉易得,在天然气脱硫工艺中居于突出地位。因此,有机醇胺作吸收剂脱除H2S定将产生良好的经济效益,具有一定的学术价值,应用前景广阔[7-8]。
Aspen Hysys是加拿大的专业化工软件公司开发的流程模拟软件,其前身是Hysim流程模拟软件,以短小、易用和功能强大而著称。它具有如下特征:①功能强大,易于使用,采用Micosoft Windows图形用户界面;②数据传输和转化方便,支持Microsoft OLE交互操作,可以方便地实现 Hysys与Microsoft Excel之间的通信,支持XML技术;③可以逐模块地分布式运行。
Aspen Plus模拟软件在市场上占有主要的份额,具有强大的物性数据系统,可以与世界上最大的热力学实验物性库DETHERM自由接口。它包含有SHBWR、LK、LKP方程、不同混合规则的SRK、PRA状态方程以及活度系数等热力学模型,所涉及的单元操作模型除化工中常用的各种基本模型外,还具有各种反应过程、固相处理模型等功能。
本文以H2S和N2的混合气为模拟天然气,选用化学吸收法中的醇胺法对天然气进行脱硫,并应用Aspen Hysys和Aspen Plus两大石油化工工艺流程模拟软件对实验数据进行模拟分析对比,考察了不同吸收剂、温度、吸收剂浓度对H2S溶解性能影响。
1 实验部分
1.1 实验原理
有机醇胺化合物即分子的烷基碳链上同时存在至少一个氨基和一个羟基的化合物。醇胺化合物分子中的氨基使醇胺的水溶液呈现碱性,是吸收酸性气体的活性基团;羟基能够增大醇胺化合物的水溶性,并与水分子形成氢键,降低有机蒸气分压[9]。
其原理如式(1)~式(3)。

上述反应为瞬时反应且为可逆反应。当温度较低、压力较高时,反应由左向右进行,几乎吸收全部H2S;当温度较高、压力较低时,反应由右向左进行,解吸其中的H2S,MDEA溶液再生[10-12]。
1.2 实验装置
1.2.1 启普发生器制H2S的实验装置
实验采用启普发生器制 H2S,见图 1。硫化亚铁与硫酸在启普发生器反应,产生H2S,进入装有无水氯化钙的干燥瓶中,脱除水蒸气后进入缓冲瓶,之后通过三通将装置内原有空气排空,H2S充入气罐内。
1.2.2 有机醇胺溶液中H2S溶解度测定装置
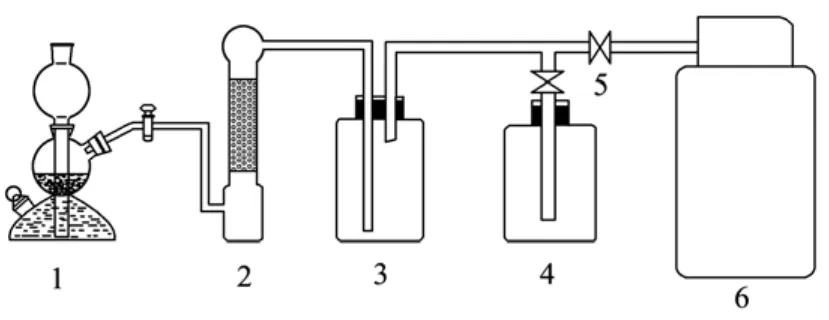
图1 启普发生器制H2S的实验装置
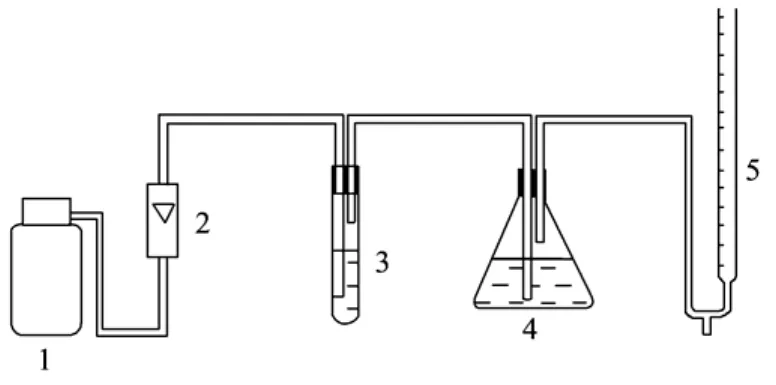
图2 有机醇胺溶液中H2S溶解度测定装置
实验采用自制的H2S溶解度测定装置,见图2。含有H2S和N2的原料气在流量计的控制下,以一定流速通过,比色管中装有同样浓度、同样体积的不同有机醇胺溶液,锥形瓶中装有一定体积的乙酸锌和乙酸镉的混合溶液,用秒表利用皂沫流量计测量气体的流速,待锥形瓶中出现黄色沉淀时停止通气。
1.3 实验方法
原料气从气罐中出来,经过减压阀减压,用浮子流量计控制气速,使原料气以一定的流速依次通过装置,当锥形瓶中的乙酸锌变成浅黄色沉淀时即可停止通气,皂沫流量计用来测量气速,用秒表记下通气时间,算出通气体积。锥形瓶中吸收液连同沉淀一起移入250 mL锥形瓶中用于碘量法测定吸收液中溶解硫化氢的量。
1.4 分析方法
首先用碘量法测定原料气中H2S的含量,原理:用ZnAc2和CdAc2的混合液吸收气原料中的H2S,生成ZnS和CdS沉淀,再加入过量的I2溶液以氧化生成的ZnS和CdS,剩余的I2用Na2S2O3标准溶液滴定[13]。主要的反应方程式如式(4)~式(9)。

2 结果与讨论
2.1 实验结果与讨论
2.1.1 吸收剂的筛选
在吸收温度为25 ℃、吸收剂浓度为2.5 mol/L、气速为20 mL/min不变条件下,用不同的吸收剂进行溶解度实验研究,考察不同吸收剂对硫化氢溶解性能的影响,实验结果见表1。

表1 不同吸收剂对H2S溶解性能的影响
从表1数据分析可知,MEA、DEA的吸收负荷较大,MDEA其次,乙二醇和水较低;但由于MDEA与MEA、DEA相比,与H2S的反应热较低,再生的能耗低,操作成本降低,同时MDEA具有极好的选择性,且化学稳定性和热稳定性好[14],所以选择MDEA作为脱除硫化氢的吸收剂。
2.1.2 吸收剂浓度的考察
以MDEA为吸收剂,在吸收温度为25 ℃、气速为20 mL/min不变条件下,改变吸收剂浓度进行溶解度实验研究,考察不同浓度吸收剂对硫化氢溶解性能的影响,实验结果见图3。

图3 不同浓度MDEA对H2S溶解性能的影响
从图3分析可知,随着MDEA浓度的增大,MDEA中溶解H2S的量也随之增大,且曲线斜率较大。当增大到2.5 mol/L后,曲线趋缓,说明MDEA浓度的增大是有一定限度的,浓度过大容易造成吸收成本增加。因此,采取2.5 mol/L MDEA吸收H2S较经济。
2.1.3 吸收温度的考察
以MDEA为吸收剂,在吸收浓度为2.5 mol/L、气速为20 mL/min不变条件下,改变吸收温度进行溶解度实验研究,考察吸收温度对硫化氢溶解性能的影响,实验结果见图4。

图4 不同温度对H2S溶解性能的影响
从图4分析可知,随着温度的增大,MDEA中溶解H2S的量随之递减,且曲线斜率较大,这是因为MDEA吸收H2S是可逆反应,当温度升高反应由右向左进行,解吸其中的H2S。MDEA在25 ℃时,溶解H2S的量最多,25 ℃接近室温,易达到,所以选择MDEA吸收H2S的吸收温度为25 ℃。
2.2 Aspen Hysys和Aspen Plus计算结果与讨论
2.2.1 吸收剂的筛选
在吸收温度为25℃、吸收剂浓度为2.5 mol/L、气速为20 mL/min不变条件下,用Aspen Hysys和Aspen Plus软件模拟计算,考察不同吸收剂对硫化氢溶解性能的影响,软件计算结果见表2。

表2 Hysys和Plus软件计算不同吸收剂对H2S溶解性能的影响
从表2数据分析可知,在所计算的吸收剂中,两个软件的计算结果均表明,MEA、DEA、MDEA吸收剂对H2S的溶解量明显高,相差两个数量级;Hysys软件计算结果表明,各吸收剂对H2S的溶解量的大小顺序为MEA> MDEA > DEA >乙二醇>水;而Plus软件计算结果表明,MEA、MDEA、DEA对H2S的溶解量均较高,相互之间差别不大。综合两个软件将计算结果,可以看出MDEA是较好的吸收剂,这与实验得出的结论相符。这是因为MDEA与MEA、DEA相比,与H2S的反应热较低,具有极好的选择性[14],且化学稳定性和热稳定性好,所以选择MDEA为吸收剂。与实验结果相比,软件计算的溶解度数据偏低,这可能是Aspen Hysys和Aspen Plus应用时受到方程参数优化和混合规则的制约,对于含H2S的天然气,方程计算精度不高造成的[15]。
2.2.2 吸收剂浓度的考察
以MDEA为吸收剂,在吸收温度为25 ℃、气速为 20 mL/min不变条件下,用 Aspen Hysys和Aspen Plus软件模拟计算,考察不同浓度吸收剂对硫化氢的溶解性能的影响,软件计算结果见图5。

图5 Hysys和Plus软件计算不同浓度MDEA对H2S溶解性能的影响
从图5分析可知,Hysys计算结果表明,随着MDEA浓度的增大,MDEA中溶解H2S的量也随之增大,且曲线斜率较大,当增大到2.5 mol/L后,曲线趋缓,说明 MDEA浓度的增大是有一定限度的;Plus计算结果表明,MDEA中溶解H2S的量随着MDEA浓度的增大而增大,且曲线斜率较大。当增大到2.5 mol/L后,随着MDEA浓度的增大H2S溶解度的增长幅度有减小的趋势。与实验结果(图3)相比可以看出,Plus软件计算结果在MDEA浓度小于2.5 mol/L时,随着MDEA浓度的增大H2S溶解均增加明显,继续增加MDEA浓度时,增长幅度有减小的趋势,这一规律与实验得出的结论相符。综上所述,实验筛选出 MDEA的最佳浓度为 2.5 mol/L是可行的。
2.2.3 吸收温度的考察
以MDEA为吸收剂,在吸收浓度为2.5 mol/L、气速为20 mL/min不变条件下,用Aspen Hysys和Aspen Plus软件模拟计算,考察吸收温度对硫化氢溶剂性能的影响,软件计算结果见图6。
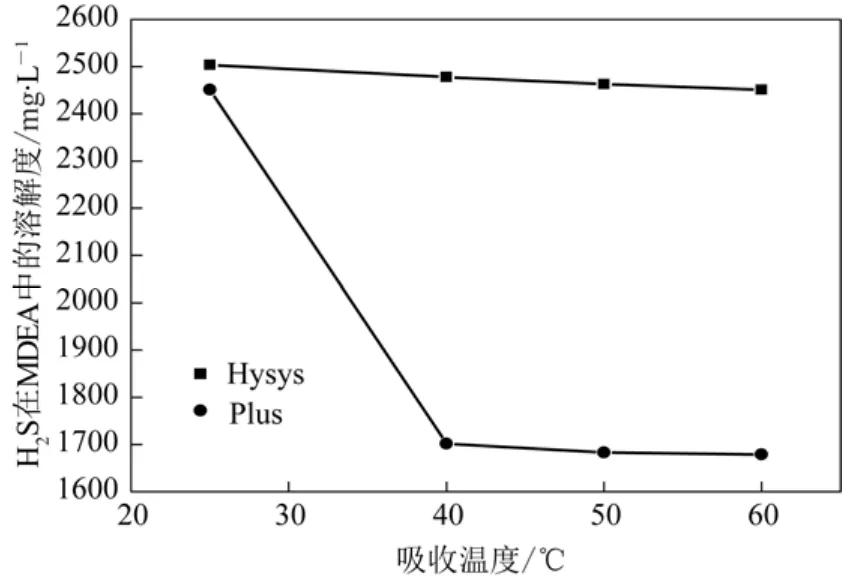
图6 Hysys和Plus软件计算不同温度对H2S溶解性能的影响
从图4数据分析可知,随着温度的增大,MDEA中溶解H2S的量随之递减,但曲线斜率较大。MDEA在25 ℃时,溶解H2S的量最多,所以MDEA吸收H2S的最佳温度为 25 ℃,这与实验得出的结论相符。同时可以看出,Plus软件的变化趋势与实验更吻合。
3 结 论
(1)在实验条件下考察了不同吸收剂、吸收剂浓度、吸收温度对硫化氢溶解性能的影响,以MDEA作萃取剂,吸收剂浓度为2.5 mol/L,吸收剂温度为25 ℃时,吸收剂的最佳吸收负荷为3183.5 mg/L。
(2)利用Aspen Hysys和Aspen Plus化工工艺流程模拟软件计算分析不同吸收剂、吸收剂浓度、吸收温度对硫化氢溶解性能的影响,模拟计算结果与实验结果相吻合,而Aspen Plus结果与实验结论更相符。
[1] 王开岳.天然气净化工艺[M].北京:石油工业出版社,2005.
[2] 王睿,石冈,魏伟胜,等.工业气体中H2S脱除方法[J].天然气工业,1999,19(3):84-90.
[3] 王青宁,李澜,俞树荣,等.凹凸棒石黏土-活性金属氧化物复合脱硫剂对脱H2S效果的影响[J].化工进展,2006,25(1):95-100.
[4] 李建新.天然气湿法脱硫工艺[J].河南化工,2008,25(9):8-11.
[5] Iliuta I,Larachi F. Concept of bifunctional redox iron-chelate process for H2S removal in pulp and paper atmospheric emissions[J].Chemical Engineering Science,2003,58:5305-5314.
[6] Maham Y,Teng T T, Hepler L G,Mather A E. Volumetric properties of aqueous solutions of monoethanolamine,mono-and dinethyethanolamines at temperatures from 5 to 80℃[J].Themochimica Acta,2002,386(22):111-118.
[7] Mandal B P,GuhaM,Biswas A K,et al. Removal of carbon dioxide by absorption amines:Modeling of absorption in aqueous MDEA/MEA and AMP/MEA solutions[J]. Chem. Eng. Sci.,2001,56:6217-6224.
[8] 韩鹏,杨大静,朱鹏,等,天然气脱硫方法的选择及醇胺法的应用[J]. 内蒙古石油化工,2007(12):177-178.
[9] Yu Wei-chung,Astarita G. Selective absorption of H2S in tertiary amine[J]. Chem. Eng. Sci.,1987,42(3):419-424.
[10] 刘小群,江宏福,姚文锐.硫化氢脱除技术研究进展[J]. 安徽化工,2004(5):33-37.
[11] 蒋文举,金燕,朱晓帆,等.活性炭材料的活化与改性[J].环境污染治理技术与设备,2002,3(12):25-27.
[12] 余彦.微生物脱硫技术在天然气净化中的应用[J].石油与天然气化工,2003,32(2):97-99.
[13] 黄韵弘.天然气中硫化氢含量的测定——碘量法影响分析结果的主要因素[J].天然气与石油,2007,25(1):23-25.
[14] 陆建刚.酸性气体(H2S,CO2)的脱除及其气液传质特性的研究[D].南京:南京理工大学,2005.
[15] 张燃.天然气脱硫装置工艺模拟及优化设计技术研究[D].成都:西南石油大学,2006.
Evaluation of dissolution of H2S in aqueous solution of organic alkanolamine
ZHANG Jiaojing,SONG Hua,BAI Bing,WANG Lu
(Provincial Key Laboratory of Oil & Gas Chemical Technology,School of Chemistry & Chemical Engineering,Northeast Petroleum University,Daqing 163318,Heilongjiang,China)
Using H2S/N2to model natural gas,the effects of absorbent and absorbent concentration and temperature on vapor-liquid equilibrium were studied on a self-made small vapor-liquid absorbent equilibrium apparatus. Two chemical process flow simulation softwares of Aspen Hysys and Aspen Plus were used in simulation of the system. Good agreement between the measured results by this work and the result of computer simulation was obtained. The absorbed burden of absorbent was 3183.5 mg/L by using N-methyldiethanolamine (MDEA) as absorbent at absorbent concentration of 2.5 mol/L and absorbent temperature of 25 ℃.
organic alkanolamine;N-methyldiethanolamine (MDEA);solubility of H2S;performance evaluation;Aspen Hysys;Aspen Plus
TQ 013.1
:A
:1000–6613(2012)07–1432–05
2012-01-15;修改稿日期:2012-03-28。
张娇静(1977—),女,博士研究生,讲师,研究方向为油田化学。E-mail zhangjiaojing@126.com。联系人:宋华,女,教授,博士生导师,从事绿色化学及催化理论的研究。E-mail songhua2004@sina.com。
