腺苷蛋氨酸预防肝癌切除术后复发疗效观察
2012-09-06卢海明卢思聪张其顺
卢海明,卢思聪,张其顺
原发性肝癌 (肝癌)是临床上最常见的恶性肿瘤之一,其发病率呈逐年升高的趋势,每年新增病例约为62.6万,居全部恶性肿瘤的第5位;每年死亡病例约为60万,居肿瘤相关死亡的第3位。我国为肝癌高发国家,当前发病人数约占全球肝癌患者总数的55%,肿瘤相关死亡率仅次于肺癌,居第2位[1]。受肿瘤大小、数量、部位等多种因素限制,适合手术治疗的肝癌患者仅占30%,且术后复发率较高,为30%~70%[2]。S-腺苷蛋氨酸 (SAMe)广泛存在于哺乳动物细胞中,主要在肝脏合成和代谢,肝硬化患者合成SAMe的功能受损[3]。研究证实,缺乏SAMe的大鼠肝脏更易受到氧化性损伤且罹患肝癌的风险增加[4];外源性SAMe对二乙基亚硝胺诱发的大鼠肝癌具有保护作用[5]。本研究旨在探讨SAMe预防肝癌切除术后复发的疗效,以期为临床预防肝癌患者术后复发提供参考。
1 资料与方法
1.1 一般资料 我院2009年8月—2010年8月收治的肝癌患者30例,符合肝癌根治性切除术指征且不愿接受化疗,采用按中心分层的区组随机化方法,借助SAS统计软件将患者分为治疗组 (15例)和对照组 (15例)。治疗组中男10例,女5例;年龄40~65岁,平均 (52.5±12.1)岁;巴塞罗那分期 (BCLC分期):A期10例,B期5例。对照组中男11例,女4例;年龄35~64岁,平均 (49.8±13.5)岁;BCLC分期:A期10例,B期5例。两组患者术前均经影像学检查证实无肝内和肝外转移,门静脉内无癌栓形成,且未接受任何放射治疗或化学治疗;均行根治性切除术,术中病理证实为肝细胞肝癌。术后病理分型:治疗组中肿瘤包膜完整者13例,不完整者2例;高分化癌6例,中分化癌6例,低分化癌3例。对照组中肿瘤包膜完整者12例,不完整者3例;高分化癌4例,中分化癌8例,低分化癌3例。
1.2 治疗方法 所有患者术后进行常规支持治疗。治疗组手术当天至术后第8天静脉滴注SAMe,1 000 mg/d;对照组手术当天至术后第8天静脉滴注还原型谷胱甘肽,1 800 mg/d;参考说明书调整药物剂量。两组患者围术期其他辅助用药基本相同,随访期间有慢性病毒性乙型肝炎的患者均在感染科进行正规抗乙肝病毒治疗,此外未使用其他特殊药物。
1.3 观察指标 每例患者分别于术前1 d和术后14 d早晨空腹采肘静脉血5 ml,检测肝功能指标,包括丙氨酸氨基转移酶(ALT)、天门冬酸氨基转移酶 (AST)及总胆红素 (TBiL);采用放射免疫法测定免疫调节功能指标,包括血清甲胎蛋白(AFP)和肝细胞生长因子 (HGF)。
1.4 随访 患者术后6个月内每1个月复诊1次,6个月~1年每3个月复诊1次,复诊内容包括临床查体、AFP水平、胸片及彩色B超,若发现异常及时行增强CT或MRI检查。两种影像学检查均确认有新肿瘤生长者定为复发。随访截止日期为2011-08-31。
1.5 统计学方法 应用SPSS 13.0软件进行统计学分析,计量资料以 (±s)表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 复发情况 两组患者均完成了1年的随访,无失访者。治疗组有2例患者复发,复发率为2/15;对照组有7例患者复发,复发率为7/15。两组复发率比较,差异有统计学意义(χ2=3.968,P <0.05)。
2.2 肝功能和免疫调节功能 两组患者术前1 d和术后14 d ALT、AST及 TBiL水平比较,差异均无统计学意义 (P>0.05)。两组患者术前1 d AFP和HGF水平比较,差异均无统计学意义 (P>0.05);术后14 d比较,差异均有统计学意义(P<0.05,见表1)。
表1 两组患者手术前后肝功能和免疫调节功能比较 (±s)Table 1 Comparison of liver function and immune regulation function between two groups before and after surgery
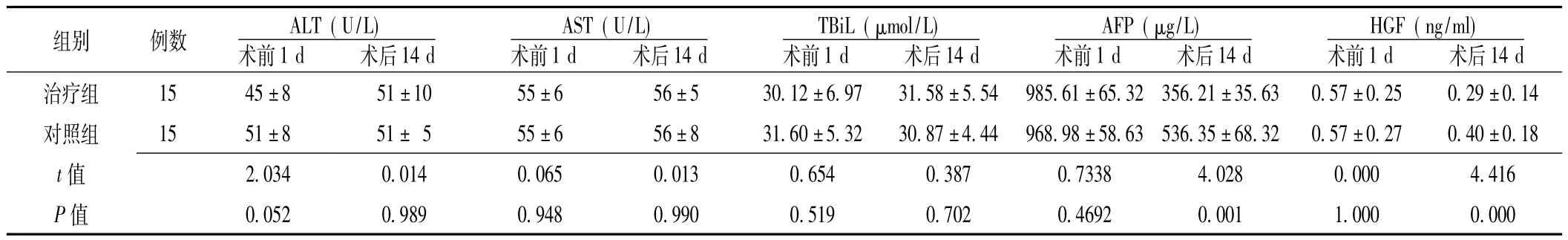
表1 两组患者手术前后肝功能和免疫调节功能比较 (±s)Table 1 Comparison of liver function and immune regulation function between two groups before and after surgery
注:ALT=丙氨酸氨基转移酶,AST=天门冬酸氨基转移酶,TBiL=总胆红素,AFP=甲胎蛋白,HGF=肝细胞生长因子
14 d治疗组 15 45±8 51±10 55±6 56±5 30.12±6.97 31.58±5.54 985.61±65.32 356.21±35.63 0.57±0.25 0.29±0组别 例数 ALT(U/L)术前1 d 术后14 d AST(U/L)术前1 d 术后14 d TBiL(μmol/L)术前1 d 术后14 d AFP(μg/L)术前1 d 术后14 d HGF(ng/ml)术前1 d 术后.14对照组 15 51±8 51± 5 55±6 56±8 31.60±5.32 30.87±4.44 968.98±58.63 536.35±68.32 0.57±0.27 0.40±0.18 t 28 0.000 4.416 P值 0.052 0.989 0.948 0.990 0.519 0.702 0.4692 0.0值2.034 0.014 0.065 0.013 0.654 0.387 0.7338 4.0 01 1.000 0.000
3 讨论
随着肝癌早期诊断、早期治疗及肝外科的进展,我国肝癌手术切除率已大为提高,手术死亡率大为降低,总体疗效显著提高。但肝癌即使获得根治性切除,5年内仍有30%~70%的患者出现转移复发,因此,如何降低肝癌切除术后复发率成为当前的研究热点。术前肝动脉化疗栓塞 (TACE)治疗,术中理化治疗,术后化疗、生物治疗、免疫治疗、基因治疗等均可在一定程度上预防和避免肝癌切除术后复发,但其费用昂贵且不良反应较重,部分患者无法接受。肝癌切除术中会对肝脏造成挤压甚至阻断肝门血流,必定会对肝功能造成一定损害,肝癌切除术后使用保肝药物是常规治疗方案。若在保肝治疗的同时达到降低肝癌复发率的目的,必将使广大肝癌术后患者受益。
SAMe是人体内重要的生理活性物质,一方面通过转甲基作用促进磷脂的生物合成,提高磷脂∶胆固醇比例,恢复Na+-K+-ATP酶活性,进而增强细胞膜流动性,促进胆酸的摄取和分泌;另一方面通过转硫基作用产生牛磺酸、谷胱甘肽,辅酶A等物质,谷胱甘肽可增强肝脏解毒能力,牛磺酸有助于胆酸溶解,减轻胆汁淤积,对各类肝炎、肝硬化、梗阻性黄疸等急慢性肝病有良好的治疗效果[3]。本研究结果显示,两组患者术前1 d及术后14 d的ALT、AST及TBiL水平无明显差异,说明两组患者术前肝功能水平基本一致,经治疗后肝功能恢复到同一水平,SAMe与常规保肝药还原型谷胱甘肽的保肝作用基本相同。Martinez-Chantar等[4]报道,SAMe除了促进肝功能恢复的作用外还能调节细胞生长及凋亡,SAMe的剂量决定着SAMe在机体内所起的生理作用。正常肝细胞中SAMe水平下降促使肝细胞有丝分裂活跃,是肝组织再生的必要因素[6]。动物实验证实,在敲除 MAT1A基因的大鼠中,SAMe的血清水平逐渐下降,随之肝细胞出现无序增殖,最终发展为肝细胞肝癌[4]。在有致肝细胞肝癌因素的大鼠模型中,中断肝细胞中SAMe水平下降可以很好地阻止肝细胞肝癌的发生[7]。推论肝癌术后患者SAMe血清水平与复发率有一定关系。张其顺等[5]动物实验证实,外源性SAMe对二乙基亚硝胺诱发大鼠肝癌有保护作用,但相关临床研究报道较少。
HGF是多向性多肽因子,具有多种生物学活性,是肝细胞强有力的有丝分裂原,肝癌患者血清HGF水平升高与肝癌的发生密切相关[8]。肝细胞中SAMe水平与细胞状态有关,静止的肝细胞中SAMe水平较高,而增生活跃的肝细胞中SAMe水平较低[9]。可能是肝细胞中SAMe水平的降低导致了HGF的过度升高,最终导致肝癌的发生。补充外源性SAMe,大鼠血清HGF水平较模型组降低,其癌变程度亦降低[5]。SAMe可能是通过抑制HGF的生成而预防肝癌发生。临床实践中以AFP作为监测肝癌术后复发的金标准之一。本研究结果显示,治疗组复发率低于对照组,差异有显著性,SAMe可降低肝癌复发率。术前1 d两组患者的AFP及HGF水平无差异;术后14 d两组AFP和HGF水平均明显降低,且治疗组降低更明显。表明两组患者术前肿瘤活动水平基本相同,经治疗可使AFP、HGF水平下降。但由于本研究纳入患者例数较少,且没有和围术期其他综合治疗患者进行比较,有待更大规模的随机对照临床试验进一步深入研究。如何降低肝癌切除术后复发率是一项任重而道远的工作,仍需不断探索和努力。
1 Jemal A,Siegel R,Xu J,et al.Cancer statistic,2010 [J].CA Cancer J Clin,2010,60(5):277 -300.
2 吴孟超,吴东.原发性肝癌综合治疗的现状与展望[J].癌症进展,2005,3(5):410-412.
3 Mato JM,Lu SC.Role of S-adenosyl-L-methionine in liver health and injury[J].Hepatology,2007,45(5):1306-1312.
4 Martinez- Chantar ML,Corrales FJ,Martinez- Cruz LA,et al.Spontaneous oxidative stress and liver tumor in mice lacking methionine adenosyltransferase 1A [J].FASEB J,2002,16(10):1292 -1294..
5 张其顺,黄世锋,卢思聪.间断给予S-腺苷蛋氨酸对二乙基亚硝胺诱发大鼠肝癌的保护作用 [J].中国全科医学,2010,13(11):3766-3768.
6 Martínez- Chantar ML,Vázquez- Chantada M,Garnacho M,et al.S-adenosylmethionine regulates cytoplasmic HuR via AMP-activated kinase[J].Gastroenterology,2006,131(1):223-232.
7 Lu SC,Ramani K,Ou X,et al.S-adenosylmethionine in the chemoprevention and treatment of hepatocellular carcinoma in a rat model[J].Hepatology,2009,50(2):462 -71.
8 Guirouilh J,Le Bail B,Boussarie L,et al.Expression of hepatocyte growth factor in human hepatocellular carcinoma [J].J Hepatol,2001,34(1):78-83.
9 Frau M,Tomasi ML,Simile MM,et al.Role of transcriptional and posttranscriptional regulation of methionine adenosyltransferases in liver cancer progression [J].Hepatology,2012,56(1):165-175.
