有机酸化剂对断奶仔猪生长性能和肠道健康的影响
2012-09-04张旭晖冀凤杰郭福存
张旭晖 王 恬* 冀凤杰 郭福存 曹 宏
(1.南京农业大学动物科技学院,南京 210095;2.诺伟司国际研发中心,北京 100085)
仔猪断奶后胃蛋白酶活性大大降低,使饲料营养物质(特别是蛋白质)消化吸收不良,造成饲料营养物质的浪费及仔猪营养性腹泻。肠道内高pH为各种有害菌提供适宜的繁殖环境,并且未被消化的蛋白质饲料在经过肠道时也给各种细菌提供了大量的营养物质,致使病原菌大量繁殖,爆发细菌性疾病。传统养殖实践一般采用抗生素预防和治疗细菌性传染病,虽然取得了一定的效果,但是不可避免的产生了诸如耐药性、药物残留等问题。鉴于抗生素使用上的种种弊端,在仔猪饲粮中添加适量的酸化剂以弥补仔猪生理性产酸不足,已逐渐成为一项重要的营养措施[1-4]。
酸化剂具有调控动物肠道微生物平衡、增殖有益菌、抑制有害菌、降低肠道pH、提高消化酶活性、提高营养物质消化率、减慢胃排空速度、提高动物抗应激和免疫力等方面的功能[1-6]。仔猪饲粮中添加有机酸化剂的研究从20世纪60年代就已开始,国内对仔猪饲粮酸化的研究起步较晚,且主要局限于添加效果的研究。关于其作用效果的报道国内外并不完全一致。原因可能和不同类型的有机酸化剂及其盐类对动物代谢的作用途径或模式存在差异有关[7]。另外,由于饲粮组成及其酸结合力、蛋白质来源、动物的生长阶段、健康状况、断奶时间、动物饲养环境条件及有机酸化剂添加水平等因素影响,使得生产实践中有机酸化剂的生产成本和经济效益差异很大。因此,对不同组合和配比的有机酸化剂的比较研究是十分必要的。本试验旨在探讨不同有机酸化剂组合对断奶仔猪的生长性能和肠道健康的影响,为其在生产实践中的应用提供参考。
1 材料与方法
1.1 试验材料
有机酸化剂A(有效成分富马酸22%、苯甲酸50%、甲酸钙14.5%、羟基蛋氨酸钙4.5%);有机酸化剂B(有效成分富马酸39.8%、苯甲酸19%、羟基蛋氨酸钙33.8%);保护型有机酸化剂C(有效成分甲酸≥22%、山梨酸≥9%、富马酸≥9%);仙人掌提取物(cactus extract,CE,其中含多糖35%、生物碱1.25%),均由诺伟司国际有限公司提供。
1.2 试验动物及饲养管理
选用“长×大”二元杂交健康仔猪540头(公母各占1/2),21日龄断奶。断奶后1~7 d为预试期,饲喂商品代乳料,至试猪28日龄,平均体重为(8.23±0.40)kg(P>0.05)时,开始为期4周的正式试验。试验仔猪采用地面饲养,半开放猪舍,自然通风。仔猪自由采食和饮水。免疫和驱虫程序按猪场常规同步进行。随时观察、记录仔猪采食和健康状况。
1.3 试验设计及饲粮
试验采用单因子随机区组试验设计,将28日龄540头试猪随机分成6个组,每个组设6个重复(公母各3个重复),每个重复15头猪。对照组饲喂基础饲粮,有机酸化剂组(I、II、III、IV和 V 组)在基础饲粮中分别添加0.3%的有机酸化剂A、有机酸化剂 B+C(2∶1)、有机酸化剂 A+C(2∶1)、有机酸化剂A+CE(2∶1)和有机酸化剂A+C+CE(2.0∶0.5∶0.5)。试验全期共 28 d,分为 3 个生长阶段,分别为前期(28~35日龄)、中期(36~42日龄)和后期(43~56日龄)。
参照NRC(1998)仔猪回肠表观可消化氨基酸模式配制玉米-豆粕型基础饲粮,其组成及营养水平见表1。试验中为预防或治疗呼吸道疾病,在基础饲粮中均添加利高霉素(含盐酸大观霉素和林可霉素,辉瑞,美国),此外,基础饲粮中均添加75 mg/kg抗氧化剂(诺伟司国际有限公司)。
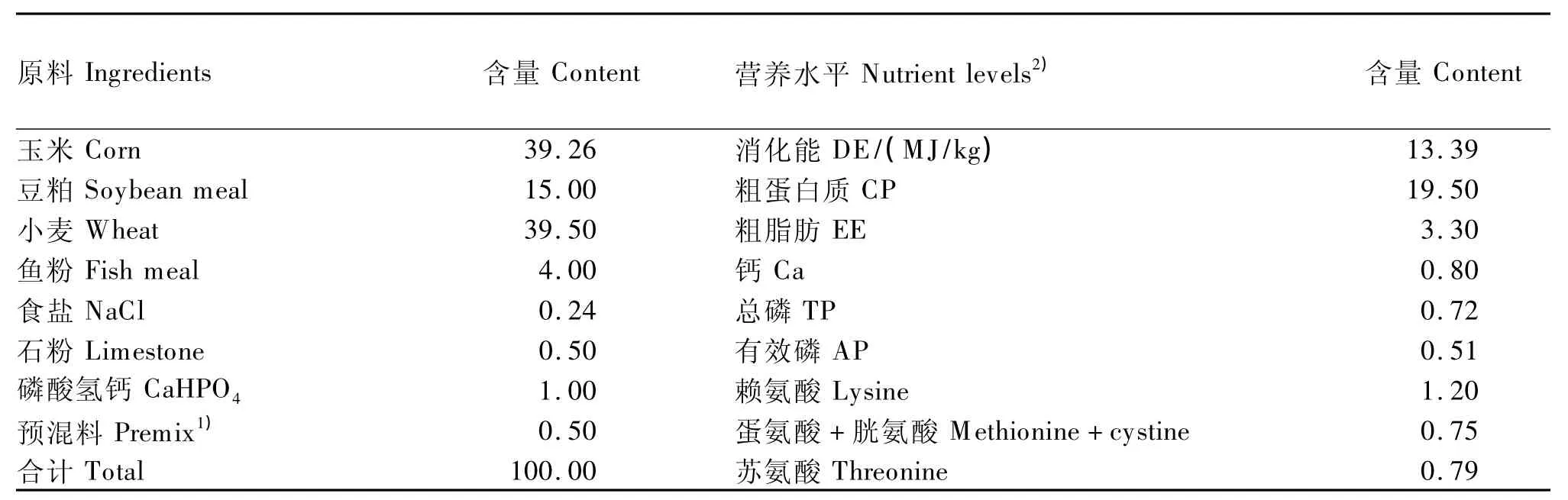
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1)预混料为每千克饲粮提供 The premix provides the following per kg of diet:Fe 100 mg,Cu 250 mg,Zn 100 mg,Mn 100 mg,I 0.3 mg,Se 0.3 mg,VA 13 500 IU,VD32 150 IU,VE 15 IU,VK 3 mg,VB11.8 mg,VB26 mg,VB324 mg,泛酸钙calcium pantothenate 20 mg,胆碱 choline 5 000 mg,生物素 biotin 4.5 mg,VB110.3 mg,VB120.024 mg,L - 赖氨酸 L-lysine 3 000 mg,DL - 蛋氨酸 DL-methionine 1 500 mg,利高霉素 lincomycin hydrochloride[前期(starter stage)40 mg,中期(middle stage)55 mg,后期(finishing stage)60 mg]。
2)营养水平为计算值。The nutrient levels are calculated values.
1.4 测定指标及方法
1.4.1 生长性能
准确记录各圈试猪的喂料量与余料量,计算每头仔猪各生长阶段及全期的平均日采食量(ADFI);试猪于每周开始及结束时,07:00以重复为单位空腹称重,记录阶段始重(IBW)和末重(FBW),计算每头仔猪各生长阶段及全期的平均日增重(ADG);根据仔猪各生长阶段及全期的ADFI和ADG计算料重比(F/G)。1.4.2 仔猪腹泻率
每天观察试猪腹泻情况,1头试猪腹泻1 d记为1次腹泻。
腹泻率(%)=[试验期内腹泻头数/(试验天数×试验头数)]×100。1.4.3 直肠粪样微生物菌群数量
采用平板涂布计数法检测直肠粪样微生物菌群数量。于试验第7、10和17天(即猪生长阶段的35、38和45日龄)早上,从每个重复中随机选取1头猪,在无菌条件下用小勺取直肠粪便样品冷冻保存。
测定时,将样品解冻,在无菌操作台内称取2 g左右粪样与灭菌稀释液配制成1∶50稀释液,振荡3~5 min,用微量移液枪准确吸取该稀释液5 mL至盛有10 mL灭菌稀释液试管中,用漩涡振荡器振荡1~2 min,制成10-1稀释液,再用微量移液枪准确吸取该稀释液1 mL至盛有9 mL灭菌稀释液试管中,用旋涡振荡器振荡1~2 min,制成10-2稀释液,依次进行 10-3~10-5稀释。
将直肠粪样的稀释液接种于相应的培养基[大肠杆菌用伊红-美蓝(EMB)培养基;乳酸杆菌用M17琼脂培养基;金色葡萄球菌采用甘露醇高盐琼脂培养基;产气荚膜杆菌采用亚硫酸盐-多粘菌素-磺胺嘧啶琼脂培养基],每种指标检测5个稀释梯度,每个梯度设2个重复。大肠杆菌37℃有氧培养16 h,乳酸杆菌和产气荚膜杆菌37℃厌氧培养36 h,金色葡萄球菌37℃需氧或兼性厌氧培养24 h。结果以lg(CFU/g)(每克肠道内容物中含菌落总数的对数)表示[2]。
1.5 数据处理
试验所得数据采用SPSS 9.0软件GLM程序进行方差分析,采用LSD和Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 不同有机酸化剂组合对断奶仔猪生长性能的影响
由表2可知,在试验前期(28~35日龄),各组间的末重、平均日采食量和平均日增重均无显著差异(P>0.05),而I和IV组的料重比显著低于对照组(P<0.05)。在试验中期(36~42日龄),各组间断奶仔猪的末重、平均日采食量、平均日增重和料重比均无显著差异(P>0.05)。在试验后期(43~56日龄),I和II组的末重显著高于对照、III、IV组(P<0.05);II组的平均日增重和平均日采食量显著高于对照、III和 IV组(P<0.05);V组的料重比最低,显著低于对照组(P<0.05)。
试验全期(28~56日龄),I和II组的平均日增重最高,分别比对照、III、IV和V组显著(P<0.05)或极显著(P<0.01)提高了13.79%、10.00%、10.00%和6.45%。I和II组的平均日采食量较高,显著(P<0.05)或极显著(P<0.01)高于其他各组;I、IV和V组的料重比最佳,分别比对照组显著(P<0.05)或极显著(P<0.01)降低了6.40%、5.23%和5.23%。
2.2 不同有机酸化剂组合对断奶仔猪腹泻率的影响
由表3可知,在28~35日龄,I、II和 III组断奶仔猪的腹泻率呈现相同趋势,显著高于对照组(P<0.05);在36~42日龄、43~56日龄和28~56日龄,I、II、III和 IV组断奶仔猪的腹泻率呈现相同趋势,显著(P<0.05)或极显著(P<0.01)高于对照组。
2.3 不同有机酸化剂组合对断奶仔猪直肠微生物菌群的影响
由表4可知,与对照组相比,35日龄时,各有机酸化剂添加组大肠杆菌数分别显著降低了10.66%、11.01%、8.78%、11.59% 和 9.72%(P<0.05);38日龄时,分别显著(P<0.05)或极显著(P<0.01)降低了18.92%、16.02%、15.25%、18.82%和11.78%;45日龄时,分别显著降低了17.97%、16.09%、14.91%、15.89% 和14.71%(P <0.05)。
乳酸杆菌数在35日龄时,I、II组分别比对照组增加了8.18%和6.68%,但差异不显著(P=0.07)。
与对照组相比,35日龄时,I和IV组的金色葡萄球菌数显著降低,且均降低了5.03%(P<0.05);38日龄时,添加有机酸化剂的5个组,金色葡萄球菌全部受到显著抑制,分别比对照组显著(P<0.05)或极显著(P<0.01)降低了14.93%、13.59%、13.71%、14.20%和9.59%;45日龄时,I、II、III和V组金色葡萄球菌数分别比对照组显著降低了10.45%、8.54%、9.17%和9.30%(P<0.05)。

表2 不同有机酸化剂组合对断奶仔猪生长性能的影响Table 2 Effects of different organic acid combination on growth performance of weaner piglets
同行数据肩标字母相同、相邻、相隔分别表示差异不显著(P>0.05),显著(P<0.05)和极显著(P<0.01)。下表同。
In the same row,the same letters on the upper right side of the data mean no significant difference(P>0.05),and the adjacent and the alternate letters mean significant difference(P<0.05 or P<0.01).The same as below.

表3 不同有机酸化剂组合对断奶仔猪腹泻率的影响Table 3 Effects of different organic acid combination on diarrhea rate of weaner piglets %
与对照组相比,35日龄时,IV组的产气荚膜杆菌数显著降低了10.38%(P<0.05);38日龄时,II、III、IV和V组产气荚膜杆菌数分别比对照组显著降低了6.74%、7.19%、7.76%和8.90%(P<0.05);45日龄时,添加有机酸化剂的5个组产气荚膜杆菌数有显著(P<0.05)或极显著(P<0.01)降低,分别比对照组降低了7.53%、9.02%、7.65%、11.07%和9.25%。
3 讨论
在养猪业中,早期断奶是提高母猪生产性能的重要途径。但是由于仔猪生理机能发育不完善,断奶会导致仔猪生长缓慢、食欲降低、消化不良、抗病力下降和腹泻等,即为断奶综合征。由于断奶仔猪消化道尚未发育完全,消化酶分泌不足[8],此外胃中产酸力不足[9],从而更加无法激活胃蛋白酶原,导致仔猪不能有效地降解消化谷物 及饼粕中的碳水化合物和蛋白质[10]。

表4 不同有机酸化剂组合对断奶仔猪直肠微生物菌群的影响Table 4 Effects of different organic acid combination on rectalmicrobial population of weaner piglets lg(CFU/g)
国内外众多研究表明,添加有机酸可以显著提高断奶仔猪的生产性能。Yi等[11]报道,在北美针对不同的仔猪饲养方案,添加0.5%的有机酸化剂B具有与抗生素(如卡巴氧)类似的生长促进效应。Li等[12]试验也表明,添加0.5%有机酸化剂B与抗生素效果类似,可以显著提高断奶仔猪的增重和饲料转化效率。本试验表明,添加0.3%有机酸化剂A及B+C组合可极显著提高平均日增重,这与前人研究结果一致。
Kirchgessner等[13]总结了一些欧洲学者的研究结果,表明在断奶仔猪开槽料中添加1% ~2%富马酸能够提高仔猪日增重、采食量、饲料转化效率和表观消化率。Giesting等[14]报道,在断奶仔猪饲粮中添加2%丙酸、富马酸或柠檬酸均能提高饲料转化效率,并且将仔猪饲粮富马酸添加量从1%提高到3%,能够线性提高仔猪平均日增重和饲料转化效率。在本试验中,各有机酸化剂添加组的料重比均有不同程度的改善。然而,有的研究结果并不一致[15-17]。有机酸应用效果的差异,可能与饲粮的缓冲能力、饲粮中有机酸添加剂量、饲料原料组成、添加剂的组合、断奶年龄和饲养阶段等有关[18-19]。
研究表明,常规玉米-豆粕型饲粮的pH约为6[20],而仔猪胃蛋白酶最适 pH 为 2.0 ~3.5,因而,直接饲喂此种饲粮会导致仔猪胃中pH升高。潜在的病原菌可以通过保护屏障进而在消化道内定植。此外,未充分酸化的胃内容物降低了饲料在小肠前段的消化率,从而使更多未消化的食糜进入肠道后段,提高了异常发酵和腹泻的风险。本试验各个阶段,0.3%有机酸化剂A、B+C、A+C、A+CE添加组的仔猪腹泻率显著或极显著低于对照组,说明腹泻情况得到显著控制。
多数学者认为饲粮酸化能有效控制仔猪消化道内有害菌群数量,降低仔猪腹泻率[1,21]。这是因为饲粮添加酸化剂降低了肠道pH,使有害微生物的适宜生存环境遭到破坏,但同时为乳酸杆菌等有益菌创造了适宜的生存繁殖环境。乳酸杆菌代谢的产物乳酸、过氧化氢也对大肠杆菌等有抑制杀灭作用。因此,酸化剂将会有助于肠道微生物菌群的结构优化,减少病原菌感染,为动物提供一个健康的肠道环境。本试验结果表明,与对照组比较,添加有机酸化剂的各组在35、38及45日龄,直肠中大肠杆菌、金色葡萄球菌和产气荚膜杆菌数量有不同程度的降低;而乳酸杆菌数量比对照组有所增加。Li等[12]研究表明,14日龄断奶仔猪饲粮中添加0.5%有机酸化剂B,粪便致病性革兰氏阴性菌大肠杆菌数下降,有益菌乳酸杆菌数增加,与本试验结果一致。肠道致病菌的减少可能会减少宿主营养素的菌群竞争,减少内源性损失,进而改善氨基酸和能量的消化和吸收[19]。这可能是仔猪生长性能得以被肠道微生物菌群改善的原因。
综合本试验的结果不难看出,合理配比的有机酸可以充分利用不同酸之间的互补协同作用,既可降低消化道pH,改善消化道生理环境,又可发挥有效的抑菌杀菌作用,改善消化道生态环境,其作用效果优于单一酸,这已被大量研究所证实[22-26]。有机酸的主要作用位点是饲料本身和胃,当有机酸到达小肠时,近中性的pH和快速吸收机制削弱了有机酸在这部分消化道的抗菌能力。有机酸化剂B+C组合采用植物来源的保护性载体脂肪,可以使其活性物质缓慢释放,并满足肠道pH的需要。Keller等[27]采用体外模拟肠道生理条件的模型,在中性pH下培养肉汤的数据表明,山梨酸具有强抗菌效果,甲酸和富马酸的效果次之。而其他有机酸,比如苹果酸、柠檬酸和乳酸对沙门氏菌和其他病原菌的效果很有限。这可以解释本试验添加有机酸化剂B+C组合获得最佳生长性能,是因为其实现了有机酸对全肠道的保护作用。然而关于有机酸化剂A+C及B+C组合的添加量,尚需更多试验验证。
4 结论
结果表明,仔猪饲粮中添加适宜的有机酸化剂及通过不同有机酸化剂之间合理配比能够改善断奶仔猪的生长发育和肠道健康,降低有害菌总数。本试验中,添加有机酸化剂A和B+C组合应用效果最好。
[1] 秦圣涛,张宏福,唐湘方,等.酸化剂主要生理功能和复合酸选配依据[J].动物营养学报,2007,19(增刊):515-520.
[2] 马鑫,马秋刚,计成,等.蛋氨酸羟基类似物和有机酸化剂对主要肠道病原菌体外抑菌效果的比较[J].动物营养学报,2008,20(2):238 -241.
[3] MROZ Z.Some developments on Dutch nutritional approaches to protect piglets against post-weaning gastro-intestinal disorders in the absence of in-feed antibiotics[J].Journal of Animal and Feed Sciences,2001,10(Suppl.1):153-167.
[4] MROZ Z.Organic acids as potential alternatives to antibiotic growth promoters for pig[J].Advances in Pork Production,2005,16:169.
[5] ROTH F X,KIRCHGESSNER M.Organic acids as feed additives for young pigs:nutritional and gastrointestinal effects[J].Animal Feed Science and Technology,1998,7(3):25 -33.
[6] KLUGE H,BROZ J,EDER K.Effect of benzoic acid on growth performance,nutrient digestibility,nitrogen balance,gastrointestinal microflora and parameters of microbial metabolism in piglets[J].Journal of Animal Physiology and Animal Nutrition,2006,90(7/8):316-324.
[7] KASPROWICZ-POTOCKA M,FRANKIEWICZ A,SELWET M,et al.Effect of salts and organic acids on metabolite production and microbial parameters of piglets’digestive tract[J].Livestock Science,2009,126:310-313.
[8] BAILEY C B,KITTS W D,WOOD A J.The development of the digestive enzyme system of the pig during its pre-weaning phase of growth.B.Intestinal lactase,sucrase and maltase[J].Canadian Journal of Agricultural Science,1956,36:51.
[9] KIDDER D E,MANNERS M J.Digestion in the pig[M].Bath:Kingston Press,1978.
[10] BURNELL T W,CROMWELL G L,STAHLY T S.Effects of dried whey and copper sulfate on the growth responses to organic acid in diets for weanling pigs[J].Journal of Animal Science,1988,66(5):1100 -1108.
[11] YI G F,HARRELL R,DIBNER J J,et al.Evaluation of 2-hydroxy-4(methylthio)butanoic acid(HMTBa)and HMTB-containing organic acid blends in different nursery pig feed programs[R].St.Louis:Novus International Inc.,2006.
[12] LI Z J,YI G F,YIN J D,et al.Effects of organic acids on growth performance,gastrointestinal pH,intestinal microbialpopulations and immune responses of weaned pigs[J].Asian-Australasian Journal of Animal Science,2008,21(2):252 -261.
[13] KIRCHGESSNER M,ROTH F X.Digestibility and balance of protein,energy and some minerals in diets for pigs supplemented with fumaric acid[J].Journal of Animal Physiology and Animal Nutrition,1980,44:239.
[14] GIESTING D W,EASTER R A.Response of starter pigs to supplementation of corn-soybean meal diets with organic acids[J].Journal of Animal Science,1985,60(5):1288 -1294.
[15] OMOGBENIGUN F O,NYACHOTI C M,SLOMINSKI B A.The effect of supplementing microbial phytase and organic acids to a corn-soybean based diet fed to early-weaned pigs[J].Journal of Animal Science,2003,81(7):1806 -1813.
[16] KIL D Y,PIAO L G,LONG H F,et al.Effects of organic or inorganic acid supplementation on growth performance,nutrient digestibility and white blood cell counts in weaning pigs[J].Asian-Australasian Journal of Animal Science,2006,19(2):252 -261.
[17] KOMMERA S K,MATEO R D,NEHER F J,et al.Phytobiotics and organic acids as potential alternatives to the use of antibiotics in nursery pig diets[J].Asian-Australasian Journal of Animal Science,2006,19(12):1784-1789.
[18] PAULICKS B R,ROTH F X,KIRCHGESSNER M.Effects of potassium diformate(FormiTMLHS)in combination with different grains and energy densities in the feed on growth performance of weaned piglets[J].Journal of Animal Physiology and Animal Nutrition,2000,84(3/4):102 -123.
[19] DIBNER J J,BUTTIN P.Use of organic acids as a model to study the impact of gut microflora on nutrition and metabolism[J].The Journal of Applied Poultry Research,2002,11:453 -463.
[20] RADCLIFFE J S,ZHANG Z,KORNEGAY E T.The effects of microbial phytase,citric acid and their interaction in a corn-soybean meal based diet for weanling pigs[J].Journal of Animal Science,1998,76(7):1880-1886.
[21] RICHARDS J D,GONG J,LANGE C F M.The gastrointestinal microbiota and its role in monogastric nutrition and health with an emphasis on pigs:current understanding,possible modulations,and new technologies for ecological studies[J].Canadian Journal of Animal Science,2005,85(4):421 -435.
[22] 候永清,梁敦素,丁斌鹰,等.早期断奶仔猪日粮中添加不同种类酸化剂的效果[J].中国畜牧杂志,1996,32(6):8 -10.
[23] TSILOYIANNIS V K,KYRIAKIS S C,VLEMMAS J,et al.The effect of organic acids on the control of porcine post weaning diarrhoea[J].Research in Veterinary Science,2001,70(3):287 -293.
[24] 林映才,陈建新,蒋宗勇,等.复合酸化剂对早期断奶仔猪生产性能、血清生化指标、肠道形态和微生物区系的影响[J].养猪,2001(1):13-16.
[25] HASSAN H M A,MOHAMED M A,YOUSSEF A W,et al.Effect of using organic acids to substitute antibiotic growth Promoters on performance and intestinal microflora of broilers[J].Asian-Australasian Journal of Animal Science,2010,23(10):1348 -1353.
[26] 李建平,单安山,宋凯.不同种类酸化剂对早期断奶仔猪生产性能和血液生化指标影响的研究[J].动物营养学报,2005,17(3):64.
[27] KELLER S,PARKER D S,BUTTIN P,et al.Organic acids in poultry diets:improving the decision-making process[C]//PERRY G C.Proceedings of the 28th poultry science symposium on avian gut function,health&disease.Bristol:World Poultry Science Association,2005.
