功能性寡糖对锦江黄牛瘤胃发酵及微生物生长效率的影响
2012-09-04戈婷婷瞿明仁黎观红钟志勇刘光斌
戈婷婷 瞿明仁 张 晖 黎观红 钟志勇 刘光斌
(江西农业大学,南昌 330045)
功能性寡糖也叫非消化性寡糖(NDOS),是指不被人和动物肠道吸收,并能促进有益菌的增殖,有益于肠道健康的一类寡糖。功能性寡糖被认为是一种具有多种功能的营养生理活性物质,由于其难以被动物体内分泌的消化酶分解,因此在畜牧业中被看作是一种很有开发潜力的绿色饲料添加剂。寡糖作为新型的饲料添加剂,是近年来国内外学者关注的热点。许多报道已表明功能性寡糖能提高猪、家禽和水产动物的生产性能[1-2],增强其免疫力[3-4],降低消化道的发病率[5-6]。对于反刍动物,功能性寡糖也能降低其胃肠疾病发生率,改善反刍动物瘤胃微生物区系[7],提高胃肠道对食糜的消化率[8],提高反刍动物的免疫功能[9]。但是目前有关功能性寡糖的研究主要集中在单胃动物上,对反刍动物的研究报道较少,在较少的关于反刍动物的研究又大都集中在对瘤胃的单个发酵参数,而没有从瘤胃微生物方面深入研究。本试验以南方的地方品种锦江黄牛为研究对象,以甘露寡糖、果寡糖和大豆寡糖为研究材料,采用体外批次培养法,探讨功能性寡糖对锦江黄牛瘤胃微生物发酵的影响,建立瘤胃微生物生长效率模型,为功能性寡糖在反刍动物生产中的应用提供理论依据和参考。
1 材料与方法
1.1 试验动物、饲粮及饲养管理
选用3头体重为(300±15)kg安装有永久性瘤胃瘘管的健康锦江黄牛,以供瘤胃液的采集。试验动物每天饲喂2次(08:00和18:00),自由饮水。基础饲粮为玉米-麦麸-稻草型,精粗比为20∶80,基础饲粮组成及营养水平见表1。试验预饲期14 d,第15天开始采集瘤胃液供体外培养。体外批次培养底物组成与瘤胃液供体牛饲粮组成完全相同。甘露寡糖购自北京奥特奇生物制品有限公司,其有效成分含量大于90%;果寡糖购自河北维尔康制药有限公司,其有效成分含量大于92%;大豆寡糖购自陕西森弗生物技术有限公司,纯度为98%。
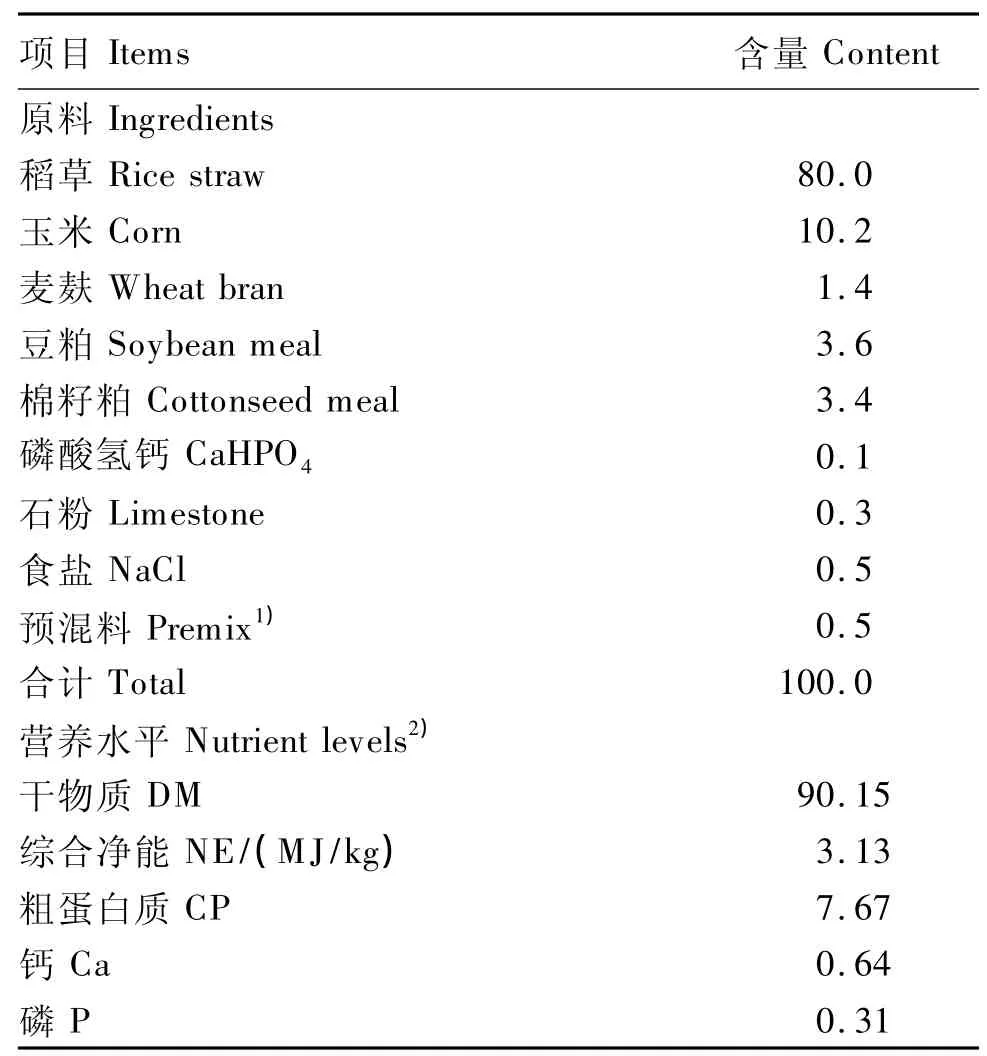
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels ofthe basal diet(air-dry basis) %
1)每千克预混料含 One kilogram of premix contained the following:VA 500 kIU,VD380 kIU,VE 2 000 IU,烟酸nicotinic acid 80 g,Cu 2 g,Fe 10 g,Mn 8 g,Zn 6 g,Se 0.02 g,I 0.1g,Co 0.02 g。
2)营养水平值为计算值。Nutrient levels were calculated values.
1.2 试验设计
试验采用体外批次培养法。体外批次培养装置参照卢德勋等[10]和程茂基[11]的方法进行。该装置主体为恒温水浴摇床,其水浴温度和震荡速率可调。培养瓶为瓶口安装有橡皮塞的150 mL奶瓶,橡皮塞上接有带三通阀的橡胶管,三通阀可打开和关闭,三通阀一端与30 mL医用玻璃注射器相连,注射器用于测定体外培养过程中的产气量。
于晨饲前由3头锦江黄牛瘤胃内上下左右(背囊、背盲囊、腹囊、腹盲囊)不同位点采集足量瘤胃液,灌入经预热达39℃并通有CO2的灭菌清洁烧杯中,烧杯置于装有39℃蒸馏水的保温瓶中,灌满后立即盖好保温瓶盖子,迅速返回实验室,经4层纱布过滤后持续通入CO2气体5 min,然后迅速分装至已预热好并装有培养底物(基础饲粮2 g)和人工培养液(20 mL)的培养瓶内,每个培养瓶加20 mL瘤胃液。接通培养瓶,打开振荡开关,开始培养。
根据培养底物中甘露寡糖、果寡糖和大豆寡糖添加水平的不同,分别设为4个组,各组功能性寡糖添加量分别为0(对照组)、0.80%、1.00%和1.20%,每组设4个重复。
1.3 样品的采集与分析
培养24 h后采集样品,立即用pH计测定pH。将培养物用纱布过滤,滤渣无损失地转移入100 mL大坩埚中,置于65℃烘箱中烘干,以测定可消化有机物质(DOM)的含量。滤液转移至100 mL大离心管中,1 500 r/min离心 15 min,去除原虫和饲料大颗粒。取10 mL离心上清液用三氯乙酸沉淀法测定菌体蛋白(BCP)浓度[12];微生物氮产量(daily microbial nitrogen production,DMNP)的计算由测得的BCP浓度除以6.25即得。
微生物生长效率(rumen microbial growth efficiency,MOEFF)=微生物氮产量/
可消化有机物质。
另取10 mL上清液,-20℃保存,以测定挥发性脂肪酸(VFA),VFA的测定采用GC-1690气相色谱仪(杭州科晓化工仪器设备有限公司)FID检验器,OV-1701型毛细管(30 m×0.32 mm×0.5 μm),2000色谱数据工作站,内标分析法,内标物为巴豆酸。采用程序升温,初温80℃,初时3.5 min,升速 30 ℃/min,终温 180 ℃,终时10 min;进样室温度260℃,检测器温度260℃;柱前压力0.05 MPa,氮气作为载气。样品进样量1 μL。
1.4 统计分析
基本数据处理采用Excel 2003,试验结果分析采用SPSS 13.0中的One-way ANOVA程序进行方差分析,多重比较用Duncan氏法,结果以“平均值±标准差”表示。
2 结果
2.1 不同功能性寡糖对锦江黄牛瘤胃微生物体外发酵参数的影响
2.1.1 不同功能性寡糖对锦江黄牛瘤胃液pH的影响
在体外培养的整个过程中,瘤胃液pH均在6.50~7.00之间,符合瘤胃微生物生长的正常范围。由表2可以看出,虽然饲粮分别添加不同水平的甘露寡糖、果寡糖和大豆寡糖对锦江黄牛瘤胃液pH有一定影响,但除了1.00%大豆寡糖组显著高于对照组(P<0.05)外,其余各组与对照组间差异均不显著(P>0.05),但添加功能性寡糖组的瘤胃液pH均普遍低于对照组。
2.1.2 不同功能性寡糖对锦江黄牛瘤胃液BCP浓度的影响
由表2可以看出,添加功能性寡糖的各组BCP浓度均高于对照组。在甘露寡糖添加组中,1.00%甘露寡糖组培养液中BCP浓度最高,达1.24 g/L,与对照组之间差异极显著(P<0.01);1.20%甘露寡糖组培养液中BCP浓度也显著高于对照组(P<0.05)。在果寡糖添加组中,1.20%果寡糖组培养液中BCP浓度显著高于对照组和0.80%果寡糖组(P<0.05)。在大豆寡糖添加组中,其结果与甘露寡糖添加组相似,1.00%大豆寡糖组培养液中BCP浓度最高,达1.26 g/L,与对照组之间差异极显著(P<0.01),1.20%大豆寡糖组培养液中BCP浓度也显著高于对照组(P<0.05)。
2.1.3 不同功能性寡糖对锦江黄牛瘤胃液VFA浓度的影响
由表2可以看出,在甘露寡糖添加组中,添加甘露寡糖组的培养液中VFA浓度均显著高于对照组培养液中VFA浓度(P<0.05)。在果寡糖添加组中,1.20%果寡糖组的培养液中VFA浓度最高,达95.97 mmol/L,与对照组间差异极显著(P<0.01);0.80%果寡糖组的培养液中VFA浓度也显著高于对照组(P<0.05);而1.00%果寡糖组的培养液中VFA浓度虽比对照组高,但差异不显著(P>0.05)。在大豆寡糖添加组中,1.00%和1.20%大豆寡糖组的培养液中VFA浓度均显著高于对照组(P<0.05)。
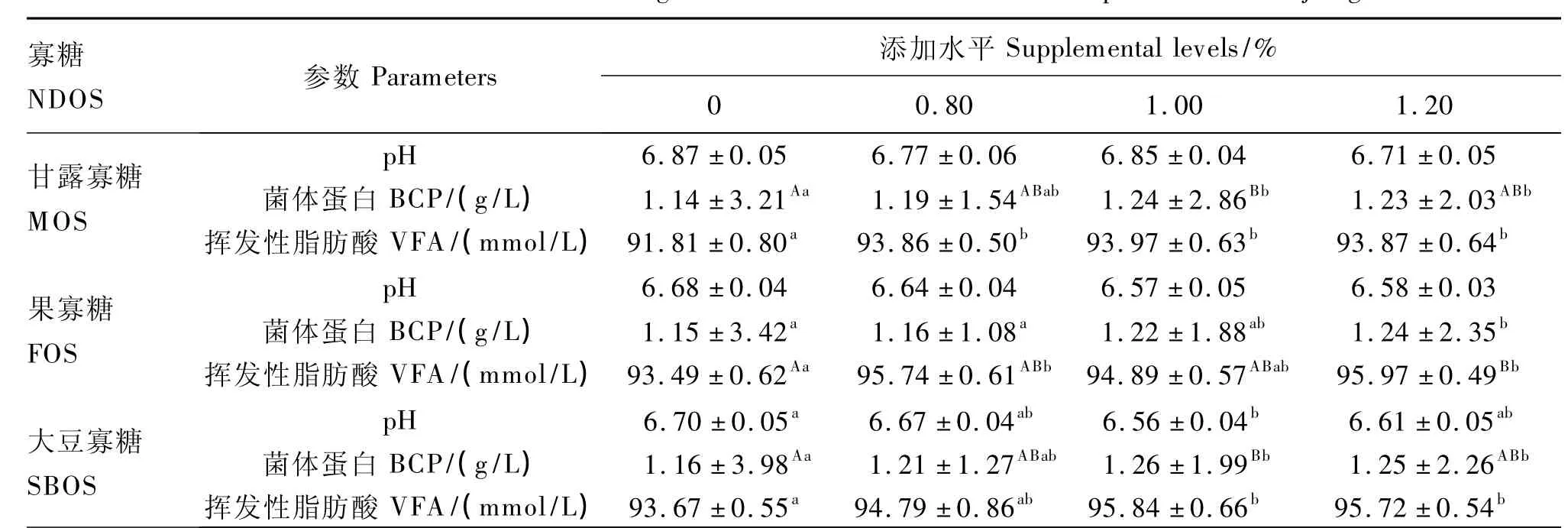
表2 不同功能性寡糖对锦江黄牛瘤胃发酵参数的影响Table 2 Effects of different functional oligosaccharides on rumen fermentation parameters of Jinjiang cattle
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row,values with different small letter superscripts mean significant difference(P<0.05),and with different capital letter superscripts mean significant difference(P<0.01),while with the same or no letter superscripts mean no significant difference(P>0.05).The same as below.
2.2 不同水平的功能性寡糖对锦江黄牛瘤胃微生物生长效率的影响
由表3可以看出,甘露寡糖和大豆寡糖对锦江黄牛瘤胃微生物氮产量和微生物生长效率的影响差异均不显著(P>0.05),但有提高的趋势;而饲粮中添加果寡糖显著提高了锦江黄牛瘤胃微生物生长效率(P<0.05),并呈现线性关系。根据功能性寡糖添加水平与微生物生长效率建立二次曲线模型,当甘露寡糖添加水平为1.17%时,微生物生长效率最大,为59.72 g/kg;当大豆寡糖添加水平为1.03%时,微生物生长效率最大,为59.50 g/kg。

表3 不同功能性寡糖对锦江黄牛瘤胃微生物氮产量和微生物生长效率的影响Table 3 Effects of different functional oligosaccharides on rumen microbial nitrogenproduction and microbial growth efficiency of Jinjiang cattle
3 讨论
国内外大量研究表明,功能性寡糖是一种具有多种功能的营养生理活性物质,具有促进有益菌的增殖的作用。在本试验条件下,饲粮中添加甘露寡糖、果寡糖及大豆寡糖,锦江黄牛瘤胃液pH均在6.5~6.8的正常范围内,这与 Roberfroid[14]和 Santoso 等[15]的报道一致;适宜的瘤胃液pH是瘤胃微生物正常活动必需的,过酸或过碱都不利于微生物发酵,甚至可能导致微生物死亡,本试验说明功能性寡糖具有维持瘤胃内环境稳定作用。
本试验条件下,饲粮中添加甘露寡糖、果寡糖及大豆寡糖均提高了锦江黄牛瘤胃液中BCP和VFA的浓度。这可能是由于功能性寡糖促进了锦江黄牛瘤胃微生物的生长,使微生物数量增多,而大量的微生物降解有机物产生更多的氨态氮(NH3-N)、VFA 和腺嘌呤核苷三磷酸(ATP),同时微生物利用这部分氮源和碳源物质合成更多的BCP。王新峰等[16]研究发现,异麦芽寡糖和果寡糖能改变断奶羔羊瘤胃菌群结构,果寡糖能明显提高瘤胃总菌、黄化瘤胃球菌及琥珀酸丝状杆菌的数量。Fukuya等[17]报道在仔猪饲粮中添加0.25%的果寡糖,可使仔猪粪便中的双歧杆菌和乳酸杆菌浓度均升高。Zdunczyk等[18]也报道甘露寡糖能抑制动物肠道中大肠杆菌、沙门氏菌等有害菌的生长。Franklin等[19]报道,甘露寡糖可以促进干奶期母牛肠道有益菌(乳酸杆菌、双歧杆菌)的生长与繁殖,抑制或减少其致病菌(如沙门氏菌)的生长,从而提高干奶期母牛的特异性免疫反应。凌宝明等[20]的体外批次培养试验表明,饲粮添加适量的异麦芽寡糖和果寡糖时,均可以显著提高生长绵羊瘤胃液中VFA浓度。刘光斌等[21]的体外培养试验报道,在绵羊饲粮中添加不同水平的大豆寡糖能增加绵羊瘤胃液总VFA和丙酸浓度,有利于瘤胃发酵的调控。Zdunczyk等[18]报道甘露寡糖能使火鸡肠道中丙酸、丁酸等VFA浓度明显增加。而 Mwenya等[22]的试验结果却是,饲粮添加异麦芽寡糖对绵羊瘤胃丙酸和其他的VFA浓度均不影响。Santoso等[23]研究表明,在奶牛饲粮中添加2%的异麦芽寡糖,可增加丙酸在总VFA中的摩尔比,但差异不显著。这些研究结果与本试验相似,说明功能性寡糖具有改善锦江黄牛瘤胃发酵功能的作用。
关于添加寡糖对瘤胃微生物生长效率影响,目前尚未见研究报道,本试验发现,饲粮中添加甘露寡糖、果寡糖和大豆寡糖,提高了锦江黄牛瘤胃微生物氮产量和生长效率,其中以果寡糖的作用最为显著,并呈现线性关系。添加甘露寡糖和大豆寡糖的瘤胃微生物生长效率随着添加量的增加而呈增大趋势,添加量达到一定程度后会逐渐降低,而添加果寡糖随着添加量的增加而呈线性增大趋势,没有达到最大值,这可能是由于本试验测得寡糖添加水平梯度太少而引起的试验误差。从瘤胃微生物生长效率来看,饲粮添加甘露寡糖和大豆寡糖最大的微生物生长效率所对应的添加水平为1.00%~1.20%。
4 结论
饲粮添加功能性寡糖能够稳定锦江黄牛瘤胃内环境,促进瘤胃发酵功能,提高锦江黄牛瘤胃液VFA和BCP浓度,提高锦江黄牛瘤胃微生物氮产量和微生物生长效率。综合所有的指标,得出本试验功能性寡糖的添加水平在1.00%~1.20%之间有利于锦江黄牛瘤胃微生物的生长。
[1] LI X J,PIAO X S,KIM S W,et al.Effects of chitooligosaccharide supplementation on performance,nutrient digestibility,and serum composition in broiler chickens[J].Poultry Science,2007,86:1107 - 1114.
[2] LIU P,PIAO X S,KIM S W,et al.Effects of chito-oligosaccharide supplementation on the growth performance,nutrient digestibility, intestinal morphology,and fecal shedding of Escherichia coli and Lactobacillus in weaning pigs[J].Journal of Animal Science,2008,86:2609 -2618.
[3] SOHAIL M,IGAZ A,YOUSAF M,et al.Alleviation of cyclic heat stress in broilers by dietary supplementation ofmannan-oligosaccharideand Lactobacillusbased probiotic:dynamics of cortisol,thyroid hormones,cholesterol,C-reactive protein,and humoral immunity[J].Poultry Science,2010,89:1934 -1938.
[4] BAURHOO B,PHILLIP L,RUIZ F.Effects of purified lignin and mannan oligosaccharides on intestinal integrity and microbial populations in the ceca and litter of broiler chickens[J].Poultry Science,2007,86:1070-1078.
[5] JUNG S,HOUDE R,BAURHOO B,et al.Effects of galacto-oligosaccharides and a bifidobacteria lactisbased probiotic strain on the growth performance and fecal microflora of broiler chickens[J].Poultry Science,2008,87:1694 -1699.
[6] DIMITROULOU A,MERRIFIELD D,MOATE R,et al.Dietary mannan oligosaccharide supplementation modulates intestinal microbial ecology and improves gut morphology ofrainbow trout,Oncorhynchus mykiss(Walbaum) [J].Journal of Animal Science,2009,87:3226 -3234.
[7] 张学峰,瞿明仁,王立阁,等.大豆寡糖对瘤胃微生物区系的影响[J].动物营养学报,2008,20(3):355-359.
[8] 刘兵,瞿明仁,张学峰,等.瘤胃灌注大豆寡糖对绵羊消化道内营养物质流通与消化的影响[J].畜牧兽医学报,2008,39(7):915 -922.
[9] 瞿明仁,刘兵,张学峰,等.消化道不同部位灌注大豆寡糖对绵羊几个免疫指标影响[J].动物营养学报,2007,19(6):678 -683.
[10] 卢德勋,谢崇文.现代反刍动物营养研究方法和技术[M].北京:农业出版社,1991.
[11] 程茂基.绵羊瘤胃内寡肽的产生、降解、吸收、流通与微生物摄取规律的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2000.
[12] 王放.瘤胃细菌和原虫蛋白测定方法初步研究[J].中国畜牧杂志,1990,26(2):43 -44.
[13] NOCEK J E.Feeding sequence and strmegy effects on ruminal environment and production perfoemance in first lactation cows[J].Journal of Dairy Science,1992,75(11):3100 -3108.
[14] ROBERFROID M B.Chicory fructo-oligosaccharides and the gastrointestinal tract[J].Nutrition,2000,16:677-679.
[15] SANTOSO B,KUME S,NONAKA K,et al.Influence of β 1-4 galactooligosaccharides supplementation on nitrogen utilization,rumen fermentation,and microbial nitrogen supply in dairy cows fed silage[J].Asian-Australian Journal of Animal Sciences,2003,16(8):1137-1142.
[16] 王新峰,冷青文,李志远,等.低聚糖对断奶羔羊瘤胃菌群的影响[J].动物营养学报,2010,22(5):1396-1401.
[17] FUKUYA T,OCHIDA Y.Use of neosugar in piglet in proceeding[M]//The 3rd Neosugar Conference in Japan.Tokyo:[s.n.],1988:145 -152.
[18] ZDUNCZYK Z,JUKIEWICZ J,JANKOWSKI J,et al.Performance and caecal adaptation of turkeys to diets without or with antibiotic and with different levels of mannan-oligosaccharide[J].Rchives of Animal Nutrition,2004,58(5):3767 -3786.
[19] FRANKLIN S T,NEWMAN M C,NEWMAN K E,et al.Immune parameters of dry cows fed mannan oligosaccharide and subsequent transfer of immunity to calves[J].Journal of dairy science,2005,88(2):766-775.
[20] 凌宝明,瞿明仁,卢德勋,等.利用体外法研究功能性寡糖对生长绵羊瘤胃发酵特性的影响[J].动物营养学报,2007,19(2):129 -134.
[21] 刘光斌,刘兵,张雪峰,等.不同大豆寡糖对生长绵羊瘤胃发酵的影响[J].江西农业大学学报,2007,12(6):871-875.
[22] MWENYA B,SAR C,SANTOSO B,et al.Comparing the effects of β 1-4 galacto-oligosaccharides and L-cysteine to monensin on energy and nitrogen utilization in steers fed a very high concentrate diet[J].Technology of Animal Feed Sciences,2005,118:19 -30.
[23] SANTOSO B,KUME S,NONAKA K,et al.Methane emission,nutrient digestibility,energy metabolism and blood metabolites in dairy cows fed silages with and without galacto-oligosaccha-rides supplementation[J].Asian-Australian Journal of Animal Sciences,2003,16:534-540.
