不同处理凤仙花对瘤胃微生物体外产甲烷及发酵特性的影响
2012-09-04张志红黄江丽田晓娟张国华王东升印遇龙丁建南
张志红 黄江丽 田晓娟 黄 黄 张国华 王东升 印遇龙 丁建南*
(1.江西省科学院生物资源研究所,南昌 330029;2.中国科学院亚热带农业生态研究所,长沙 410125)
随着全球气候变暖形势的日益严峻,人们越来越关注温室气体的排放问题。甲烷(CH4)作为重要的温室气体之一,其温室效应是二氧化碳(CO2)的20~30倍。畜牧业对全球温室效应的贡献率为9% ~18%,而反刍动物排放的CH4约占其中的80%[1]。反刍动物瘤胃内生成的CH4不仅加剧了温室效应,同时也降低了饲料利用率,造成2% ~15%饲料总能的损失[2]。因此,研究降低瘤胃CH4排放的措施和新型添加剂已成为目前研究的热点之一。研究表明,抗生素、离子型载体等物质能有效改善瘤胃发酵,降低CH4产量[3]。但此类物质长期使用会导致微生物产生耐药性和药物残留,同时影响动物产品的品质,给动物或人类健康带来威胁。研究发现,一些植物提取物具有调节瘤胃微生物发酵,减少 CH4释放的效果[4-6]。因此,大力发掘植物提取物亦成为瘤胃CH4减排研究的热点[7-8]。凤仙花(Impatiens balsamina L.)是凤仙花科凤仙花属植物,为一年生草本植物,主要分布于热带地区及亚热带地区,在中国主要产于西南地区[9]。本课题组在筛选降CH4药用植物时发现,与青蒿、蒲公英等植物比较,凤仙花具有显著的降CH4效果[10]。目前国内外很少有关于凤仙花降低瘤胃CH4生成的报道,本试验采用体外厌氧培养技术,旨在通过研究不同处理凤仙花对瘤胃微生物CH4产生和发酵特性的影响,并通过对 CH4、氨态氮(NH3-N)以及微生物蛋白质(MCP)等特征指标的分析,初步评价凤仙花能否作为反刍动物降CH4植物。
1 材料与方法
1.1 试验材料
1.1.1 植物材料与人工饲料
凤仙花为江西省科学院生物资源研究所植物遗传育种研究室栽培,开花后期整株采收,全株风干后粉碎过1 mm筛成为固体粉剂。固体粉剂在50℃下分别在70%乙醇和蒸馏水中浸泡48 h,料液比为1∶4,浸泡之后用超声波提取,超声波频率为20 000 Hz,提取温度为50℃。通过抽滤得到粗提液,在60℃左右将粗提液浓缩到总体积的1/5,即为凤仙花水或乙醇浸提液。人工饲料选用稻草、玉米和黄豆,粉碎过1 mm筛备用。
1.1.2 瘤胃液
瘤胃液取自装有永久性瘤胃瘘管的黄牛,试验动物每天饲喂2次,饲喂时间为07:00和17:00,自由饮水。晨饲2 h后采集瘤胃瘘管中新鲜瘤胃液,迅速装入充有氮气的自封袋中,并用39℃保温瓶带回实验室。将采集的瘤胃液用4层脱脂纱布在大烧杯中过滤,过滤时在厌氧袋中操作,减少微生物与空气接触机会。量取所需体积的瘤胃液迅速加入到准备好的人工唾液中(瘤胃液与人工唾液体积比为1∶2),制成混合人工瘤胃培养液,培养液在开始前新鲜配制。人工唾液的配制参照Menke等[11]的方法。
1.1.3 瘤胃体外培养装置
本研究使用的瘤胃体外培养装置是在王全军等[12]所用培养体系的基础上改造而成,装置由2部分组成,即培养瓶和50 mL全玻璃注射器(浙江宁波和平注射器厂)。培养瓶中放入培养液和人工饲料后,瓶口用反口胶塞和铝盖密封。在胶塞和铝盖上插入注射器,注射器接触的地方用密封带密封,同时注射器外围再用医用胶布固定。注射器每次使用之前洗净晾干,用凡士林涂沫注射器,减少注射器内腔和塞之间摩擦。
1.2 试验方法
1.2.1 试验设计
试验设10个处理,即对照(无任何添加剂,CK);3个水平的凤仙花水浸提液,添加量分别是培养液装量的0.5%、1.0%和2.5%(W1、W2和W3);3个水平的凤仙花乙醇浸提液,添加量分别是培养液装量的0.5%、1.0%和2.5%(E1、E2和E3);3个水平的凤仙花固体粉剂,添加量分别是培养液装量的0.5%、1.0%和2.5%(S1、S2和S3)。每个处理设7个平行,每个培养瓶为1个平行,试验连续重复3个批次。
1.2.2 体外培养试验操作
分别称取稻草粉、玉米粉和黄豆粉0.90、0.45和0.15 g,组成体外培养所用人工饲料。将人工饲料送入250 mL培养瓶内,加入不同处理凤仙花制剂。在厌氧操作袋中打开培养瓶,分别向每个瓶中加入人工瘤胃培养液200 mL,与人工饲料混合均匀。迅速盖上胶塞和铝盖,用注射针头导入氮气,驱除瓶中空气,确保培养瓶内为厌氧环境,插上注射器(标注1 mL刻度)。将培养瓶放入(39.0±0.5)℃恒温培养箱中发酵培养24 h。12、18和24 h记录注射器读数,放空注射器再插回培养瓶。各个处理的注射器读数与校正对照(只有培养液没有饲料底物)比较后,转换成产气量。公式为:产气量=Vt-Vi,其中Vt为各处理发酵t小时的注射器读数,Vi为校正对照发酵t小时的注射器读数。发酵至终点后迅速测定瓶中CH4和CO2含量,收集各处理发酵液,测定pH、NH3-N和MCP含量。
1.2.3 测定方法
CO2和 CH4含量的测定:CO2含量用 GASBOARD沼气分析仪(武汉四方光电科技有限公司)测定;CH4含量用岛津气相色谱仪器测定:采用 HP-INNOWAX(19091N -133)毛细管柱,测定条件为柱温80℃、气化室温度100℃、检测室温度120℃,载气使用高纯氮气。用10 μL微量注射器分别抽取 1.0、2.0、3.0、4.0、5.0、6.0 μL CH4标准气,根据CH4含量和其峰面积关系,确定CH4标准曲线,具体条件参照胡伟莲等[13]的方法。
发酵液参数测定:发酵液pH用梅特勒-托利多酸度计直接测定;NH3-N含量测定采用水杨酸钠-次氯酸钠比色法,具体过程参照冯宗慈等[14]的方法;MCP含量测定参照 Makkar等[15]分步离心法进行样品的预处理,采用考马斯亮蓝(G250)比色法进行测定。
1.3 统计分析
数据采用Excel 2003软件进行记录整理,统计分析采用SAS V8软件的Turkey法进行多重比较,以P<0.05作为差异显著性判断标准,试验结果用平均值±标准误表示。
2 结果
2.1 不同处理凤仙花对体外瘤胃发酵产气量的影响
从表1看出,不同处理的凤仙花体外培养瘤胃产气量不同。比较12 h产气量,CK产气量最低,S3比CK产气量提高了86.7%(P<0.05),且显著高于其他凤仙花处理(P<0.05)。18 h产气量中,CK也是最低,S1、S2和S3均显著高于其他处理(P<0.05)。24 h产气量中,CK依然最低,S1、S2、S3和 E3显著高于其他处理(P <0.05)。比较24 h累积产气量,固体粉剂处理均显著高于CK(P<0.05),平均为96.02 mL,比 CK提高了56.8%;E2和E3显著高于 CK(P<0.05),乙醇浸提液处理累积产气量平均为76.37 mL,比CK提高了24.7%;水浸提液仅W3累积产气量显著高于CK(P<0.05),3个处理平均为69.90 mL,比CK提高了14.1%。凤仙花不同处理中,添加量和产气量之间也表现出一定关系,添加量低,产气量低,添加量高时,产气量也相应提高。
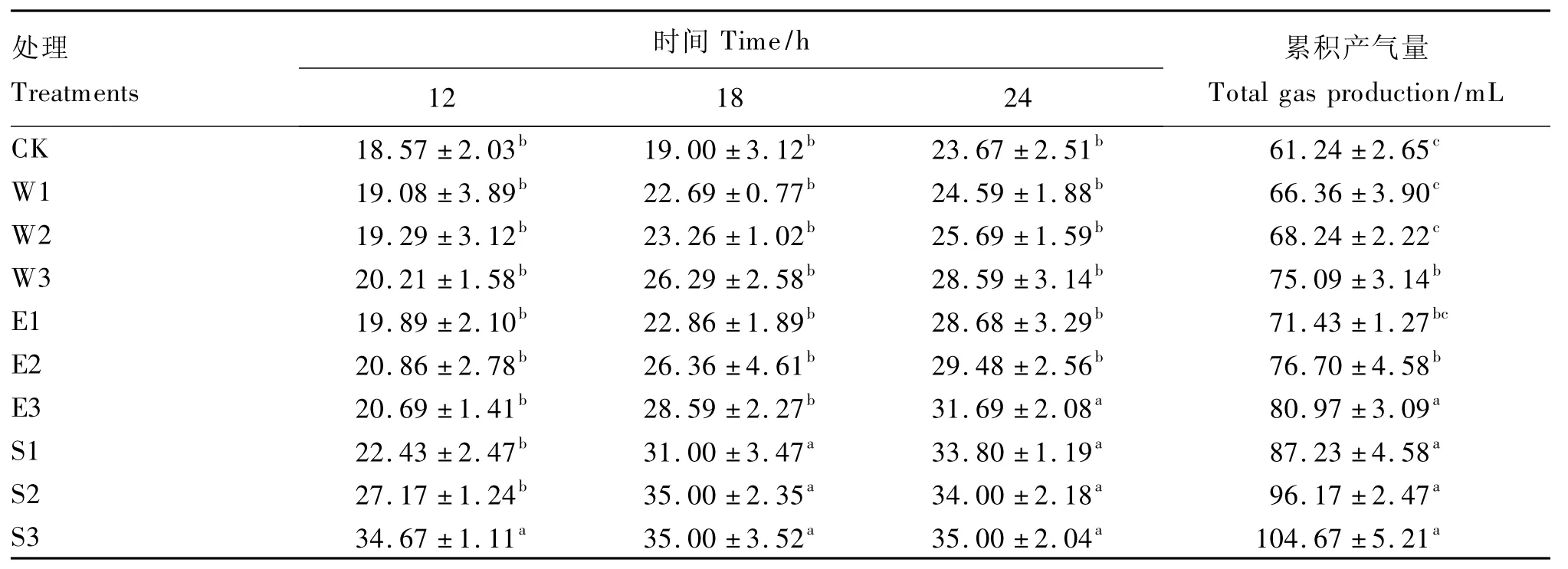
表1 不同处理凤仙花对体外瘤胃发酵产气量的影响Table 1 Effects of different preparations of Impatiens balsamina on gas production in vitro rumen fermentation
同列数据肩标不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。下表同。
In the same column,values with different small letter superscripts mean significant difference(P<0.05),while with the same letter superscripts mean no significant difference(P>0.05).The same as below.
2.2 不同处理凤仙花对体外瘤胃发酵CH4、CO2含量和pH的影响
不同处理凤仙花对体外培养CH4、CO2含量以及pH的影响见表2,CK CH4含量最高,而S3为0,完全抑制了CH4生成;S1、S2和E3 CH4含量小于1%,W1和W2与CK比较,没有显著差异(P>0.05)。比较凤仙花不同添加量对CH4含量的影响可以发现,随着添加量增加,CH4含量越来越低。CO2含量变化与CH4相反,在所有处理中,CK最低,S3最高,S3比CK提高了88.5%(P<0.05)。凤仙花3种添加方式中,固体粉剂对CO2含量提高最明显,平均比CK提高了64.9%,其次是乙醇浸提液,平均比CK提高了36.1%,水浸提液效果较差,平均比CK提高了11.2%。随着添加量的增加,CO2含量提高十分明显。pH变化趋势与CH4相同,CK最高,S3最低,并且差异显著(P<0.05)。凤仙花不同处理中,固体粉剂降低pH最明显。
2.3 不同处理凤仙花对体外瘤胃发酵NH3-N含量的影响
NH3-N是瘤胃微生物发酵一个重要参数,反映了瘤胃代谢状态。不同处理凤仙花对NH3-N含量的影响见表3,CK最高,S3最低,差异显著(P<0.05)。NH3-N含量整体变化趋势与CH4相似,添加量相同时,凤仙花固体粉剂降低最明显。随着添加量的增加,NH3-N含量降低越明显,S1、S2和S3分别比CK降低了41.1%(P<0.05)、52.2%(P <0.05)和 55.4%(P <0.05),E1、E2和E3分别比CK降低了12.8%(P>0.05)、29.7%(P <0.05)和 48.2%(P <0.05),W1、W2和W3分别比CK降低了5.9%(P>0.05)、6.2%(P>0.05)和42.9%(P<0.05)。
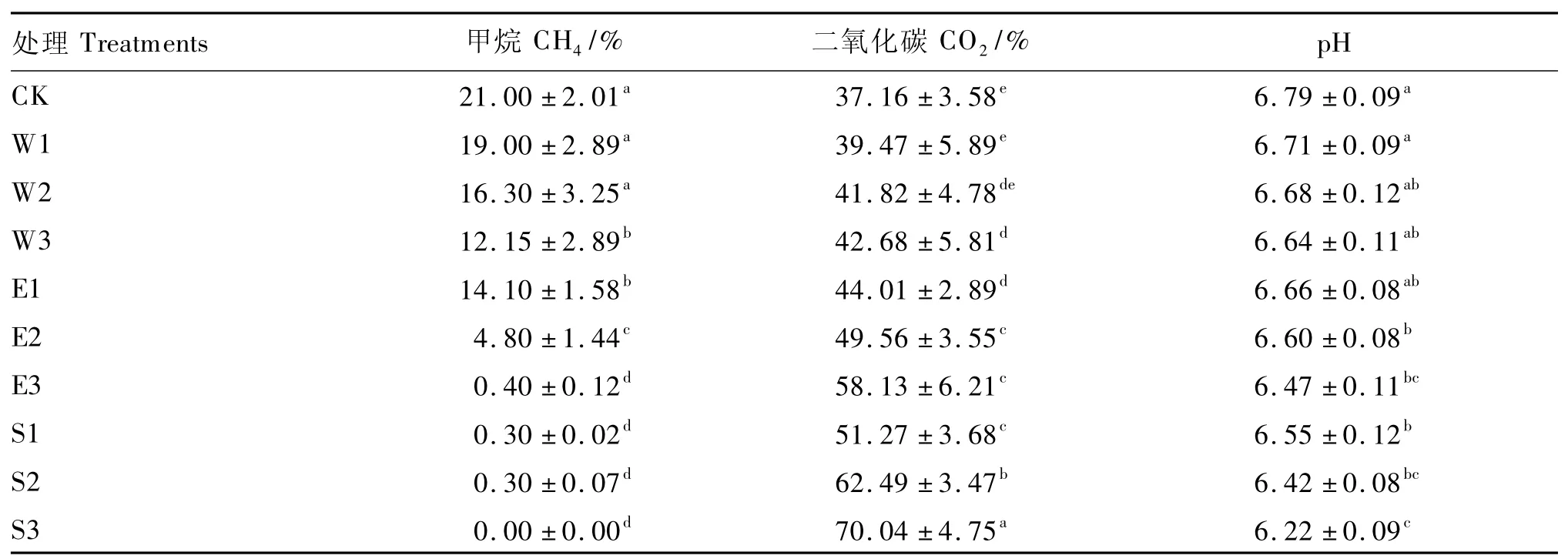
表2 不同处理凤仙花对体外瘤胃发酵CH4、CO2含量和pH的影响(24 h)Table 2 Effects of different preparations of Impatiens balsamina on CH4,CO2contents and pH in vitro rumen fermentation(24 h)
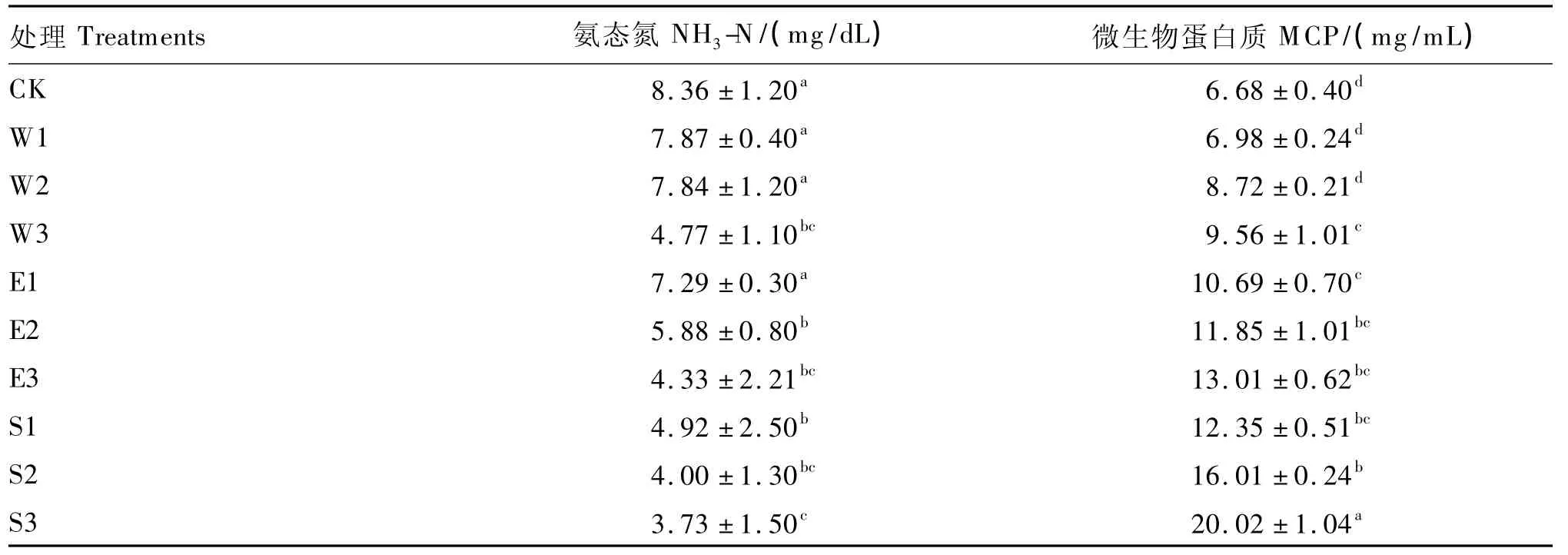
表3 不同处理凤仙花对体外瘤胃发酵NH3-N和MCP含量的影响(24 h)Table 3 Effects of different preparations of Impatiens balsamina on NH3-N and MCP contents in vitro rumen fermentation(24 h)
2.4 不同处理凤仙花对体外瘤胃发酵MCP的影响
从表3看出,体外发酵液中CK的MCP含量最低,凤仙花固体粉剂处理的MCP含量高,S1、S2和S3分别比CK提高了84.9%(P<0.05)、139.7%(P<0.05)和199.7%(P<0.05);E1、E2和E3分别比CK提高了60.0%(P<0.05)、77.4%(P<0.05)和94.8%(P<0.05);水浸提液对MCP提高效果比乙醇浸提液差,W1、W2和W3分别比CK提高了4.5%(P>0.05)、30.5%(P>0.05)和43.1%(P<0.05)。在凤仙花相同处理中,随着添加量的增加,MCP含量逐渐提高。
3 讨论
3.1 不同处理凤仙花对体外瘤胃发酵产气量以及CH4和CO2含量的影响
研究结果表明,产气量越高,瘤胃内的发酵活动越剧烈,对反刍动物的促进作用越明显[16]。从试验结果看,凤仙花不同处理对体外瘤胃发酵有一定影响,与CK比较,从开始到培养结束,凤仙花均可以刺激瘤胃微生物发酵代谢活动,提高瘤胃产气量,添加量高时效果越明显。凤仙花对CH4和CO2含量的影响相反,CH4含量均比CK低,这可能是与CH4生成受到抑制时,引起CO2和氢气(H2)等的累积有关[17],其中原因以及瘤胃中产CH4微生物的变化特征还有待进一步研究。研究发现,莫能菌素具有明显降低CH4生成的效果,但是在饲粮中莫能菌素含量较高时抑制CO2产生,影响瘤胃微生物代谢活动,初步分析两者降甲烷作用方式可能不同。
3.2 不同处理凤仙花对体外瘤胃发酵pH的影响
瘤胃液pH是反映瘤胃内发酵状况的一项综合指标。瘤胃微生物以瘤胃为其直接的生长环境,pH过高或过低对瘤胃微生物的正常生长、发育及发酵均有不利的影响。通常认为正常的瘤胃pH变化范围为6~7,当pH低于6时,纤维分解菌和原虫数量将减少,饲粮中纤维素和蛋白质的降解率就会降低[18]。在本试验中体外发酵24 h各处理pH均大于6,pH的变化范围未超出瘤胃微生物的最适生长范围。随着不同处理凤仙花添加量的增加,pH有降低的趋势,但对瘤胃发酵没有产生不利影响。添加凤仙花引起pH降低,分析原因可能是凤仙花改变了瘤胃微生物发酵方式,引起挥发性脂肪酸(VFA)等物质增加,又由于采用不连续体外培养方式,造成代谢产物不能及时排出而累积[19]。
3.3 不同处理凤仙花对体外瘤胃发酵NH3-N和MCP含量的影响
瘤胃液中NH3-N是瘤胃氮代谢过程中外源蛋白质和内源含氮物质降解的重要产物,同时也是瘤胃微生物合成MCP的原料,它反映了瘤胃内微生物氮的供应状况[20]。MCP代谢是瘤胃微生物区系营养代谢的一个重要组成部分,是反刍动物最主要的氮源供应者,它可以满足动物营养需要量的40%~80%。由于体外培养没有瘤胃壁对NH3-N 的吸收、分泌等的影响,所以 NH3-N 的含量主要取决于2个方面:一方面是瘤胃微生物降解饲粮中的含氮化合物为NH3-N的能力,另一方面是瘤胃微生物利用NH3-N合成MCP的能力。本试验中,体外培养24 h后,添加凤仙花各处理的NH3-N含量不同程度低于 CK,降低了5.8% ~55.4%;MCP含量相反,凤仙花处理均比CK高,比CK增加了4.5%~199.7%。结果表明,凤仙花处理刺激了瘤胃微生物代谢活动,促进NH3-N向MCP转化,加快了MCP的合成,这个结果与前人报道茶皂素等植物提取物具有减少瘤胃NH3-N含量、促进MCP合成[21]的结论一致。
3.4 凤仙花不同处理方式瘤胃发酵效果比较
比较凤仙花水和乙醇浸提液以及固体粉剂体外瘤胃发酵效果,从CH4、CO2和MCP含量等数据看,添加量相同时,固体粉剂的效果最好,水浸提液效果最差。直接添加固体粉剂,其中的糖、蛋白质等营养物质也可被微生物利用,促进瘤胃发酵,因此效果更好。凤仙花乙醇浸提液效果比水浸提液好,这表明降CH4有效成分极性较弱,更容易被有机溶剂浸提。因此,在以后研究中可以选用不同有机溶剂浸提凤仙花,比较体外培养降甲烷效果,并分析有效成分的性质和结构。
4 结论
①不同处理凤仙花均能有效降低CH4产生,促进NH3-N向MCP转化,添加量高(2.5%)时效果更明显。
②比较水浸提液、乙醇浸提液和固体粉剂体外培养效果,固体粉剂最好。
③凤仙花有望成为新的降CH4植物。
[1] GILL M,SMITH P,WILKINSON J M.Mitigating climate change:the role of domestic livestock[J].Animal,2010,4(3):323 -333.
[2] JOHNSON K A,JOHNSON D E.Methane emission from cattle[J].Journal of Animal Science,1995,73:2483-2492.
[3] YANG C M,RUSSELL J B.The effect of monensin supplementation on ruminal ammonia accumulation in vivo and the numbers of amino acid-fermenting bacteria[J].Journal of Animal Science,1993,71(12):3470-3476.
[4] WALLACE R J.Antimicrobial properties of plant secondary metabolites[J].Proceedings of the Nutrition Society,2004,63:621 -629.
[5] 陆燕,林波,王恬,等.大蒜油对体外瘤胃发酵、甲烷生成和微生物区系的影响[J].动物营养学报,2010,22(2):386 -392.
[6] BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Plant extracts affectin vitrorumen microbial fermentation[J].Journal of Dairy Science,2006,89:761 -771.
[7] AMLAN K P,JYOTIANA S.A new perspective on the use of plant secondary metabolites to inhibit methanogenesis in the rumen[J].Phytochemistry,2010,71:1198-1222.
[8] PATRA A.Chemical constituents of Impatiens balsamina L.[J].Chemical Society,1988,19(6):367-368.
[9] 胡喜兰,朱慧,刘存瑞,等.凤仙花的化学成分研究[J].中成药,2003,25(10):833.
[10] 张志红,黄江丽,田晓娟,等.几种植物提取物对瘤胃体外培养物甲烷生成的影响[J].江西科学,2011,29(1):43 -45.
[11] MENKE K H,STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].Animal Research and Development,1988,28:7 - 55.
[12] 王全军,毛胜勇,张红霞,等.半胱胺对山羊瘤胃微生物体外发酵的影响[J].华中农业大学学报,2002,21(6):535 -539.
[13] 胡伟莲,王佳堃,吕建敏.瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J].浙江大学学报:农业与生命科学版,2006,32(2):217-221.
[14] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40.
[15] MAKKAR H P S,SHAVMA O P,DAWRA R K,et al.Simple determination of microbial protein in rumen liquor[J].Journal of Dairy Science,1982,65:2170 -2173.
[16] MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J].The Journal of Agricultural Science,1979,93:217-222.
[17] LÓPEZ S,VALDÉS C,NEWBOLD C J,et al.Influence of sodium fumarate addition on rumen fermentation in vitro[J].British Journal of Nutrition,1999,81:59-64.
[18] BROWN M S,PONCE C H,PULIKANTI R,et al.Adaptation of beef cattle to high-concentrate diets:performance and ruminal metabolism[J].Journal of Animal Science,2006,84:25 -33.
[19] 陈俊材,王威,王之盛.利用体外法研究纳米氧化锌的添加对瘤胃发酵的影响[J].动物营养学报,2011,23(8):1415 -1421.
[20] 王聪,刘强,董群,等.日粮补充苹果酸对牛瘤胃发酵和养分消化代谢的影响[J].草业学报,2009,18(3):224-231.
[21] 叶均安.茶皂索对湖羊生产性能的影响[J].饲料研究,2001,6:33.
