下肢骨骼肌缺血后处理对兔缺血/再灌注心肌坏死和凋亡的影响*
2012-08-30任慧敏谢瑞芹呼海娟鲁静朝
任慧敏,谢瑞芹,崔 炜,刘 凡,刘 静,呼海娟,鲁静朝
(河北医科大学第二医院心内科,石家庄 050000)
心肌缺血/再灌注损伤是临床上比较常见的病理生理过程,因其较大的影响了再灌注的治疗效果,而受到人们越来越多的关注。1986年,Murry等[1]首次提出缺血预处理(ischemic preconditioning,IPC)能减轻后续长时间缺血/再灌注所引起的心肌损伤,认为是一种有效的机体保护机制,并且已在多种动物试验模型中得到证实。然而,由于心肌缺血发生时间的不可预知性,缺血预处理在临床中的应用受到了极大限制。后来,Zhao等学者[2]提出缺血后处理(ischemic-postconditioning),并证明其与预处理有着相似的心脏保护作用。近年来,有学者提出了远端缺血后处理的概念,并进行了一系列的研究,但骨骼肌缺血后处理对兔心肌缺血/再灌注坏死和凋亡的研究目前报道较少,本实验预对此进行研究。
1 材料与方法
1.1 实验动物及分组
雄性新西兰大白兔,体重2 500~3 000 g,由河北医科大学动物中心提供。随机分3组:假手术组(Sham):仅开胸暴露心脏,左冠状动脉左室支中点处穿线,不结扎;缺血/再灌注组(ischemia/reperfusion,I/R):左冠状动脉左室支阻断45 min后,开放再灌注120 min;远端后处理组(remote postcondationing,RPostC):在冠脉缺血/再灌注39 min时采取双下肢髂外动脉闭塞5 min,在心肌再灌注前1 min结束双下肢后处理,心肌再灌注120 min。
1.2 主要试剂
Tunel试剂盒(南京建成生物工程研究所),Caspase-3兔免疫组化试剂盒(北京博奥森生物科技有限公司),一抗Bcl-2,Bax兔抗IgG多克隆抗体(博士德生物技术有限公司),SP9001试剂盒及DAB显色试剂盒(北京中杉生物科技有限公司),肌酸激酶试剂盒(中生北控生物科技股份有限公司),乳酸脱氢酶试剂盒(南京建成生物工程研究所)。其余均为分析纯。
1.3 方法
1.3.1 心肌缺血/再灌注模型建立 以3%戊巴比妥钠(30 mg/kg)耳缘静脉注射麻醉,气管插管,接小动物呼吸机,用针形电极记录标准肢体导联心电图。在胸骨左缘3~5肋间开胸,暴露心脏。选择左室支在左心耳下缘与心尖连线的中点穿线备用,硅胶管套线,束紧后在贴近硅胶管的上端用止血钳将线夹紧,造成心肌缺血。结扎成功标准是心电图导联ST抬高,结扎冠脉远端心肌变紫。再灌注成功时变紫心肌恢复红润。
1.3.2 双下肢骨骼肌缺血/再灌注模型建立 在心肌缺血/再灌注模型制备之前,采用2%利多卡因局麻双侧腹股沟区,直视下分离双侧髂外动脉。应用动脉夹夹闭髂外动脉固定位置以阻断血流,以动脉搏动消失及恢复反映下肢缺血/再灌注情况。
1.3.3 心肌缺血区、坏死区范围的检测 于再灌注末在原位重新结扎左室支,从颈静脉注入5%伊文思兰4 ml,取下心脏,游离左心室,-20℃冷冻20 min固定心脏;将心脏沿着左心室(LV)长轴均匀切为厚约2 mm的心肌8~9片。再分离无蓝染的缺血区(ischemic zone,IZ)和蓝染的非缺血区并照像。将心肌置于 1%TTC磷酸缓冲液中37℃孵育 10~15 min,可将灰白色的坏死区(necrotic zone,NZ)和深红色的非坏死区分开,照相后分离缺血区、非缺血区及缺血区内的坏死区和非坏死区,将分离好的心肌用滤吸纸吸干后分别称重,并通过图像处理软件(Photoshop及image-Pro Plus图像处理系统)计算各部分面积。以重量和面积两种计量单位评价心肌缺血及坏死程度(缺血程度:缺血区重量/左室重量 ,以IZ/LVg表示,缺血区面积/左室面积 以IZ/LVs表示;坏死程度:坏死区重量/缺血区重量以NZ/IZg表示,坏死区面积/缺血区面积以NZ/IZs表示)。
1.3.4 血清心肌酶的测定 分别于结扎冠脉前、缺血45 min、再灌注60 min、120 min由颈动脉抽血 2 ml,2 500 r/min,离心20 min分离血清,-80℃保存待测。分别检测血清磷酸肌酸酶(CK)、乳酸脱氢酶(LDH)。
1.3.5 凋亡心肌细胞检测 用Tunel法,即末端脱氧核苷酸转移酶介导的生物素(dUTP)切口末端标记法(terminal deoxynucleotidyltransferase-mediated dUTP-biotin nick end labeling assay,TUNEL assay)。于再灌注末,取缺血区心肌。组织大小为1 cm×1 cm×0.5 cm。取材后立即放人4%多聚甲醛液固定。用二甲苯常规脱蜡,梯度酒精入水重新水合,然后置PBS中5~10 min。TUNEL法标记程序严格按试剂盒方法进行。最后用苏木精复染,常规脱水、透明、封片,显微镜观察结果。凋亡细胞细胞核呈棕褐色或棕黄色颗粒为Tunel阳性反应。独立取5个高倍镜视野,计数凋亡细胞数和细胞总数。凋亡细胞指数=(凋亡细胞数/细胞总数)×100%。
1.3.6 免疫组化法测caspase-3、Bcl-2及Bax的表达于再灌注末,取相应缺血区心肌组织用4%多聚甲醛液固定。脱水、透明、浸蜡、石蜡包埋。石蜡切片常规脱蜡至水,3%双氧水孵育,微波抗原修复,正常山羊血清封闭,依次分别滴加1∶200抗兔caspase-3抗体,1∶100抗兔Bcl-2抗体及1∶100抗兔Bax抗体。生物素化二抗,SP复合物,DAB显色,复染,脱水,透明,中性树胶封片。计算caspase-3的表达,于每张玻片上随机选取5个区域,每个区域计数100个细胞中的阳性细胞数。计算Bcl-2及Bax的表达通过CIAS-1000型计算机图像分析系统,每张切片随机选10个视野,分别测定每组Bcl-2、Bax细胞阳性染色的平均光密度(OD值)与阳性细胞百分比,计算蛋白阳性表达指数(PEI),PEI=OD值×阳性细胞百分比×100,并计算Bax与Bcl-2的比值。
1.4 统计学分析
2 结果
2.1 血流动力学指标
3组动物在缺血前、缺血后45 min及再灌注60 min、120 min时的心率(HR)和平均动脉压(MAP)。
各组间HR和MAP在冠状动脉缺血前差异无统计学意义。在冠状动脉缺血期间,各组试验动物的MAP呈下降趋势,但是这种变化无统计学差异(表1)。
Tab.1 Hemodynamics during ischemia and reperfusion in three groups(±s,n=6)
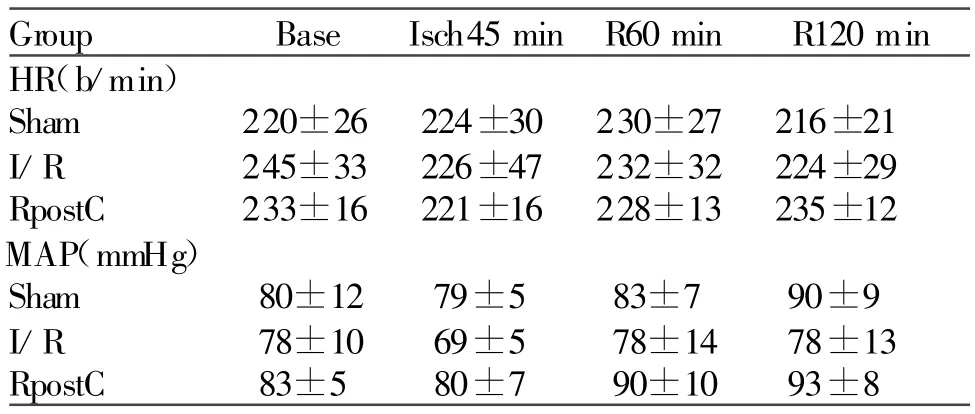
Tab.1 Hemodynamics during ischemia and reperfusion in three groups(±s,n=6)
Isch45 min:End of 45 min LCX occlusion;R60 min:60 min after reperfusion;R120 min:120 min after reperfusion;HR:Heart rate;MAP:Mean arterial blood pressure;I/R:Ischemia/reperfusion;Rpost C:Remote postconditioning
Group Base Isch45 min R60 min R120 min HR(b/min)Sham 220±26 224±30 230±27 216±21 I/R 245±33 226±47 232±32 224±29 RpostC 233±16 221±16 228±13 235±12 MAP(mmHg)Sham 80±12 79±5 83±7 90±9 I/R 78±10 69±5 78±14 78±13 RpostC 83±5 80±7 90±10 93±8
2.2 心肌缺血和坏死范围的测定
缺血/再灌注组与远端后适应组W、LV及左室支结扎所造成的心肌缺血程度之间无统计学意义。远端后适应组与缺血/再灌注组相比能够显著减少坏死程度:RPostC:NZ/IZg 19.4%±5.6%、NZ/IZs 17.11%±7.74%vsI/R:NZ/IZg 35.9%±6.3%、NZ/IZs 33.46%±8.05%(P<0.05,表2)。
Tab.2 Comparison of W、LV and IZ/LV(%)、NZ/IZ(%)among three groups(±s,n=6)

Tab.2 Comparison of W、LV and IZ/LV(%)、NZ/IZ(%)among three groups(±s,n=6)
W:Weight;LV:Left ventricular mass;IZ:Ischemic zone;NZ:Necrotic zone;g:Gravity;s:Square metre*P<0.05 vs I/R
Group W(Kg) LV(g) IZ/LV(g) IZ/LV(s) NZ/IZ(g) NZ/IZ(s)Sham 2.70±0.13 3.16±0.08 0 0 0 0 I/R 2.69±0.09 3.21±0.15 33.7±5.6 38.2±7.1 35.9±6.3 33.46±8.05 RpostC 2.73±0.16 3.19±0.23 31.5±3.7 36.7±4.8 19.4±5.6* 17.11±7.74*
2.3 血清CK和LDH的测定
各组动物缺血前、缺血后、再灌注60 min及再灌注120 min测得血清CK及LDH。各组缺血前CK及LDH均无差异。RPostC较缺血/再灌注组能够减少再灌注120 min末CK释放RPostC:CK 3997±865 U/LvsI/R:CK 6885±1202 U/L(P<0.05),但LDH未显示统计学差异(表3)。
Tab.3 Comparison of CK(U/L)and LDH(U/L)among three groups(±s,n=6)
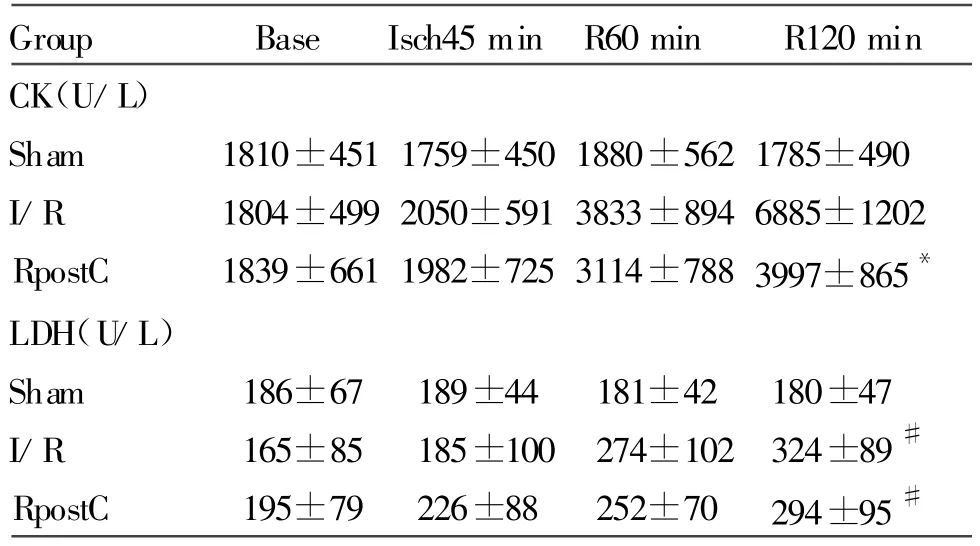
Tab.3 Comparison of CK(U/L)and LDH(U/L)among three groups(±s,n=6)
*P<0.05 vs I/R;#P<0.05 vs sham
Group Base Isch45 min R60 min R120 min CK(U/L)Sham 1810±451 1759±450 1880±562 1785±490 I/R 1804±499 2050±591 3833±894 6885±1202 RpostC 1839±661 1982±725 3114±7883997±865*LDH(U/L)Sham 186±67 189±44 181±42 180±47 I/R 165±85 185±100 274±102 324±89#RpostC 195±79 226±88 252±70 294±95#
2.4 HE染色结果
Sham组心肌细胞大小形态无变化,横纹清晰,胞核正常,只有少数区域间质充血。I/R组心肌细胞体积明显增大、水肿,广泛空泡变性。胞浆染色淡。少数区域的心肌纤维断裂;胞核明显增大,染色浅;间质充血、水肿,血管明显扩张。RPostC组的心肌细胞体积略增大,少数细胞内空泡变性;胞浆染色较正常略淡,心肌横纹局灶性消失,胞核小、染色无明显变化,心肌细胞染色较I/R组深,部分区域间质充血,少数区域血管周围有炎性细胞渗出(图1)。
2.5 Tunel检测结果
凋亡细胞的细胞核呈Tunel阳性反应,为棕褐色或棕黄色颗粒(图2)。假手术组兔心肌组织只有少量凋亡细胞,缺血/再灌注组缺血区出现大量凋亡细胞,凋亡指数为35.81%±1.10%,远端后处理组缺血区心肌凋亡指数为21.79%±1.07%,显著低于缺血/再灌注组(P<0.05,表4)。
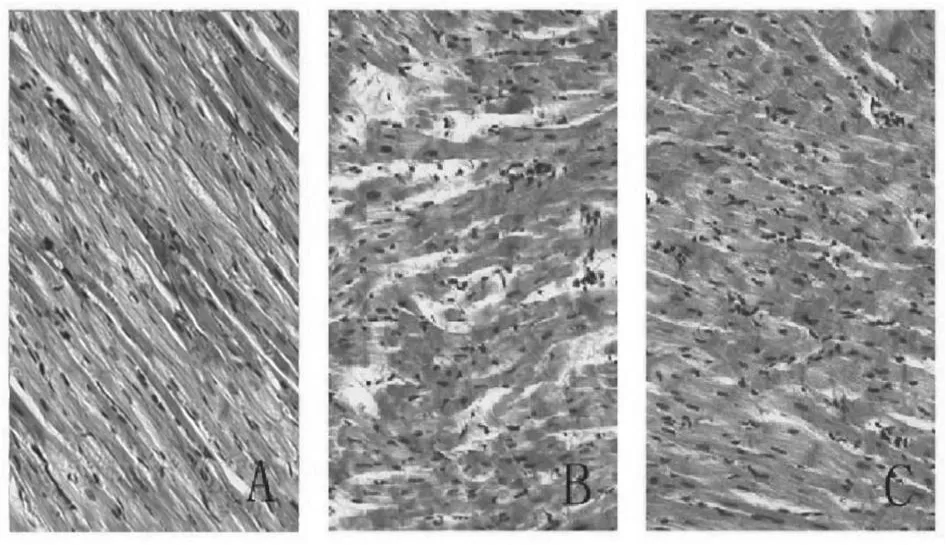
Fig.1 Myocardial cell shape(HE ×200)

Fig.2 Tunel test results(TUNEL ×400)
2.6 Caspase-3的表达
与假手术组4.57%±1.72%比较,缺血/再灌注组caspase-3阳性细胞指数明显增加,39.00%±2.43%(P<0.05);而RPostC组的阳性细胞指数25.03%±1.16%与缺血/再灌注组比较显著减小(P<0.05,表 4)。
Tab.4 Tunel and caspase-3 positive cells index(%,±s,n=6)
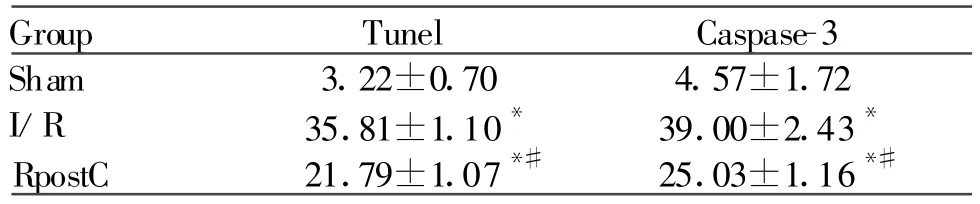
Tab.4 Tunel and caspase-3 positive cells index(%,±s,n=6)
*P<0.05 vs Sham;#P<0.05 vs I/R
Group Tunel Caspase-3 Sham 3.22±0.70 4.57±1.72 I/R 35.81±1.10* 39.00±2.43*RpostC 21.79±1.07*# 25.03±1.16*#
2.7 Bcl-2及Bax的表达
与Sham组比较,I/R组及RPostC组Bax蛋白表达指数、Bcl-2蛋白表达指数均升高,RPsotC组的Bax/Bcl-2比值降低,而I/R组的Bax/Bcl-2比值升高。与I/R组相比较,RPostC组Bax蛋白表达指数及Bax/Bcl-2比值显著降低,Bcl-2表达指数显著升高,差异均有统计学意义(P<0.05,表5)。
Tab.5 Bcl-2 and Bax protein expression ratio(±s,n=6)

Tab.5 Bcl-2 and Bax protein expression ratio(±s,n=6)
*P<0.05 vs sham;#P<0.05 vs I/R
Group Bcl-2 Bax Bax/Bcl-2 Sham 0.36±0.07 0.31±0.02 0.84±0.72 I/R 5.81±1.70* 16.85±2.43* 3.37±0.28*RpostC 14.79±1.07*# 4.03±1.16*# 0.27±0.46*#
3 讨论
急性心肌梗死是严重危害人类健康的常见疾病。溶栓或直接经皮冠状动脉介入治疗(PCI)等再灌注治疗可以有效恢复冠脉血流,减少心肌梗死面积,但在再灌注治疗的同时也会带来再灌注损伤,表现在促进缺血心肌的凋亡[3],加重心肌的损伤[4]等。因此,再灌注损伤明显影响了血管开通的治疗的效果。缺血预处理及后处理均是机体的有效保护机制,其心脏保护作用已经在犬、兔和鼠等动物模型上得到了证实[2,5,6]。缺血后处理的心肌保护作用不仅可以通过心脏本身的反复缺血/再灌注而获得,还可以通过心脏外器官如肾动脉、肢体动脉及肠系膜动脉等来实现。通过其短暂的缺血/再灌注而产生类似的心脏保护效应,即远端缺血后处理。2005年,Kerendi等[7]人证实在心肌缺血/再灌注末实施的短暂性肾脏缺血/再灌注能够显著的减少心肌梗死的面积。然而,作为一种外周器官,骨骼肌具有操作方便、耐受力强等特点,但骨骼肌远端缺血后处理对心肌坏死和凋亡的影响目前的研究和报道较少。
关于远端缺血后处理的作用机制,已有大量实验进行研究。Kerendi等提出这种远端器官提供的保护作用(肾对心脏),可能与肾缺血/再灌注引起腺苷(ADO)的释放有关,随后又激活了心脏腺苷受体。Liu等[8]在对兔肾脏的研究中发现,远端肾脏的缺血后处理减少了心脏缺血/再灌注的心肌细胞的凋亡,同时上调Bcl-2的表达,下调Bax的表达,此作用可能与蛋白激酶C(PKC)的激活有关。
心肌的损伤包括心肌细胞的坏死和凋亡,其中坏死是主要的表现形式,但凋亡在细胞损伤过程中同样起着极其重要的作用。细胞凋亡是一个由多种因素引起的复杂过程,受多种蛋白因子的调控,其中caspase-3(半胱天冬酶-3)和Bcl-2水平的高低是决定细胞凋亡的重要因素。在凋亡阶段,caspase-3主要负责对关键性蛋白的酶切,caspase-3一旦被激活,细胞凋亡的发生就将不可逆转。Sun等[9]在肝缺血/再灌注模型中发现在缺血后处理中Bcl-2蛋白明显提高而且凋亡指数显著下降,进而提出后处理可通过促进抑凋亡基因Bc1-2的表达、抑制凋亡执行者caspase-3酶的活性,从而抑制再灌注诱导的细胞凋亡。
本研究结果显示,在冠状动脉再灌注早期给予兔双下肢髂外动脉短暂缺血/再灌注能够明显减轻兔心肌缺血/再灌注损伤,减少血清CK的释放,同时也明显地减小了心肌梗死的程度。此结果与Li等[10]在兔骨骼肌后处理模型中的研究结果相一致,其可能与减少氧自由基释放,增强抗氧化功能有关。同时,骨骼肌缺血后处理不仅减少caspase-3的表达,还减少Bax/Bcl-2的表达比例,增加Bcl-2的表达,而Bcl-2是一个抑制细胞凋亡的重要因素,其能够在多阶段、多层次阻断细胞凋亡的进程。可以抑制线粒体的破裂,阻止凋亡执行者caspase-3的激活物细胞色素C的释放,还可直接与凋亡蛋白酶激活因子1结合,使caspase-3无法激活,从而起到抑制细胞凋亡的作用。
由此可以看出,骨骼肌远端缺血后处理不仅减少了心肌坏死的程度,而且减少了缺血/再灌注心肌缺血区心肌细胞的凋亡。推测其原因,骨骼肌的缺血后处理抑制了兔心肌缺血/再灌注早期启动的凋亡程序,抑制了其促凋亡基因caspase-3的表达,促进了抑凋亡基因Bcl-2的表达,减少了Bax/Bcl-2的蛋白表达比例,从而抑制了凋亡的进程。骨骼肌远端缺血后处理对心肌细胞的坏死和凋亡都有着有效的控制作用,这为骨骼肌远端后处理能够应用于临床提供了可靠的动物实验数据。
[1]Murry C E,Jennings R B,Reimer K A.Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-1136.
[2]Zhao Z Q,Corvera J S,Halkos M E,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-588.
[3]Fliss H,Gattinger D.Apoptosis in ischemic and reperfused rat myocardium[J].Circ Res,1996,79(5):949-956.
[4]Jordan J E,Zhao Z Q,Vinten-Johansen J.The role of neutrophils in myocardial ischemia-reperfusion injury[J].Cardiovasc Res,1999,43(4):860-878.
[5]HalkosM E,Kerendi F,Corvera J S,et al.Myocardialprotectionwith postconditioning is not enhanced by ischemic preconditioning[J].Ann Thorac Surg,2004,78(3):961-969.
[6]Tsang A,Hausenloy D J,Mocanu M M,et al.Postconditioning:a form of“modified reperfusion” protects the myocardium by activating the phosphatidylinositol 3-kinase-Akt pathway[J].Circ Res,2004,95(3):230-232.
[7]Kerendi F,Kin H,Halkos M E,et al.Remote postconditioning.Brief renal ischemia and reperfusion applied before coronary artery reperfusion reducesmyocardial infarct size via endogenous activation of adenosine receptors[J].Basic Res Cardiol,2005,100(5):404-412.
[8]刘 松,吴相峰.肾脏缺血后处理对兔性缺血再灌注心肌细胞凋亡和 Bcl-2、Bax蛋白表达的影响[J].中华心血管病学杂志,2007,35(8):757-760.
[9]Sun K,LiuZ S,Sun Q.Role of mitochondria in cell apoptosis during hepatic ischemia-reperfusion injury and protective effect of ischemic postconditioning[J].World J Gastroenterol,2004,10(13):1934-1938.
[10]Li C M,Zhang X H,Ma X J,et al.Limb ischemic postconditioning protects myocardium from ischemia-reperfusion injury[J].Sc and Cardiovasc J,2006,40(5):312-317.
