中药合剂抗运动病作用与对血液内分泌激素水平的影响*
2012-08-30沈华祥姜正林董根山杨红旗陈苗苗
沈华祥,姜正林△,董根山,杨红旗,蒋 锐,李 霞,尹 鹏,陈苗苗
(1.南通大学航海医学研究所,江苏南通 226001;2.河南省人民医院,郑州 450003)
国内外学者研究发现,运动病与机体的某种应激有关,因为运动病具有运动环境依赖性,乘坐交通工具时发生,离开该环境后即很快缓解[1,2],而应激反应都伴有内分泌激素的改变。并且,运动病敏感性存在个体差异,与前庭刺激后血液激素水平有一定的联系。因此,运动病时的内分泌变化成为关注点。血液中一些内分泌激素如精氨酸加压素(Arginine vasopressin,AVP)、皮质醇或皮质酮(cortisol or corticosterone)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、肾上腺素、去甲肾上腺素的变化与运动病敏感性个体差异存在联系[2-5],特别是AVP及其相关受体[5,6],已有研究证明中枢神经系统中AVP的V1受体拮抗剂在动物可抗实验性运动病。有研究发现,糖皮质激素受体协同剂地塞米松可抑制运动病的发生。
我们根据中药作用研制了一种抗运动病中药方剂,主要由酸枣仁、苦参、赤芍、丹皮等 10味中药组成,初步的人体药效试验显示,该药具有较好的抗运动病效果,为了进一步研究开发,通过动物实验进一步验证其药效,并探讨其作用机制,本研究通过大鼠、豚鼠和毕格犬运动病模型,灌胃给予上述中药制成的合剂,检测大鼠产生异食癖时高岭土摄入量、豚鼠眼震指标、毕格犬呕吐潜伏期的变化,并通过大鼠给药后对旋转刺激后血浆皮质酮(Cort)、ACTH、促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)和AVP等激素水平的变化,进一步探讨中药合剂预防运动病的有效性及其机制,为运动病药物防治提供实验依据。
1 材料与方法
1.1 研究对象与实验材料
SD大鼠140只,雌雄各半,体重 220~260 g,其中80用于进行旋转刺激给药前后激素水平的测定,60只用于旋转刺激后异食高岭土量测定;10只豚鼠,雌雄各半,380~460 g,用于旋转实验诱发眼震电图的测定;16只毕格犬,雌雄各半,体重7.5~10.5 kg,用于旋转剌激后呕吐潜伏期的测定。大鼠、豚鼠由南通大学实验动物中心提供,毕格犬购自上海交通大学农学院教学实验实习场。中药合剂由河南省人民医院提供,药煎好后,折合生药量为0.43 g/ml生药。茶苯海明购自上海淮海制药厂,用生理盐水溶解。旋转刺激前1 h,大鼠及豚鼠以灌胃方式给药,毕格犬经口给药。
大鼠与犬的旋转刺激装置根据Crampton和Lucot(1985)的报道仿制而成;豚鼠眼震诱发刺激装置为眼震电图检查系统(VTS-2000型,北京爱赛德科技发展有限责任公司);SN-697全自动双探头放射免疫γ-计数器(中科院上海原子能研究所日环仪器厂生产);Cort、ACTH放射免疫测定试剂盒由北京北方生物技术研究所提供,AVP、CRH放射免疫测定试剂盒由中国人民解放军第二军医大学神经生物学教研室提供;大鼠食用的高岭土由阿拉伯粉胶和高岭土混匀后加蒸馏水配制而成。
1.2 旋转刺激
实验时将大鼠或犬无束缚地放入旋转装置的有机玻璃笼内,围绕水平轴以16°/s2的角加速度开始加速旋转,达到最高速度120°/s2的角速度后立即以48°/s2的角加速度减速旋转,直至旋转停止,历时10 s,然后反方向旋转,如此反复刺激,大鼠旋转60 min,犬旋转30 min。豚鼠眼震实验选用自制的固定盒,将豚鼠固定,并处于自然俯卧体位,采用频率为0.05 Hz,峰速为90°/s的正弦摆动以诱发前庭性眼震。
1.3 运动病敏感大鼠和犬的筛选
选择运动病敏感的动物进行后续实验。
大鼠运动病敏感性依异食癖行为进行筛选。动物从实验动物中心领取后,分别编号,单独置于各实验笼内,自由摄食、饮水。适应性饲养3~4 d后,让其自由食用高岭土,记录3 d内的摄入量,然后给予旋转刺激60 min,再让其自由食用高岭土3 d,观察旋转刺激后高岭土食用量的增加情况。刺激前进食高岭土的大鼠,刺激后3 d摄取总量增加≥3 g的为敏感;刺激前不进食高岭土的大鼠,刺激后3 d摄取总量≥1 g的为敏感。休息2周,然后进行后续中药合剂抗运动病实验。
16只毕格犬购回后,适应性饲养2周,然后进行运动病敏感性筛选。通过30 min的旋转刺激,观察呕吐出现时间,2周后重复一次,取两次结果的平均值,选择呕吐潜伏期类似的10只相对敏感的犬(雌性6只,雄性4只),间隔2周后进行后续药物试验。
1.4 中药合剂抗晕实验
(1)大鼠分成6组(n=10,雌雄各半):空白组(不给予任何处理)、对照组(生理盐水灌胃3.24 ml/kg+旋转)、低剂量组(给中药合剂0.81 ml/kg+旋转)、中剂量组(给中药合剂1.62 ml/kg+旋转)、高剂量组(给中药合剂3.24 ml/kg+旋转)、茶苯海明(阳性对照药)组(给茶苯海明4.5 mg/kg+旋转),每日给予1次旋转刺激,每次60 min,如此持续3 d,记录3 d摄入高岭土的总量。
(2)10只豚鼠,随机分成2组:中药合剂组和对照组,适应性饲养3~4天,自由摄食饮水。豚鼠用乙醚麻醉,于两眼外眦部和头顶部剃毛,插入针灸电极,记录电极位于两眼外眦部,参考电极位于头顶部。待动物清醒后开始实验,豚鼠固定于实验匣内,处于自然头位,对照组灌服等量的蒸馏水,药物组给予中药合剂(3.24 ml/kg),1.5 h后在暗室中进行旋转摆动试验,摆动周期为20 s,共摆动5个周期,在摆动过程中进行眼震记录。两组分别记录给水前后4次和给药前后4次眼震,观察指标为眼震频率(眼震最大反应期10 s内眼震的平均次数)、平均慢相速度(平均慢相波幅/慢相时间,°/s)、增益(正弦摆动中,眼震慢相峰速度与转椅峰速度之比)。
(3)10只毕格犬按5×5拉丁方设计分为5个小组 ,分别编号为A、B、C、D、E,每组两只,每 2周进行1次旋转刺激,每次刺激30 min,10周完成5个刺激与药物实验轮次。5个小组随机排序,分别为5个组别:对照组(生理盐水 10 ml)、中药低剂量组(0.1875 ml/kg)、中剂量组(0.375 ml/kg)、高剂量组(0.75 ml/kg)和茶苯海明组(1.25 mg/kg)。观测不同组别毕格犬旋转刺激后的呕吐潜伏期,判断药物的抗运动病作用。
1.5 大鼠旋转刺激后激素水平测定
80只大鼠分成4组,分别是空白组、对照组(生理盐水3.24 ml/kg)、中药合剂组(3.24 ml/kg)、茶苯海明(4.5 mg/kg)组,每组20只。空白组不进行旋转刺激等处理,其它3组10只大鼠不给予旋转刺激,另10只给予旋转剌激60 min,然后同时采血。由于Cort、ACTH、CRH等激素分泌呈周期性节律变化,因此所有大鼠采血时间均选择在下午2点左右进行。以10%水合氯醛(400 mg/kg)腹腔麻醉后,打开胸腔,剪开心包,用5 ml注射器心尖部采血4~5 ml,迅速置入肝素抗凝管中混匀,然后置于冷冻离心机中,4℃3 000 r/min离心15 min后,取上清液即血浆,分装于EP管中待测。根据试剂盒说明书按步操作完成各激素水平的测定。
1.6 统计学处理
2 结果
2.1 中药合剂对大鼠旋转刺激后异食癖行为的影响
空白组大鼠也摄入高岭土,但模型组于旋转刺激后的摄入量明显增加(P<0.05),中药三个剂量均明显抑制大鼠摄入高岭土(P<0.05),但高剂量组作用最明显,其中中剂量组的作用与阳性对照药茶苯海明相当(表1)。鉴于中药合剂高剂量组效果明显,故在后述大鼠旋转剌激后的体内激素水平测定及豚鼠眼震检测中采用高剂量来进行实验。
Tab.1 Effect of the extracted mixture of herbs on Kaolin uptake in rat after rotatory stimulation(g,±s,n=10)

Tab.1 Effect of the extracted mixture of herbs on Kaolin uptake in rat after rotatory stimulation(g,±s,n=10)
*P<0.05 vs sham-rotation;#P<0.05 vs rotatory stimulation
Group Uptake of Kaolin Sham-rotation 2.29±1.28 Rotatory stimulation 6.00±4.33*Drug Low dose 2.71±2.18#Medial dose 1.91±0.76#High dose 0.79±0.68#Dimenhydrinate 1.68±1.37#
2.2 中药合剂抑制豚鼠旋转刺激后眼震的作用
对照组给予生理盐水,眼震频率、平均慢相速度与增益三个指标在给水前后均无显著性改变(P>0.05,表2)。图1为记录的眼震原始波形。豚鼠给予中药合剂后转椅右转与左转所诱发眼震频率与给予中药合剂前比较,明显减少(P<0.05),平均慢相速度于给药后也明显降低(P<0.05),但给药后增益的改变无显著性(P>0.05,表3)。

Fig.1 Originalwaves of nystagmus in guinea pig during sinusoidal rotation
Tab.2 Nystagmus in control group after rotatory stimulation(±s,n=5)
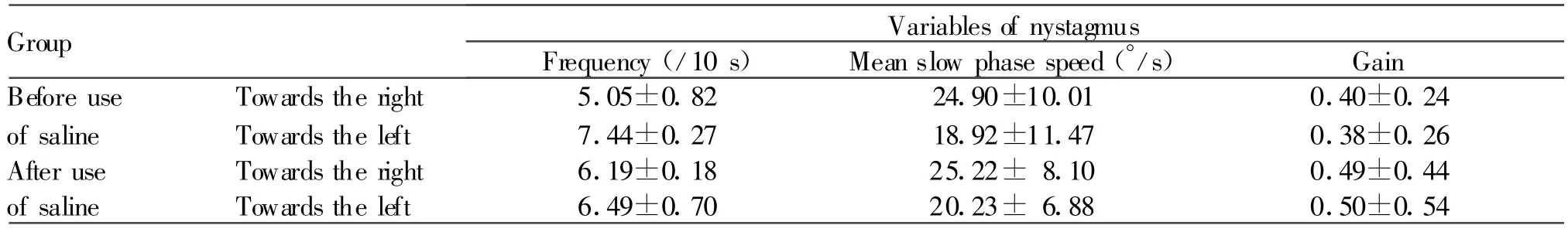
Tab.2 Nystagmus in control group after rotatory stimulation(±s,n=5)
Group Variables of nystagmus Frequency(/10 s) Mean slow phase speed(°/s) Gain Before use Towards the right 5.05±0.82 24.90±10.01 0.40±0.24 of saline Towards the left 7.44±0.27 18.92±11.47 0.38±0.26 After use Towards the right 6.19±0.18 25.22± 8.10 0.49±0.44 of saline Towards the left 6.49±0.70 20.23± 6.88 0.50±0.54
Tab.3 Effect of the extractedmixture of herbs on nystagmus in guinea pig after rotatory stimulation(±s,n=5)

Tab.3 Effect of the extractedmixture of herbs on nystagmus in guinea pig after rotatory stimulation(±s,n=5)
*P<0.05 vs before use of drug
Group Variables of nystagmus Frequency(/10s) Mean slow phase speed(°/s) Gain Before use Towards the right 6.42±0.23 28.32±12.31 0.46±0.40 of saline Towards the left 7.16±0.12 17.42±10.43 0.58±0.32 After use Towards the right 0.45±0.21* 13.21± 4.40* 0.60±0.25 of saline Towards the left 1.05±0.12* 9.28± 3.72* 0.68±0.15
2.3 中药合剂抗毕格犬旋转刺激性呕吐的作用
旋转刺激30 min内,对照组犬平均于9.48 min出现呕吐症状,使用中药合剂后,中与高剂量组的呕吐潜伏期显著延长(P<0.05)。并且,中剂量组显著长于低剂量组(P<0.05)。茶苯海明组的呕吐潜伏期也显著延长(P<0.05)。中药合剂中或高剂量的作用与茶苯海明相当(表4)。
Tab.4 Effect of the extracted mixture of herbs on latency to vomit in Beagle dog after rotatory stimulation(min, ±s,n=10)

Tab.4 Effect of the extracted mixture of herbs on latency to vomit in Beagle dog after rotatory stimulation(min, ±s,n=10)
*P<0.05 vs control;#P<0.05 vs low dose
Group Latency to vomit Control Drug low dose Middle dose High dose Dimenhydrinate 9.48±3.52 10.52±5.68 15.64±8.04*#14.74±8.99*15.91±9.66*
2.4 内分泌指标测定结果
2.4.1 血浆皮质酮的变化 空白组大鼠不接受旋转刺激,前后两次检测血浆Cort水平(15.4±2.11、16.2±2.51 ng/ml)无明显变化(P>0.05)。模型组旋转剌激后Cort水平比不接受旋转刺激的大鼠明显升高(P<0.01,表5)。中药合剂组旋转刺激后Cort水平有所升高(P<0.05),茶苯海明组旋转刺激后Cort水平也有所升高(P<0.05),但两个药物组旋转刺激后的血浆Cort水平显著低于模型组旋转刺激后的水平(P<0.01)。中药合剂与茶苯海明组之间无统计学差异(P>0.05,表5)。
Tab.5 Effect of the extracted mixture of herbs on blood level of corticosterone in rat after rotatory stimulation(ng/ml,±s,n=10)

Tab.5 Effect of the extracted mixture of herbs on blood level of corticosterone in rat after rotatory stimulation(ng/ml,±s,n=10)
*P<0.05,**P<0.01 vs no rotation;## P<0.01 vs control group
Group No rotation Rotation Control Drug Dimenhydrinate 12.23±2.53 13.11±2.13 12.76±2.19 35.10±4.88**18.20±3.20*##19.10±4.67*##
2.4.2 血浆促肾上腺皮质激素的变化 空白组不接受旋转刺激,前后两次检测ACTH血浆水平(11.53±1.83、12.80±1.88)pg/ml无明显变化(P>0.05)。模型组接受旋转剌激的大鼠血浆ACTH水平明显升高(P<0.01,表6)。中药合剂组旋转刺激后ACTH水平有所升高(P<0.05),茶苯海明组旋转刺激后ACTH水平也有所升高(P<0.05),但两个药物组旋转刺激后的血浆ACTH水平显著低于模型组旋转刺激后的水平(P<0.01)。中药合剂与茶苯海明组之间无统计学差异(P>0.05,表6)。
Tab.6 Effect of the extracted mixture of herbs on blood level of ACTH in rat after rotatory stimulation(pg/ml, ±s,n=10)

Tab.6 Effect of the extracted mixture of herbs on blood level of ACTH in rat after rotatory stimulation(pg/ml, ±s,n=10)
*P<0.05,**P<0.01 vs no rotation;## P<0.01 vs control group
Group No rotation Rotation Control Drug Dimenhydrinate 11.60±1.98 10.09±2.23 11.46±2.19 25.40±3.56**16.70±3.16*##19.50±3.27*##
2.4.3 血浆促肾上腺皮质激素释放激素的变化 与Cort和ACTH的结果类似,空白组两次检测CRH水平(41.80±9.68、39.89±10.33)pg/ml无显著性变化(P>0.05)。模型组接受旋转剌激的大鼠血浆CRH水平明显升高(P<0.01,表7)。使用中药合剂后,旋转刺激未引起CRH水平的显著性改变(P>0.05)。茶苯海明组旋转刺激后CRH水平的改变也无统计学意义(P>0.05)。
Tab.7 Effect of the extracted mixture of herbs on blood level of CRH in rat after rotatory stimulation(pg/ml,±s,n=10)

Tab.7 Effect of the extracted mixture of herbs on blood level of CRH in rat after rotatory stimulation(pg/ml,±s,n=10)
**P<0.01 vs no rotation
Group No rotation Rotation Control Drug Dimenhydrinate 36.11±11.22 38.09±12.23 53.26±12.09 89.6±22.18**40.70±15.46 45.34±10.97
2.4.4 血浆精氨酸加压素的变化 同样,不接受旋转刺激的空白组,前后两次检测血浆 AVP水平(7.81±1.33、7.60±1.48)pg/ml无显著性变化(P>0.05)。模型组接受旋转剌激的大鼠血浆AVP水平明显升高(P<0.05,表8)。使用中药合剂后,旋转刺激虽使血浆AVP水平有所升高,但无显著性意义(P>0.05)。茶苯海明组与中药合剂类似,旋转刺激后的变化亦无统计学意义(P>0.05)。
Tab.8 Effect of the extracted mixture of herbs on blood level of AVP in rat after rotatory stimulation(pg/ml, ±s,n=10)
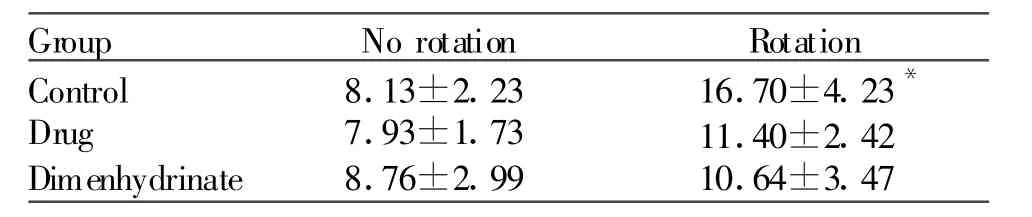
Tab.8 Effect of the extracted mixture of herbs on blood level of AVP in rat after rotatory stimulation(pg/ml, ±s,n=10)
*P<0.05 vs no rotation
Group No rotation Rotation Control Drug Dimenhydrinate 8.13±2.23 7.93±1.73 8.76±2.99 16.70±4.23*11.40±2.42 10.64±3.47
3 讨论
有效预防运动病的药物包括抗组胺药、抗胆碱药、部分钙拮抗剂、拟交感药、中草药(如生姜)、止吐剂等,以抗胆碱药东莨菪碱效果最强,抗组胺药乘晕宁(茶苯海明)最为常用,效果肯定。但是,东莨菪碱和乘晕宁等均有镇静(中枢抑制)的副作用,可能会损害人的警觉性与视觉调节功能,减慢机体对运动环境的适应,东莨菪碱还会损害记忆。这些不良作用会损害人们在特殊环境下的作业能力,尤其是对保持警觉和清醒的头脑进行决策和判断工作的影响较大。拟交感药有成瘾性等不良作用。因此,从疗效、副作用、药物作用时间、成瘾性等多方面综合考虑,缺乏令人满意的药物。并且,大多数药物需在乘坐车船前至少半小时服用,用于运动病发生后的治疗效果均不佳。因此,目前需要研究抗运动病作用强,对机体无明显副作用的药物。
中草药方剂组成讲究配伍,保证药效的同时,尽量减少副作用。我国从20世纪50年代开始中草药防治运动病的研究,国外也有一些相关报道,发现抗运动病有效的中药包括单味生姜粉、生姜半夏为主的方剂等[7]。本研究通过对传统抗呕吐药、抗眩晕药物进行筛选,以酸枣仁、苦参、赤勺、丹皮等 10味中药制成中药合剂,人体抗运动病试验显示较好的作用。该方剂中,酸枣仁具有宁心安神、敛汗、生津、养肝功能,用于虚烦不眠、惊悸怔忪、头晕眼花等症。洪庚辛曾在1987年对酸枣仁的化学成分、药理作用作了较系统的介绍。80年代研究认为酸枣仁有抗氧化及抗衰老作用,90年代以后,尤其是近十多年来,发现酸枣仁含有总黄酮及总皂苷,尹升镇等(1997)从酸枣仁中还提取分离得到2种生物碱。近年的研究大部分以酸枣仁及其所含成分对中枢神经系统的影响确定其主要药理作用为镇静、催眠、镇痛、抗惊厥、降温、降压、降脂、抗缺氧、增强免疫功能以及保护心脏等。
苦参具有抗肿瘤、抗病毒、抗肝损伤、抗肝纤维化、抑制中枢等多种药理活性。化学成分主要为生物碱和黄酮类化合物,其次还含有二烷基色原酮、醌类和三萜皂苷等。苦参碱对中枢神经系统有镇静和抗惊厥作用。
丹皮又名牡丹皮,近代药理研究表明,丹皮有抗凝血、降压、抗炎、抑制中枢神经系统等功能。丹皮含有牡丹皮原苷、芍药苷、芍药酚等,丹皮原苷酶分解后生成丹皮酚和丹皮酚苷。丹皮酚是牡丹皮中的主要活性成分,丹皮在一定程度上可以抑制中枢,有镇静催眠作用。
赤芍具有清热凉血、散瘀止痛的功能。其化学成分包括芍药苷、氧化芍药苷和牡丹酚原苷等。近年来的药理学研究表明,赤芍提取物具有扩张血管、降低血压、抗血小板聚集、抑制血栓形成、降血脂和抗动脉硬化作用,还具有清除自由基、抗氧化与细胞保护以及改善学习记忆等作用。文献报道,赤芍根提取物对乙酰胆碱所致大鼠气道平滑肌痉挛有拮抗作用,说明其可能具有抗胆碱作用[8]。
本实验结果显示,用酸枣仁、苦参、赤芍、丹皮等草药配伍制成的中药合剂可抑制大鼠旋转刺激诱导的异食高岭土行为;抑制旋转刺激在豚鼠诱导的前庭-眼反射即抑制眼震,包括减少眼震次数,抑制慢相速度;在毕格犬延长旋转刺激诱发的呕吐潜伏期。表明该药能抑制前庭刺激诱发的运动病,且具有一定的剂量依赖关系,这与人体实验结果吻合。中药合剂的抗运动病效果与阳性对照药茶苯海明类似。根据文献报道酸枣仁、苦参、赤芍、丹皮的药理作用,我们推测可能其中所含活性成分通过抑制前庭等中枢、改善脑缺血、抗胆碱作用参与发挥了其抗运动病效果。
为了阐明该中药合剂的抗运动病作用机制,研究从内分泌改变的角度进行了深入的探讨。许多研究提示,运动病时伴随有应激反应。应激是机体受到强烈刺激后发生的,以下丘脑-垂体-肾上腺皮质轴功能增强为主要特点的非特异性反应。此时,下丘脑大量分泌以CRH和AVP为主的生物活性肽,垂体前叶分泌促肾上腺皮质激素,肾上腺皮质分泌大量的糖皮质激素;此外,交感神经和肾上腺髓质轴活动也有所增强,儿茶酚胺释放增加。上述激素加上其它神经肽的协同作用,共同调节心血管系统、免疫系统和能量代谢系统等功能活动。这样,机体在紧急情况下通过改变内环境来适应外界变化。我们从本实验大鼠受旋转刺激后内分泌指标的变化结果来看,运动病也是一种应激反应,因为,旋转刺激后HPA轴激活,CRH、ACTH、Cort分泌增加,同时血浆AVP水平也明显升高。已有研究证明,静脉或脑室内应用AVP可诱导呕吐[9],内分泌因素与恶心、呕吐有一定的联系[10]。
大鼠经灌胃使用中药合剂后,本研究发现旋转刺激诱导的HPA轴激活受到抑制,血浆 CRH、ACTH、Cort水平的升高不再像模型组那样明显,同时AVP水平的升高也受到明显抑制。这些结果与阳性对照药茶苯海明的作用相同。因此,本研究结果表明,中药合剂有抑制旋转刺激诱导的内分泌变化的作用,即药物在一定程度上降低了大鼠对旋转刺激的应激反应。从现有研究资料来看,运动病与应激的关系,以及抗运动病药物对应激反应的影响与抑制运动病的内在联系,仍需进行深入细致的研究才能解明。
综上所述,本研究结果表明:(1)所用中药合剂可以有效地抑制运动病的发生;(2)中药合剂可抑制旋转刺激引起的血浆HPA轴激素和AVP水平的升高。
[1]Herron D G.The ups and downs of motion sickness[J].Am J Nurs,2010,110(12):49-51.
[2]Heer M,Paloski W H.Space motion sickness:incidence,etiology,and countermeasures[J].Auton Neurosci,2006,129(1-2):77-79.
[3]Kohl R L,Leach C S,Homick J L,et al.Motion sickness susceptibility related to ACTH,ADH andTSH[J].Physiologist,1983,26:S117-118.
[4]邱晓霞,姜正林,周维钅容,等.大鼠运动病敏感性与血浆皮质酮、促肾上腺皮质激素水平关系[J].中华航海医学与高气压医学杂志,2005,12(1):22-25.
[5]李 霞,姜正林,王国华,等.大鼠运动病敏感性性别差异与血浆和垂体中AVP水平及垂体V1b受体表达水平的关系[J].中国应用生理学杂志,2007,23(1):35-40.
[6]Li X,Jiang Z L,Wang G H,et al.Plasma vasopressin,an etiologic factor of motion sicknessin rat andhuman[J].Neuroendocrinol,2005,81(6):351-359.
[7]Holtman S,Clarke A H,Scherer H,et al.The anti-motion sickness mechanism of ginger.A comparative study with placebo and dimenhydrinate[J].Act Otolaryngol,1989,108(3-4):168-174.
[8]Ghayur M N,Gilani A H,RasheedH,et al.Cardiovascular and airway relaxant activities of peony root extract[J].CanJ Physiol Pharmacol,2008,86(11):793-803.
[9]Ikegaya Y,Matsuki N.Vasopressin induces emesis in Suncus murinus[J].Jpn J Pharmacol,2002,89(3):324-326.
[10]Otto B,Riepl R L,Klosterhalfen S,et al.Endocrine correlates of acute nausea and vomiting[J].Auton Neurosci,2006,129(1-2):17-21.
