促红细胞生成素对血管性痴呆大鼠海马CA1区胆碱乙酰转移酶的影响
2012-08-22黄树其牛富生邵福源
黄树其 牛富生 邵福源
(第二军医大学附属长征医院神经内科,上海 200003)
血管性痴呆(VaD)是老年期痴呆的重要病因。有研究表明痴呆的发生过程中除脑结构发生病理改变外,脑内与学习记忆过程相关的神经递质及酶类〔如乙酰胆碱(Ach)、胆碱乙酰转移酶(ChAT)等〕的代谢也发生异常〔1〕。ChAT被认为是与学习记忆相关的脑内神经递质ACh的促进代谢生成酶,在记忆相关脑区的含量高低与学习记忆能力呈正相关〔1〕。
近年国外研究发现,中枢神经系统在缺血缺氧状态下促红细胞生成素(EPO)分泌增多,并被证实是脑组织对缺血缺氧的保护性机制;EPO还可以改善VaD大鼠以及脑缺血后认知功能障碍〔2〕,但是具体机制并不清楚,推测ChAT可能在EPO改善VaD大鼠认知功能障碍过程中起到一定作用。因此,本研究观察VaD大鼠海马CA1区ChAT蛋白含量以及ChAT mRNA表达水平的变化,以确定ChAT在EPO改善VaD大鼠认知障碍中的作用机制。
1 材料与方法
1.1 实验动物 月龄超过16个月的Wistar大鼠,体重(296±35)g,雌雄不限(购自上海市BK实验动物公司),用Y型迷宫训练筛选符合标准〔3〕大鼠86只进行实验。
1.2 实验试剂与仪器 重组人EPO(rhEPO,沈阳三生制药股份有限公司),一抗(ChAT兔抗大鼠血清)、即用型SABC试剂盒、RT-PCR试剂盒均购自武汉博士德公司,总RNA抽提试剂盒(华舜生物工程公司),引物由上海捷倍思基因技术有限公司设计合成。MG-3型Y-迷宫(张家港生物医学仪器厂),立体定位仪(美国ASI公司),MP120电子天平(上海第二天平仪器厂),YL-3型石蜡切片机(上海仪表厂),CH型光学显微镜、BX60显微照相机(日本Olympus公司),PCR仪(美国Beckerman公司),DY-A型电泳仪、Flous-S multiImage图像分析系统(美国BIO-RAD公司),紫外透射分析仪(上海长明光学电子仪器厂)。
1.2 方法
1.2.1 VaD模型制作
1.2.1.1 侧脑室套管埋植术 参照Paxinos及Wistar鼠脑图谱〔4〕,借助PF5-48立体定位仪,用微型电动颅钻钻孔,将外径为0.5 mm的不锈钢导引管插入左侧脑室(AP 1.0 mm,L 1.5 mm,H 3.0 mm),用502黏合剂和牙托粉固定于颅骨上,在引导管内插入外径为0.3 mm的不锈钢内管,其尖端比引导管长1 mm,另一端和微量注射器相连。术后连续肌注抗生素1 w以抗感染。
1.2.1.2 VaD模型的建立 参照Olsson等〔5〕方法,以水合氯醛经腹腔麻醉后行颈正中切口,仔细分离肌肉,钝性分离暴露双侧颈总动脉,其下置7号手术线,注意避免刺激迷走神经,小心结扎双侧颈总动脉,缝合伤口。VaD模型的验证方法参照文献〔2〕。
1.2.2 分组 将86只Wistar大鼠随机分为4组。假手术组(Sham组):健康大鼠18只,经手术分离双侧颈总动脉,埋线后不结扎而将手术线抽出,然后缝合伤口。除假手术组外均按1.2.1.2方法成功造模。VaD组:21只,EPO侧脑室注射+VaD组(E1组):26只,侧脑室套管埋植术成功1 w后造模,从侧脑室注射 rhEPO,剂量为200 IU/kg,3次/w。EPO腹部皮下注射+VaD组(E2组):21只,造模后腹部皮下注射 rhEPO 1 250 IU/kg,3次/w。实验中保持温度恒定。
1.2.3 免疫组化检测ChAT的表达 分别在术后4、8、12 w各随机取3只大鼠,10%乌拉坦(1 g/kg)麻醉后打开胸腔,将右心房剪开,行左心室插管,经升主动脉快速灌注37℃生理盐水约500 ml,然后快速灌注4%多聚甲醛溶液(pH7.4)约250 ml,其间大鼠出现全身抽搐时将大鼠首尾拉直,之后减慢灌流速度,在1 h内再灌注约250 ml 4%多聚甲醛灌注液,此时大鼠全身僵硬。灌注完毕后立即取出脑组织置于充满灌注液的小瓶中,行石蜡包埋。将石蜡包埋的组织块作连续切片,厚度为4μm,并置于60℃烤箱中烘干后备用。取充分显示海马区的切片行免疫组织化学染色。将切片脱蜡至水化;然后经100%二甲苯Ⅰ、Ⅱ溶液浸泡各5 min,蒸馏水冲洗;无水乙醇1 min,95%酒精1 min,85%酒精1 min,75%酒精1 min,蒸馏水冲洗2 min;将样本置于磷酸盐缓冲液(PBS)中漂洗3×3 min,每片样本滴加封闭液(过氧化物酶阻断液)50μl,并在室温下孵育10 min,以阻断内源性过氧化物酶的活性,吸去封闭液,PBS洗3×3 min。加50μl正常非免疫动物血清,室温下孵育10 min;除去血清,加入抗体稀释液配制的最佳稀释度的第一抗体工作液(1∶100兔抗大鼠ChAT抗体),于湿盒中4℃ 过夜;次日用PBS洗3×3 min,每片加抗体稀释液配制的生物素标记的第二抗体工作液,于室温湿盒温育1 h;用PBS洗3×3 min,每片加链霉素抗生物素-过氧化物酶溶液50μl,于室温下孵育10 min;用PBS洗3×3 min。每片加100μl新鲜配制的二氨基联苯胺(DAB)溶液,显微镜下控制显色,显色完成后用0.1 mol/L PBS(pH7.4)终止反应;切片经过梯度酒精脱水干燥,二甲苯透明,中性树脂封固。定量分析计数方法:每张切片在海马的锥体细胞层,分别选择6个相邻视野,在15×10倍光镜下做免疫反应阳性神经元计数,计数方法采用标准网格,以“/0.9 mm2”为单位,结果取平均值。
1.2.4 RT-PCR检测ChAT mRNA的表达 分别在4、8、12 w各组随机取3只大鼠,20%乌拉坦(1g/kg)腹腔注射麻醉后用断头法处死,在冰浴中快速分离出双侧海马CA1区,置于冻存管中液氮保存;然后按照总RNA提取试剂盒说明书进行海马组织总RNA提取、定量;分别取各组海马组织总RNA抽提液1.0μg加至eppendorf管,按照逆转录试剂盒说明书操作,依次加入 dNTP(10 mmol/L)5 μl,MgCl2(25 mmol/L)10 μl,10 ×buffer 5 μl,RNase Inhibitor(40 U/μl)1 μl,AMV RTase XL(5 U/μl)1 μl,AMV-Optimized Taq(5 U/μl)1 μl,ChAT 上、下游引物各1 μl,β-肌动蛋白(β-actin)上、下游引物各 1 μl,加灭菌去离子水至50μl。以β-actin引物作为内对照,配制内对照反应体系,以双蒸水代替模板RNA作为阴性对照。混匀后加石蜡油50μl,再将各反应管同时置于同一PCR扩增仪中,PCR条件为:50℃,30 min;灭活逆转录酶并初步激活PCR反应:94℃,2 min;94℃变性30 s,60℃退火 30 s,72℃ 延伸 1 min,共 28 个循环,最后反应终止于72℃ 10 min。β-actin上游引物为5'CCTCTATGCCAACACAGTGC 3',下游引物为5'GTACTCCTGCTTGCTGATCC 3',产物大小为211 bp。ChAT上游引物为5'CAGAAGAGCAGTATCATGCCCGA3',下游引物为 5'TCCAGGCATACCAGGCAGATGCAG 3',产物大小为296 bp。PCR扩增产物用1.5%琼脂糖凝胶电泳分析,电泳结果用Flous-SmutiImager生物电泳图像分析系统进行图像分析,记录每条谱带的面积灰度值,以每例组织电泳带面积灰度值/β-actin电泳带面积灰度值的比值作为该标本目的基因表达的相对值。
1.3 统计学方法 应用SPSS16.0统计软件进行分析,测定值以x±s表示,采用方差分析进行假设检验,两组间采用直线相关分析,相关系数采用t检验。
2 结果
2.1 ChAT免疫组织化学染色结果 ChAT免疫反应阳性产物为神经元细胞质内棕褐色沉淀物。Sham组海马锥体细胞层和颗粒细胞层ChAT免疫阳性神经元最密集。术后4 w,VaD组、E1组和E2组大鼠海马CA1区ChAT免疫反应阳性神经元减少,与Sham组相比均显著降低(P<0.01),VaD组与E1组或E2组之间均存在显著性差异(P<0.05);术后8 w和12 w时,VaD组、E1组和E2组大鼠海马CA1区ChAT免疫反应阳性神经元数量进一步减少,VaD组比同期E1组或E2组的减少更为显著(P<0.01),但E1组与E2组海马CA1区ChAT免疫反应阳性神经元数目在各相应时间点均无显著差异(P>0.05)。术后4 w、8 w和12 w,VaD组、E1组和E2组大鼠海马 CA1区ChAT免疫反应阳性神经元计数与相应时间的全天总反应时间(TRT值)呈显著负相关:r=-0.869(P<0.05),与大鼠学习记忆能力呈正相关。由此可知,EPO上调VaD大鼠海马CA1区ChAT蛋白表达。见表1,图1。
2.2 ChAT mRNA表达结果 Sham组大鼠术后4 w、8 w和12 w海马CA1区ChAT mRNA相对表达量无明显差异;与Sham组相比,相应时间点,VaD组、E1组和E2组大鼠海马CA1区ChAT mRNA的相对表达量均显著减少(P<0.05或P<0.01);但E1组与E2组大鼠ChAT mRNA的相对表达量在各相应时间点均无显著差异(P>0.05)。见表2,图2。
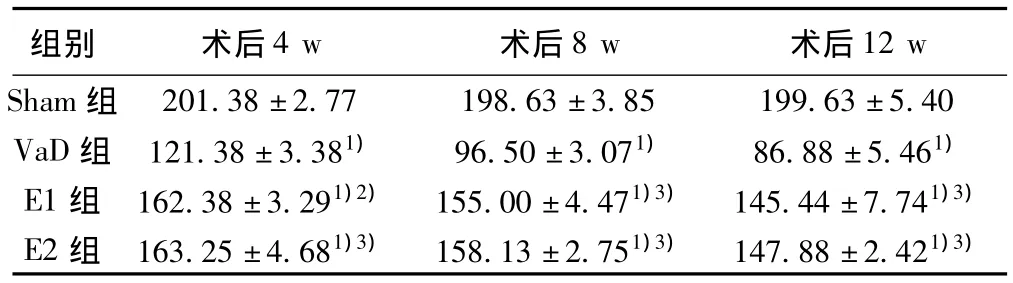
表1 不同时间点海马CA1区ChAT免疫反应阳性神经元比较(x ± s,n=3)
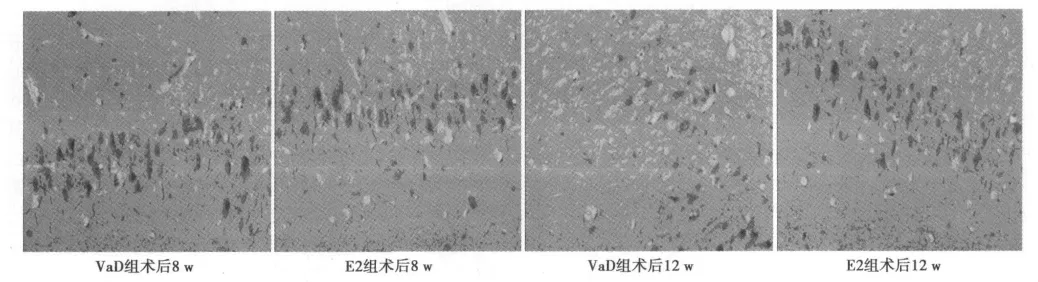
图1 不同时间点海马CA1区ChAT免疫阳性神经元(×400)
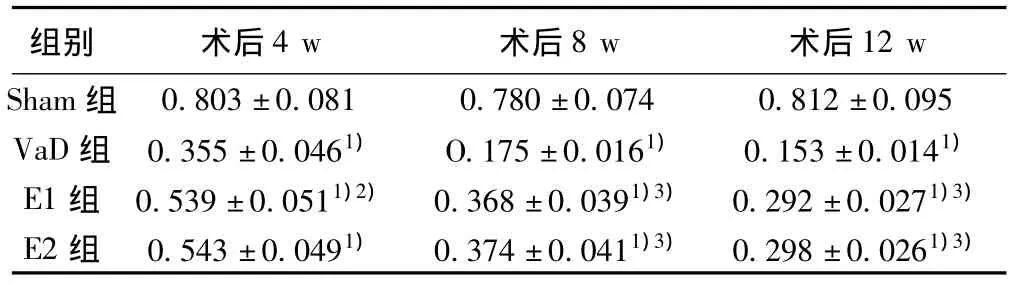
表2 不同时间点海马CA1区ChAT mRNA的表达(x±s)
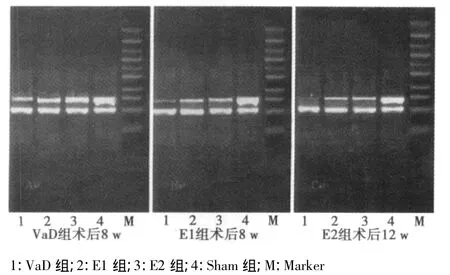
图2 不同时间点海马CA1区ChAT mRNA RT-PCR电泳图
3 讨论
ChAT为胆碱能神经递质乙酰胆碱合成的限速酶,分子量为60~70万,活性中心有咪唑基和巯基,与乙酰辅酶A结合使咪唑基乙酰化;然后,胆碱与ChAT活性中心的阴离子部位结合,将乙酰基转移到胆碱上,合成Ach。ChAT在胆碱能神经元胞体内合成,是胆碱能神经元的特殊标志,其活性变化能直接影响神经元内Ach的合成,从而影响正常神经元的功能,可以作为胆碱能神经元功能状态的明确标志。由于ChAT可合成Ach,而Ach具有促进学习记忆的生物功能,因此认为ChAT在脑内的含量高低与动物学习记忆功能呈正相关。而ChAT含量和活性高低与学习记忆相关的直接证据则来源于发现在AD病人大脑皮质和海马中,ChAT和AchE的活性明显下降,与正常同年龄对照组的脑组织相比ChAT大约减少50%~90%。这一发现随后又为许多实验室所证实,但因这些数据均来自尸检而受到质疑。后来在AD患者大脑活检标本中也观察到Ach合成能力和ChAT活性均降低,并且通过ChAT单克隆抗体免疫组化发现AD病人受损的内侧前脑Meynert核细胞含有ChAT的细胞。因此,目前公认基底前脑ChAT活性下降是AD的一个重要的生化改变。有研究发现,AD病人的认知功能衰退与脑神经ChAT活性及ChAT阳性纤维数量与老年斑增多具有相关性〔6〕,AD病人ChAT活性明显低于正常对照组,并且与病人死前简易精神状态量表(MMSE)得分存在相关性〔7〕。这些研究证明了ChAT含量与痴呆病人的认知功能衰退存在直接的因果关系,因而本实验选取ChAT作为的研究对象。
1997年美国慢性肾脏病诊疗(DOQI)指南规定rhEPO的用量:皮下注射为每周80~120 IU/kg,静脉给药为每周 120~180 IU/kg;1999年欧洲指南规定为每周50~150 IU/kg。而目前文献报道 rhEPO剂量从 375 IU/kg,2次/w~700 IU/kg,3次/w不等。多数作者研究表明,rhEPO剂量<300 IU·kg-1·w-1难以奏效,故目前多数学者建议最适剂量为500~750 IU·kg-1·w-1。根据熊远珍〔8〕计算的人和实验动物按体表面积折算的单位重量用药量换算系数,大鼠腹部皮下注射rhEPO用量应为1 250 IU/次,故本研究选择侧脑室200 IU·kg-1·次-1和腹部皮下1 250 IU·kg-1·次-1,3次/w注射。本次研究发现侧脑室和腹部皮下注射两种给药方式并无显著性差异。
本研究发现,VaD大鼠海马CA1区ChAT蛋白及mRNA表达均下降,且下降程度随时间延长逐渐加重,与文献报道相符〔9〕。VaD大鼠海马CA1区ChAT缺乏导致Ach的合成减少,可能是导致大鼠空间辨别及学习记忆能力下降的重要原因。ChAT表达下降的原因可能与脑血流减少引起合成原料(乙酰CoA和分子氧)的供给不足有关。本实验中,EPO组(E1组和E2组)大鼠海马CA1区ChAT蛋白和ChAT mRNA表达较Sham组明显下降,但在4 w、8 w和12 w时与同期VaD组比较显著增加,提示EPO能使VaD大鼠海马CA1区ChAT含量增加,这可能是EPO改善VaD大鼠认知功能障碍的机制之一。EPO改善VaD大鼠认知功能障碍的机制还有可能与海马CA1区神经细胞、海马CA1区神经突触的可塑性及抑制兴奋性氨基酸的毒性作用等有关,尚需进一步研究。
1 Kilgard M.Cholinergic modulation of skill learning and plasticity〔J〕.Neuron,2003;38(5):678-80.
2 黄树其,邵福源.促红细胞生成素对血管性痴呆大鼠认知功能的影响〔J〕.医学临床研究,2006;23(5):653-5.
3 Liu JI,Chen SP,Gao YH,et al.Effects of repeated electroacupuncture on β-endorphin and adrencorticotropic hormone levels in the hypothalamus and pituitary in rats with chronic pain and ovariectomy〔J〕.Chin JIntegr Med,2010;16(4):315-23.
4 包新民,舒斯云.大鼠脑立体定位图谱〔M〕.北京:人民卫生出版社,1991:32.
5 Olsson Y,Brun A,Engiuund E.Fundamental pathological lesions in vascular dementia〔J〕.Acta Neurol Scand Suppl,1996;168:31-8.
6 Buttini M,Yu GQ,Shockley K,et al.Modulation of Alzheimer's-like synaptic and cholinergic deficits in transgenic mice by human apolipoprotein E depends on isoform,aging,and overexpression of amyloid beta peptides but not on plaque formation〔J〕.JNeurosci,2002;22(24):10539-48.
7 Minger SL,Honer WG,Esiri MM,et al.Synaptic pathology in prefrontal cortex is present only with severe dementia in Alzheimer disease〔J〕.J Neuropathol Exp Neurol,2001;60(10):929-36.
8 熊远珍.实验动物与人用药量的新换算〔J〕.江西医学院学报,1997;37(4):41.
9 Gottfries CG,Blennow K,Karlsson I,et al.The neurochemistry of vascular dementia〔J〕.Dementia,1994;5(3-4):163-7.
