衰老相关基因Klotho在小鼠心脏表达的增龄性变化
2012-08-22王贵华孙梅芹杨大春杨永健侯言彬邓珏琳
王贵华 汪 汉 孙梅芹 彭 柯 唐 兵 杨大春 杨永健 张 鑫 侯言彬 邓珏琳
(成都军区总医院心血管内科,四川 成都 610083)
Klotho基因与衰老和窦房结功能密切相关,三者之间可能存在一定关联,但具体的分子生物学机制尚不明确〔1~4〕,阐明心脏Klotho基因表达有助于进一步研究其在窦房结的功能,为病态窦房结综合征(病窦)开辟新的治疗途径。鉴于小鼠出生后心脏Klotho基因表达的增龄性变化尚未见报道,本研究拟采用实时荧光定量聚合酶链反应技术(RT-PCR)检测不同日龄小鼠心脏Klotho基因表达的变化,探讨昆明小鼠Klotho基因的表达及其在心脏的确切定位,研究Klotho基因与心脏生长发育和窦房结之间的关系。
1 资料与方法
1.1 实验动物 1、120 d和540 d昆明小鼠各15只,2、4、7、15、30、60、180、270 d 和 360 d 昆明小鼠各 10 只,雌雄各半,昆明小鼠购自四川省医学科学院实验动物中心(批号:A09-C57BL-1021)。
1.2 PCR引物 登陆GenBank(Klotho ID:16591;Klotho mRNA:NM-013823.1)获得C57BL小鼠Klotho基因序列,由Premer 5.0软件设计特异性引物,PCR引物由上海生工生物工程有限公司合成,用无RNA酶无菌双蒸水配置成溶液,-20℃保存。
1.3 主要试剂及仪器 Revert Aid First Strand cDNA Synthesis Kit试剂盒,立陶宛MBI公司;Taq DNA聚合酶,北京博大泰克公司;dNTP:美国Promega公司;DNA分子量标准:北京TIANGEN公司;琼脂糖:法国BIOWEST公司;FTC2000实时荧光定量基因扩增仪:加拿大FUNGLYN公司;PE9600DNA扩增仪:美国PE公司;Gel Doc 1000:美国Bio-rad公司。
1.4 实验方法
1.4.1 昆明小鼠心脏组织总RNA的提取及鉴定 实验组:取1、2、4、7、15、30、60、120、180、270、360 d 和 540 d 昆明小鼠各10只,断颈处死,快速剪取整个心脏组织;取1、180、540 d昆明小鼠各5只,处死后快速取出心脏,切除右心房后,以余下的心脏组织作为阴性对照;并取出肾脏组织作为阳性对照。按Trizol RNA分离试剂说明书操作。进行总RNA完整性检验。
1.4.2 逆转录合成 cDNA Klotho引物序列:正义链:5'-GTACCTGGTTGCCCACAA-3';反义链:5'-CTTCGAGGATTGATCCAATG-3';探针序列:5'-CTCATGCCAAAGTCTGGCATCTC-3',产物长度129 bp。GADPH引物系列:正义链:5'-CCTCAAGATTGTCAGCAAT-3',反义链:5'-CCATCCACAGTCTTCTGAGT-3';探针序列:5'-FAM-ACCACAGTCCATGCCATCAC-TAMRA-3',产物长度141 bp。依据以上引物及探针序列,在PCR仪上操作。
1.4.3 Klotho mRNA的实时荧光定量PCR检测 依次进行实时荧光定量PCR的优化;对待测基因Klotho和管家基因GADPH,选择相应基因的cDNA模板进行PCR反应,确认PCR反应产物和测序;Klotho mRNA的实时荧光定量PCR检测。
1.5 统计学方法 采用SPSS13.0统计软件进行统计学分析。数据以x±s表示。多组之间采用方差分析检验,组间两两比较采用LSD方法检验。
2 结果
2.1 昆明小鼠心脏组织总RNA纯度与完整性鉴定 提取的总RNA样品经1%琼脂糖凝胶电泳后,在紫外灯下观察可见28、18、5 S三条亮度依此递减的清晰条带,泳道上无明显弥散痕迹,其中28 S与18 S条带亮度比值约为2∶1,无蛋白质和DNA污染。紫外分光光度计测定样品的OD260/OD280结果在1.7~2.0之间,可用于cDNA的合成。
2.2 小鼠Klotho和GADPH扩增产物的凝胶电泳鉴定 常规PCR扩增产物电泳鉴定:Klotho(129 bp)和GAPDH(141 bp)扩增片段经1.5%琼脂糖凝胶电泳,显示扩增得到大约130 bp左右的片段,清晰,无杂带,与设计的产物理论大小很相近。
鉴于Klotho基因主要在肾脏表达,特选取肾脏组织作为阳性对照,以切除右心房后的心脏组织作为阴性对照,不加模板cDNA作为试剂空白对照。电泳结果表明,昆明小鼠肾脏组织有Klotho基因mRNA表达,完整心脏可检测到Klotho基因表达,切除右心房的心脏组织未能扩增到相应产物;在小鼠肾脏组织和切除右心房的心脏组织,均可检测到内参基因GAPDH;试剂对照组泳道上没有明显条带,表明试剂没有污染。见图1。提示Klotho基因可能仅在右心房区域表达,在其他心房及心室不表达。
2.3 昆明小鼠心脏组织Klotho基因mRNA的表达 RT-PCR检测结果显示:1、2、4、7、15、30、60、120、180、270、360 和 540 d昆明小鼠心脏组织均可检测到Klotho基因的表达,其表达量分别为:1.086±0.258;1.134±0.275;2.021±0.534;2.580±0.584;2.270±0.680;2.460±0.572;3.196±0.541;6.232±0.549;6.128±0.325;5.867±0.545;4.356±0.263;3.182±0.561。结果表明在540 d内的昆明小鼠心脏Klotho基因mRNA基本呈持续表达状态。出生后第1天及第2天Klotho基因的表达量均较低,与4 d后的表达量有统计学意义(P=0.000);在4 d后,表达呈曲线波动,15 d时表达量降低,之后持续升高,直到120 d时,此时Klotho表达mRNA最高,与第60天(P=0.006)相比有统计学差异;180 d(P=0.081)、270 d(P=0.052)时的表达量与120 d时的表达量差异无统计学意义;540 d(P=0.000)、360 d(P=0.002)时的表达量与270 d时的表达量差异有统计学意义,表明270 d之后,Klotho基因在心脏组织的表达量呈下降趋势。
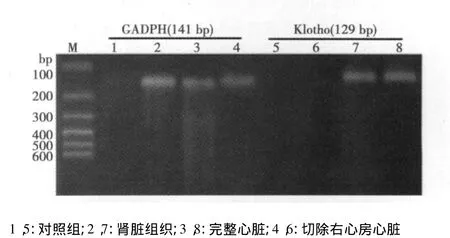
图1 小鼠Klotho和GADPH的表达
3 讨论
国外的研究〔4〕观测到Klotho基因在小鼠心脏的表达局限于右心房和上腔静脉交界处的心外膜下细胞内,这一区域恰好对应于窦房结区域,免疫组化及Western印迹证实小鼠心脏其他部位可能并不存在Klotho基因的表达,野生型小鼠和Klotho杂合小鼠过度运动后,后者窦房结恢复时间明显增长,让两种小鼠异种共生后,Klotho鼠的窦房结功能退化的症状也明显好转。最近亦有研究〔5〕认为Klotho基因通过影响其他组织细胞的Ca2+离子通道或其他细胞因子发挥其生物学作用。以上研究和我们的研究提示Klotho基因在维持窦房结功能中有重要作用,有可能是单独的Klotho基因通过调节K+、Ca2+或者Na+通道对窦房结功能进行作用。
针对Klotho基因在窦房结的研究〔4〕则表明Klotho基因可能仅在窦房结周围区域表达,且在应激状态下的窦房结起搏功能或者是窦房结功能异常与Klotho基因膜型mRNA表达有关。有研究表明实时荧光定量PCR较印记杂交可以检测到肾脏Klotho基因微量的表达,我们的研究运用荧光定量PCR,证实了在Klotho基因mRNA在右心房的表达在一定年龄范围内随增龄而增加,而超一定年龄范围却随增龄而减弱,这也许可以解释低于60岁的人群病窦的发病率极低的情况。
研究均认为窦房结的衰老自成年期开始,以后随着年龄的增长以及心肌缺血变化而发生结细胞退行性变缓慢的进行性加重,胶原纤维脂肪组织增生,在这个过程中与窦房结离子通道相关的基因如起搏电流基因的产物超极化激活的环核苷酸门控通道蛋白2、4均随增龄而表达呈衰减的趋势〔6〕;Xiao等〔7〕的研究发现,在10岁以前,人血清的分泌型Klotho蛋白水平较低,在30~40岁左右达到高峰,而后随着年龄的增加反而下降。这些研究都间接提示Klotho基因的表达可能不是一直呈递增或者递减的状态,与我们的研究结果相吻合。实际上Klotho基因敲除后的纯合子突变小鼠在应激情况下会出现固定心率减慢,窦性停搏,窦房传导阻滞,以及缓慢的交界性心律,直至完全性停搏。这些表现与病窦〔8〕极其相似,由此推测,Klotho基因突变小鼠可能能够成为病窦的一种模型小鼠,而多数研究认为病窦在50~79岁(即近乎人类老年期左右)之间为发病高峰期,联系到Klotho基因突变的小鼠,推测在小鼠的老年期,Klotho基因的表达可能是呈递减趋势的,而在老年期之前,Klotho基因的表达似乎是呈递增趋势渐至高峰,此前提及的研究〔7〕也证明了这一点。我们推测Klotho基因的峰型的表达可能会直接或者间接作用于起搏电流基因的产物超极化激活的环核苷酸门控通道蛋白2、4致使其表达量出现相应的改变,从而引起起搏电流的改变,导致病窦的产生。
1 Wang Y,Sun Z.Current understanding of klotho〔J〕.Ageing Res Rev,2009;8(1):43-51.
2 袁 丹,陈海平.抗衰老Klotho基因的功能及与人类疾病的关系〔J〕.中国老年学杂志,2010;30(14):2074-6.
3 Masuda H,Chikuda H,Suga T,et al.Regulation of multiple ageing-like phenotypes by inducible klotho gene expression in klotho mutant mice〔J〕.Mech Ageing Dev,2005;126(12):1274-83.
4 Takeshita K,Fujimori T,Kurotaki Y,et al.Sinoatrial node dysfunction and early unexpected death of mice with a defect of klotho gene expression〔J〕.Circulation,2004;109(14):1776-82.
5 Sopjani M,Alesutan I,Dërmaku-Sopjani M,et al.Regulation of the Na(+)/K(+)ATPase by klotho〔J〕.FEBSLett,2011;585(12):1759-64.
6 Yanni J,Tellez J,Sutyagin P,et al.Structural remodelling of the sinoatrial node in obese old rats〔J〕.J Mol Cell Cardiol,2010;48(4):653-62.
7 Xiao N,Zhang Y,Zheng Q,et al.Klotho is a serum factor related to human aging〔J〕.Chin Med J,2004;117(5):742-7.
8 Monfredi O,Dobrzynski H,Mondal T,et al.The anatomy and physiology of the sinoatrial node——a contemporary review〔J〕.Pacing Clin Electrophysiol,2010;33(11):1392-406.
