周期性张应力对人牙周膜细胞生物学活性的影响*
2012-08-22刘加强刘洪臣
刘加强 刘洪臣 房 兵 李 晋
人牙周膜成纤维细胞(human periodontal ligament fibroblast,hPDLF)对机械应力的适应性改建是正畸牙齿移动的生物学理论基础。在正畸牙齿移动过程中,牙周组织发生一系列的生理或病理性改变,包括成骨细胞和破骨细胞的活跃[1-2],各种细胞因子及炎性介质的表达增加,压力侧牙槽骨吸收,张力侧牙槽骨增生等等[3-5],最终使牙齿移动到新的位置达到矫治目的。其中牙周膜细胞活性的变化不仅是促进牙周组织改建的重要影响因素,也是影响牙周组织改建后稳定性的关键因素。本实验采用体外培养的hPDLF,对细胞施加不同强度的周期性牵张力,检测牵张力作用后hPDLF的总蛋白合成、碱性磷酸酶(ALP)活性、Ⅰ型胶原(Col-Ⅰ)和骨钙素(OCN)的分泌,探讨周期性牵张力对hPDLF活性的影响。
1.材料与方法
1.1 试剂和仪器 试剂:胎牛血清(Gibco,美国),DMEM 培养基(Gibco,美国),胰蛋白酶(Amresco,美国),乙二胺四乙酸(EDTA)(Amresco,美国),TritonX-100(Sigma,美国),BCA试剂盒(北京赛驰生物公司),羟脯氨酸试剂盒(南京建成生物公司),ALP活性检测试剂盒(南京建成生物公司)。
仪器设备 3111型孵箱(ThermoForma,美国),TGL-16G型高速台式离心机(安亭,上海),ELx800uv型酶联免疫检测仪(Bio-Tek,美国),温控超速离心机(Eppendorf,德国),TDZS-WS型自动平衡高速离心机(湘仪,湖南),FV500激光共聚焦显微镜(Olympus,日本),DMIL倒置相差显微镜(Leica,德国)。
1.2 hPDLF培养 经患者同意,取因正畸拔除的11-14岁患者的健康前磨牙,用含有1000U/L双抗(青霉素、链霉素)的PBS缓冲液冲洗后,无菌条件下刮取牙根中部1/3的牙周膜组织并剪成碎片,Ⅰ型胶原酶37℃水浴振荡消化1小时,轻轻吹打后离心。弃上清液,细胞沉淀用经DMEM洗涤后平铺接种于6孔培养板中,加入1.5mL含20%胎牛血清的DMEM培养基,置于恒温孵箱(5%CO2、95%空气、100%湿度、37℃恒温)中培养。72h后换液,以后隔日换液并观察细胞生长情况,细胞长至培养板底约80%时传代,标记为第1代。取5-8代细胞用于实验[6]。
1.3 实验方法
1.3.1 实验分组及其处理 取对数生长期细胞接种于6孔弹性培养板,密度为1×104个/孔,置于CO2恒温孵箱中培养。培养24h后换液去除不贴壁细胞,然后采用美国Flexercell细胞加力装置对细胞施加周期性牵张力,本实验共分4组,根据预实验及参考文献[7-8],我们分别采用强度为6%、12%、20%细胞表面拉伸率的周期性牵张力作用于细胞,频率为拉伸5s,松弛5s,即6周期/min,作用时间为24s,并采用不加力组作为对照,共4组,每组6个样本。
1.3.2 周期性牵张力对hPDLF总蛋白合成的影响 收集各组细胞,弃去孔内液体,用PBS冲洗 3次,每孔加入0.5%的TrtonX-100裂解液150μL过夜后,按蛋白浓度试剂盒说明用酶标仪检测吸光度,根据标准曲线计算成总蛋白浓度(ug/mL)。
1.3.3 周期性牵张力对hPDLF内ALP活性的影响 细胞加力后并裂解后,按ALP试剂盒说明用酶标仪检测吸光度,根据标准曲线计算ALP浓度(U/mgprot)。
1.3.4 周期性牵张力对hPDLF内Col-Ⅰ分泌的影响 细胞加力后,用细胞裂解液进行裂解,按羟脯氨酸试剂盒说明,用酶标仪检测吸光度,间接反映细胞Col-Ⅰ活性,根据标准曲线计算Col-Ⅰ浓度(ug/mgprot)。
1.3.5 周期性牵张力对hPDLF内OCN分泌的影响 细胞加力后,取上清液进行检测,200μL上清液加入200μL碘(125I)OCN放射免疫分析液和200μL的抗血清并充分混匀,4℃静置24h,加 1000μL分离剂并混匀,室温放置20min,4℃离心25min(3500rpm),吸弃上清,检测各组沉淀物中OCN水平(ng/mL)。
1.4 数据统计学处理 运用SPSS 13.0软件对所得数据进行方差分析,P<0.05为具有显著性差异。
2.结果
2.1 周期性牵张力对牙周膜细胞总蛋白合成的影响 与不加力对照组相比较,6%的拉伸率对细胞总蛋白合成没有影响(P>0.05),12%时开始下降(P<0.05),当达到20%时,对蛋白合成出现了显著的抑制作用(P<0.01)(表1,图1)。

表1 各组细胞总蛋白表达情况
2.2 周期性牵张力对牙周膜细胞ALP活性的影响 6%和12%的拉伸率对hPDLF的ALP活性无显著影响(P>0.05),当力值增至20%时,开始出现对ALP活性的抑制作用(P<0.05)(表2,图 2)。
2.3 周期性牵张力对牙周膜细胞Col-Ⅰ分泌的影响 6%表面拉伸率对hPDLF的Col-Ⅰ分泌无显著影响(P>0.05),12%-20%拉伸率对hPDLF的 Col-Ⅰ分泌有抑制作用(P<0.05),并呈浓度依赖性(表3,图3)。

图1 总蛋白表达情况

表2 各组细胞ALP活性

图2 ALP活性情况

表3 各组细胞Col-Ⅰ分泌情况
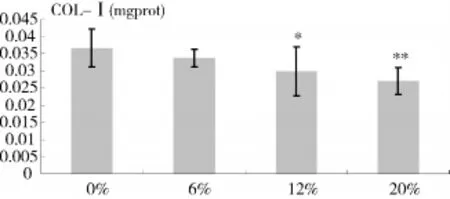
图3 Col-Ⅰ分泌情况
2.4 周期性牵张力对牙周膜细胞OCN分泌的影响 6%和12%的拉伸率对对hPDLF的OCN分泌无显著影响(P>0.05),20%的拉伸率对hPDLF内OCN分泌有抑制作用(P<0.05)(表 4,图 4)。

表4 各组细胞OCN分泌情况

图4 OCN分泌情况
3.讨论
牙周组织是人体改建最为活跃的组织之一,这与牙周组织担负咀嚼功能,承载咬合应力有关,牙周膜细胞活性,特别是在应力刺激状态下的活性高低直接关系到牙周组织的适应性改建能力以及牙周健康状况[9-10]。本实验中组织块在培养7-10d后可见周围有少量细胞爬出,15d左右可传代,传代后的细胞4-5d就能长满瓶底的80%,并且细胞生长旺盛,活力较高,纯度较高,适合本实验后续研究。
hPDLF总蛋白含量的变化能够反映出细胞功能的活跃程度。本实验结果表明,周期性张应力可以抑制细胞总蛋白的合成,并且呈浓度依赖性。但在6%表面拉伸率组,细胞总蛋白含量无明显变化,该牵拉强度不足以抑制细胞蛋白合成。随着张应力强度的进一步升高,其抑制蛋白合成的作用开始显现。周期性张应力一方面可以通过抑制细胞的增殖而使细胞总量下降,导致总蛋白分泌量下降,另一方面还可通过抑制hPDLF内多数酶的活性,又进一步抑制细胞总蛋白的合成。
ALP是hPDLF分化时分泌的酶,参与hPDLF的分化成熟,ALP活性的高低,能比较客观地反映hPDLF分化成熟的趋势。本实验结果表明,随着牵张力强度的增加,ALP的活性逐渐降低,并且呈浓度依赖性,说明细胞的分化能力逐渐减弱,细胞活性降低。但6%和12%表面拉伸率,都不足以影响ALP的活性。胶原是构成牙周膜基质的主要成分之一,在维持牙周组织的结构稳定和再生方面都起到重要作用。Col-Ⅰ占到骨有机基质90%以上,在细胞早期即开始分化,并随着基质的成熟而逐渐增加。本研究结果表明,6%表面拉伸率对hPDLF的Col-Ⅰ分泌无显著影响,12%-20%拉伸率可以呈强度依赖性抑制牙周膜细胞Col-Ⅰ的合成。说明较强的张应力能够破坏牙周组织结构的稳定性,这可能也是颌创伤的细胞生物学机制之一。
OCN是成骨样细胞成熟的特征性标志之一,成熟的hPDLF也可少量合成并分泌OCN,OCN释放到牙周组织中促进牙槽骨及牙骨质的矿化。本实验结果表明,6%和12%的拉伸率对对hPDLF的OCN分泌无显著影响,20%的拉伸率对hPDLF内OCN分泌有抑制作用,说明较强的张应力也可影响到牙槽骨及牙骨质的矿化,甚至导致骨吸收。
综上所述,周期性张应力可以使hPDLF的多项活性指标受到明显抑制[11],并且多数呈强度依赖性。但所有指标在6%表面拉伸率时均未受到影响,说明一定强度范围内的张应力作用不会影响到牙周膜细胞的活性,这也是牙周组织能够承担一定咬合应力的生物学基础。因此,临床上合理掌控正畸力值的大小显得非常重要,恰当的正畸作用力不仅能够使牙齿移动,还能保证牙周膜细胞活性,促进牙周组织改建以及正畸疗效的稳定
[1]Proff P,R?mer P.The molecular mechanism behind bone remodelling:a review[J].Clin Oral Investig,2009,13(4):355-362
[2]Xie R,Kuijpers-Jagtman AM,Maltha JC.Osteoclast differentiation and recruitmentduring early stages of experimental tooth movement in rats[J].Eur J Oral Sci,2009,117(1):43-50
[3]Olson C,Uribe F,Kalajzic Z,et al.Orthodontic tooth movement causes decreased promoter expression of collagen type 1,bone sialoprotein and alpha-smooth muscle actin in the periodontal ligament[J].Orthod Craniofac Res,2012,15(1):52-61
[4]Monnouchi S,Maeda H,Fujii S,et al.The roles of angiotensin II in stretched periodontal ligament cells[J].J Dent Res,2011,90(2):181-185
[5]Wasilewska A,Rybi-Szuminska AA,Zoch-Zwierz W.Serum osteoprotegrin(OPG)and receptor activator of nuclear factor kappaB(RANKL)in healthy children and adolescents[J].JPediatr Endocrinol Metab,2009,22(12):1099-1104
[6]刘加强,刘洪臣,冯 元,等,Caspase信号转导通路在高糖引发牙周膜细胞凋亡中的作用[J].中华老年口腔医学杂志,2011,9(1):3-6
[7]Jiaqiang Liu,Yi Wang,Xiao Yuan,et.al.Cyclic-stretch inducestheapoptosisof myoblast by activation of Caspase-3 protease in a magnitude-dependent manner[J].Int J Biochem Cell Biol,2010,42(12):2004-11
[8]Jiaqiang Liu,Jing Liu,Xiao Yuan,et.al.Caspase-3 Mediated CyclicCtretch-Induced Myoblast ApoptosisVia a Fas/FasL-independent Signaling Pathway During Myogenesis[J].Journal of Cellular Biochemistry,2009,107(4):834-844
[9]刘洪臣,布静秋.老年人常见的口腔疾病[J].中华老年口腔医学杂志,2008,6(4):I0017-I0019
[10]Saito M,Tsuji T.Extracellular matrix administration as a potentialtherapeutic strategy for periodontalligament regeneration[J].Expert Opin Biol Ther,2012,12(3):299-309
[11]Ritter N,Mussig E,Steinberg T,et al.Elevated expression of genesassigned to NF-kappaB and apoptotic pathwaysin human periodontal ligament fibroblasts following mechanical stretch[J].Cell Tissue Res,2007,328(3):537-548
