培养结合PCR检测生物制品支原体污染的研究
2012-08-21李书光陈金龙胡琳琳沈志强
张 娜,李书光,陈金龙,胡琳琳,沈志强
2.山东省滨州畜牧兽医研究院,滨州 256600
支原体是一类缺乏细胞壁的最小微生物,能在细胞培养中生长繁殖。目前支原体污染组织、细胞、疫苗的现象越来越严重,据统计,有36%~87%的细胞株被支原体污染[1-2],其中猪鼻支原体、口腔支原体、精氨酸支原体、发酵支原体、莱氏无胆甾支原体占全部污染的98%[3],其余的仅占2%。支原体污染严重时,宿主细胞特性发生变化,包括生长特性、酶结构、染色体及细胞膜成分并诱导细胞病变,影响细胞的功能和代谢[4]。因此,受支原体污染的细胞、组织等用于疫苗生产将产生不良后果。支原体检测方法主要有分离培养法、电镜法、血清学方法以及核酸探针法等,但都存在着种种不足[5],本实验应用传统培养和PCR技术相结合的方法,综合利用传统培养方法的精准和PCR检测方法的快速,大大提高了检测效率,又不失其精准度。
1 材料与方法
1.1 材料 鸡滑液囊支原体和猪鼻支原体购自中国兽医药品监察所,Taq DNA 聚合酶、DL2000、p MD-18T均购自大连宝生生物工程有限公司,改良Frey氏液体培养基和固体培养基、支原体液体培养基和固体培养基均参照《中国兽药典》制备。1.2 方法
1.2.1 PCR引物的设计与合成 根据GenBank中报道的支原体基因序列及其他细菌基因序列就行同源性比对分析,设计合成4条引物,Z-1,Z-2,Z-J和Z-Z。Z-1和Z-2一对引物参考倪红霞等[6],在此基础上补充2条下游引物Z-J和Z-Z,PCR扩增片段大小为280 bp左右。
1.2.2 检测样品总DNA的提取 检测样品为本公司所生产的不同批号和来源的各种疫苗半成品、成品,细胞株,血清等。取样品900μL,加入100μL 10%SDS和10μL protein K,55℃,水浴1 h后,酚氯仿抽提,沉淀用20μL灭菌水溶解,-20℃保存备用。
1.2.3 PCR反应体系 反应体系为25μL。10×PCR Buffer 2.5μL(Mg2+),2.5 mmol/L d NTPs 2 μL,25μmol/L引物各1μL,模板2μL,Taq酶0.5 μL,补水至总体积为25μL;95℃预变性5 min,94℃变性40 s,55℃退火40 s,72℃延伸1 min,扩增30个循环,最后延伸10 min。扩增后的PCR产物做1%琼脂糖凝胶电泳,在紫外光下分析扩增效果。1.2.4 检测样品中阳性产物的克隆和序列分析
使用DNA凝胶回收试剂盒回收280bp的目的片段,将回收的DNA与p MD18-T载体连接,连接产物转化感受态E.coliDH5α。阳性克隆菌液送上海生工生物有限测序,分析污染支原体的种类。
1.2.5 培养法和PCR相结合检测支原体污染方法的应用 参照《中国兽药典》检验方案进行培养法检测支原体污染,同时样品进行PCR检测。判定标准如下:若PCR检测结果为阳性,判定生物制品为支原体感染;若PCR检测结果为阴性,依培养法的结果为判定依据。
2 结 果
2.1 支原体标准株的PCR鉴定结果 我们用该引物扩增支原体标准株猪鼻支原体和鸡滑液囊支原体,结果显示,2种支原体在280 bp处均有特异性条带(图1)。将特异性产物回收、测序,测序结果显示,与猪鼻支原体和鸡滑液囊支原体的核苷酸同源性为100%。
2.2 培养法和PCR相结合检测支原体污染方法的应用 共检测生物制品样品224份,判定为阳性的份数为25份。PCR阳性产物克隆、测序,结果经Blast比对分析,我公司污染生物制品的主要是精氨酸支原体、口腔支原体和猪鼻支原体,为污染生物制品的常见支原体。
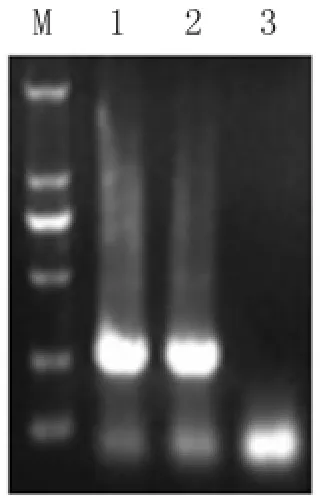
图1 鸡滑液囊支原体、猪鼻支原体的PCR扩增结果M:Marker 2000;1:猪鼻支原体;2:鸡毒支原体;3:空白对照Fig.1 The PCR results of Mycoplasma synoviae and Mycoplasma hyorhinisM:DL2000 Marker;1:Mycoplasma hyorhinis;2:Mycoplasma gallisepticum;3:Blank control
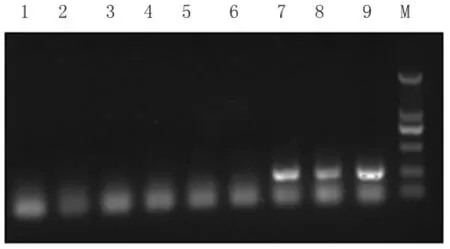
图2 部分样品的PCR检测结果1:空白对照;2-8:样品;9:阳性对照Fig.2 PCR results of some samples1:Blank control;2-8:Samples;9:Positive control
3 讨 论
Z-1,Z-2上下游引物由倪红霞等设计合成,特异性、灵敏度均较高,理论上可检测出近30种支原体,包括最常污染细胞的5种支原体,且对污染细胞的细菌无特异性,在此基础上补充2条下游引物,使该方法检测支原体的种类涵盖常见的生物制品支原体污染种类及生产中的弱毒和强毒。用该方法和传统培养法同步检测血清、疫苗、细胞株等样品224份,PCR检测出阳性25份,阳性率为11.2%,培养法检出阳性13份,阳性率为5.8%,这说明PCR方法比传统培养法灵敏、特异,且检测时间大大缩短。
目前,支原体检测方法比较多,最常用的是荧光染色法和培养法,荧光染色法具有检验样品的限制[7],而且因背景荧光的存在,使实验结果不准确。培养法作为检测支原体污染的经典方法,是其他各种检验方法的标准,具有不可替代性,但其也有自身的弱点,其检验周期较长,操作相对繁琐。我们进行检测时将培养法和PCR方法同步进行,为保证生物制品的纯粹判定。该方案综合利用PCR方法快捷和传统培养法精准的优势,提高支原体污染阳性样品的检出速度,保证支原体阴性样品检验的合格率,为各企事业单位的生物制品和细胞系支原体污染提供一个更为切实可行的方案。
[1]Drexler HG,Uphoff CC.Mycoplasmacontamination of cell cultures:Incidence,sources,effects,detection,elimination,prevention[J].Cytotechnology,2002,39(2):75-90.DOI:10.1023/A:1022913015916
[2]Yin QS,Ma LR,Wang BN.Design and universal primers for the PCR detection ofMycoplasmaand their clinical application[J].Chin J Zoonoses,2000,16(3):61-62.(in Chinese)
尹秋生,马立人,王北宁.支原体通用PCR引物的设计及在诊断的应用[J].中国人兽共患病杂志,2000,16(3):61-62.
[3]Chen L.Detection and elimination ofMycoplasmacontamination of cell cultures[J].Lett Biotechnol,1998,9(4):294-299.(in Chinese)
陈琳.细胞培养过程中支原体污染的检测和去除研究[J].生物技术通讯,1998,9(4):294-299.
[4]Jiang SD,Dai YX,Song RX,et al.Laboratory research in elimi-nation ofMycoplasmaof bovine serum[J].Yunnan Med,1993,3:52-54.(in Chinese)
姜述德,戴永祥,宋加仙,等.去除实验室牛血清中支原体的研究[J].云南医药,1993,3:52-54.
[5]Liu MJ,Zhang Y.Brief introduction ofMycoplasmadetection technology[J].Chin J Vet Sci Technol,2002,32(3):414-443.(in Chinese)
刘茂军,张映.支原体检测技术简介[J].中国兽医科技,2002,32(3):414-443.
[6]Ni HX,Chen LM,Zhang L.Species-specific PCR for identification of common contaminationMycoplasmain cell culture[J].J Beijing Univ(Nat Sci),2007,8(6):510-512.(in Chinese)
倪红霞,陈立梅,张雷.支原体种属特异性PCR引物的设计及对细胞培养物支原体的检测[J].北华大学学报(自然科学版),2007,8(6):510-512.
[7]Yu H,Du YF,Yan YB.Comparison of DNA fluorescent staining and cultivation used for detection ofMycoplasma[J].J Anhui Agri,2010,38(8):4039-4041.(in Chinese)
余华,杜永凤,严玉宝.DNA荧光染色法和培养法在支原体检测中的比较[J].安徽农业科学,2010,38(8):4039-4041
