抗球虫新药纳川珠利在大鼠肝S9中的代谢稳定性研究
2012-08-14李素梅张可煜王霄旸薛飞群
李素梅,张可煜,王霄旸,李 涛,薛飞群
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室 中国农业科学院兽药安全评价与兽药残留研究重点开放实验室,上海200241)
球虫病是鸡、火鸡、兔等畜禽的常见寄生虫,每年给养鸡业、养兔业造成巨大损失,三嗪类抗球虫药是当前预防和治疗球虫病较有效的药物[1]。然而,地克珠利(diclazuril)和妥曲珠利(toltrazuril)等药物由于长期使用,已经导致非常严重的耐药性问题[2-3]。纳川珠利是新型的三嗪类抗球虫药物,已有报道显示该药不仅具有良好的抗球虫效果,抗球虫指数(ACI)达185~200[4],与地克珠利、妥曲珠利等其他三嗪类化合物无交叉耐药性,且安全性好、毒副作用低,具有广阔的应用前景。作为国家一类新兽药开发的纳川珠利的代谢特征目前尚无相关研究报道。
肝脏是机体进行生物转化的主要场所,以肝脏为基础的体外代谢模型在药物代谢中应用广泛,其与体内代谢相比具有以下优点:①体外代谢可以排除体内诸多的干扰因素,直接观察代谢酶对底物的选择性代谢,为体内代谢的研究提供重要线索。②体外代谢具有快速简便的特点,适合大量化合物的药动学筛选。③试验过程中,无需消耗大量的样品和试验动物,降低了研究费用[5]。
研究药物体外代谢的方法主要有肝微粒体孵育法、肝细胞系孵育法、肝S9孵育法、原代肝细胞孵育法等。肝微粒体法因操作简易得到广泛应用,但其缺乏除CYP450及UGTs以外的其他代谢酶,可能导致某些代谢物的丢失;肝细胞系容易培养,但此类细胞不表达或仅少量表达相关代谢酶,这大大的限制了该系统的应用;原代肝细胞系统克服了代谢酶表达量少的问题,然而制备过程复杂,在初步筛选中较少运用。肝S9系统制备简便,且该系统所含的酶比肝微粒体更丰富,适合对药物体外代谢进行初步筛选[6]。本研究利用高效液相方法研究了纳川珠利与大鼠肝S9孵育的代谢稳定性及可能存在的代谢物[7-13],为进一步研究纳川珠利在体内的消除规律、确证代谢产物和指导临床合理用药提供依据。
1 材料与方法
1.1 材料
1.1.1 仪器 Waters 2690高效液相色谱仪,Waters 2487检测器,Thermo高速离心机,涡旋振荡混合器,上海凌初环保仪器有限公司生产;超纯水系统,上海瑞枫生物科技有限公司生产。
1.1.2 试剂 纳川珠利对照品(含量99.81%,批号20101210)为中国农业科学院上海兽医研究所动物药学研究室制,大鼠肝S9为Biology Toxicity产品,6-磷酸葡萄糖(G-6-P),6-磷酸葡萄糖脱氢酶(G-6-PD)辅酶Ⅱ(NADP)为Roche产品,色谱纯乙腈为Fisher产品,其他试剂均为分析纯。
1.1.3 对照品储备液和工作液的配制 精密称取纳川珠利对照品20mg,置于10mL容量瓶中以二甲基亚砜 (DMSO)溶解稀释至刻度,制成2mg/mL的对照品储备液。精确量取1mL储备液于10mL容量瓶中,以pH 7.5浓度为0.1mol/L的磷酸盐缓冲液稀释至刻度,得0.2mg/mL的工作液。
1.2 方法
1.2.1 孵育条件 试验组反应体系中肝S9蛋白浓度为2mg/mL,其中NADPH还原系统各组分含量如下:1mmol/L NADP、10mmol/L 6-磷酸葡萄糖、2U/mL 6-磷酸葡萄糖脱氢酶、7mmol/L MgCl2。该反应体系放入37℃水温箱,预孵育5min后,加入纳川珠利工作液50μL,反应体系终体积为0.5mL。对照组于反应体系预孵育5min后加入50μL 0.1 mol/L磷酸盐缓冲液(pH 7.5),其他均与试验组相同。取不同孵育时间的样品加入2倍体积的乙腈,混合涡旋终止反应。4℃、5 000r/min离心15min,取上清液经0.22μm微孔滤膜过滤后进样分析。
1.2.2 色谱条件 Dikma(2.0mm×150mm,5μm)C18色谱柱;柱温30℃;流动相为乙腈︰1 mL/L甲酸水=50︰50;流速为1mL/min;检测波长为300nm,进样量15μL。
1.2.3 方法专属性 按1.2.1处理方法,1.2.2色谱条件考察对照组与试验组在试验条件下的色谱行为,考察该方法的专属性。
1.2.4 纳川珠利溶液的稳定性 取50μL纳川珠利工作液加入450μL磷酸盐缓冲液中,置于37℃温箱48h后 ,加入1 000μL乙腈,混匀后经0.22μm微孔滤膜过滤后进样分析,考察纳川珠利在37℃下的稳定性。
1.2.5 工作曲线的制备 精密量取纳川珠利工作液,置于37℃ 预孵育5min后的大鼠肝S9反应体系中,配制成分别含0.5,1.0,2.0,5.0,10.0,20.0 μg/mL纳川珠利的系列样品,终体积为0.5mL,立即加入1mL乙腈混合,4℃、5 000r/min离心15 min,上清液经0.22μm微孔滤膜过滤后上样分析。以纳川珠利峰面积(Y)对其浓度(X)进行线性回归。
1.2.6 最低检测限 按照1.2.5分别配制并处理0.1、0.2、0.5mg/mL系列样品,1.2.2色谱条件考察最低检测限,即当S/N=3时的样品浓度。
1.2.7 回收率及精密度测定 选取0.5、2.0、20.0 μg/mL为高、中、低3个浓度为质控样品,按照1.2.5处理后进样,求方法回收率。分别按照测定方法每个浓度平行测定5个样品;并连续重复3d,计算日间日内精密度。
1.2.8 纳川珠利在大鼠肝S9的代谢稳定性 取0、0.5、1.0、2.5h时的孵育液,每个时间点设3个样品,每个样品测量3次,代入工作曲线回归方程,计算孵育液中纳川珠利的浓度。
2 结果
2.1 方法专属性
对照组与试验组色谱图显示纳川珠利的出峰时间为10.9min(图1B中2),且分离度良好,对纳川珠利的专属性好。同时,与对照组相比较,试验组色谱图监测到代谢产物1,其出峰时间为2.4min(图1B中1)
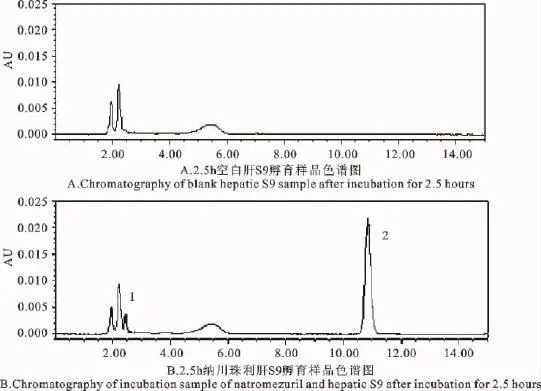
图1 对照组与试验组色谱图Fig.1 Chromatogram of the control group and the experimental group
2.2 纳川珠利溶液的稳定性
纳川珠利溶液置于37℃温箱48h后,按1.2.2测定纳川珠利的峰面积变化小于0.7%,结果显示药物在孵育环境中稳定。
2.3 工作曲线与最低检测限
纳川珠利峰面积(Y)对质量浓度(X)进行线性回归,得到纳川珠利在S9孵育体系中的线性方程为Y=48 529X+403.95R2=1.000,线性范围为0.5 μg/mL~20.0μg/mL,最低检测限为0.1μg/mL。
2.4 回收率及精密度
高、中、低3个浓度,每个浓度平行测定5个样品,并3d内重复3次的回收率及精密度如表1。结果显示其回收率在96%~101%之间,日内精密度低于2.3%,日间精密度低于5.6%,回收率及精密度良好,符合生物样品的测定要求。

表1 纳川珠利回收率及精密度试验结果(n=5)Table 1 The results of recovery and precision of natromezuril(n=5)
2.5 纳川珠利在大鼠肝S9的代谢稳定性
纳川珠利与大鼠肝S9孵育2.5h后约代谢了42%。0~1h内药物浓度从20.03μg/mL(C0)线性下降到15.07μg/mL(C),代谢符合一级反应的特征(图2)。以lnC/C0-t作线性回归,消除公式为:lnC/C0=-1.842t+7.264,R2=0.999 5,由公式K.t=lnC0/C;t1/2=ln2/K进一步计算可得反应速率常数K=0.004 719min-1,t1/2=146.88min。与纳川珠利的代谢消除对应的是0h~1h内代谢产物1亦呈线性增加,进一步利用色谱峰面积进行比较,发现代谢产物1的峰面积为纳川珠利孵育前后峰面积差的36%(图3)。

图2 纳川珠利在大鼠肝S9中代谢消除趋势Fig.2 Metabolic elimination tendency of natromezuril in hepatic S9
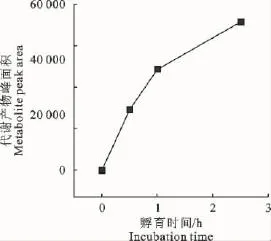
图3 纳川珠利代谢物的时间-峰面积图Fig.3 Time-peak area graph of the metabolite of natromezuril
3 讨论
本研究成功建立了大鼠肝S9孵育液中纳川珠利含量的检测方法,方法回收率高,高、中、低3个质控浓度下的回收率均大于90%,日内和日间精密度良好,符合生物样品的测定要求。
考虑到孵育时间过长,一方面会影响酶的活力,导致反应结果不具分析性;另一方面会导致样品变质,使得制备的工作曲线方程不适用于含量分析。因此本研究选取2.5h为孵育时间,发现0~1h范围内纳川珠利在大鼠肝S9孵育液中呈线性消除,符合一级反应的特征,反应速率常数K=0.004 719 min-1,t1/2=146.88min,表明该代谢系统对纳川珠利具有较弱的代谢能力,纳川珠利具有较高的代谢稳定性。本研究同时还监测到纳川珠利代谢产物1,其在0~1h内随纳川珠利浓度的下降而呈线性增加,约占纳川珠利药物代谢总量的36%。
本研究初步确定了纳川珠利在大鼠肝S9系统中具有较高的代谢稳定性,并监测到可能存在的代谢产物,为进一步鉴定纳川珠利的代谢产物及结构,研究纳川珠利在体内外的代谢和消除规律提供了科学依据。
[1] 索 勋,李国清.鸡球虫病学[M].北京:中国农业大学出版社,1998:166-167.
[2] 韩春来,王丽明,郑明学,等.鸡球虫的耐药性研究进展[J].畜禽业,2001(4):32-33.
[3] 金光明,程从升,顾有方,等.2株柔嫩艾美耳球虫对5种抗球虫药的抗药性[J].中国兽医学报,2003,23(1):40-41.
[4] 费陈忠,韩春周,林 洋,等.抗鸡球虫病的三嗪类新化合物纳川珠利的药效试验[J]中国兽药杂志,2010,44(7):11-12,31.
[5] 陈万平,孙 翔,程鹏远.体外药物肝代谢研究进展[J].第四军医大学学报,2008,29(9):861-863.
[6] Esther F.An update onin vitrotest methods in human hepatic drug biotransformation research:pros and cons[J].Toxicol Apll Pharmacol,2003(189):233-246.
[7] 姚彤炜,胡云珍.地非三唑在鼠肝微粒体中的体外代谢[J].中国药理学与毒理学杂志,2002,16(2):128-132.
[8] WU W N,Linda A.In vitro metabolism of the new anxiolytic agent,RWJ-52763in human hepatic S9fraction-API-MS/MS identification of metabolites[J].J Pharm Biomed Anal,2003,31:95-102.
[9] 栾连军,邵 青,曾 苏.高效液相色谱分离法测定大鼠肝微粒体中普洛萘尔葡醛酸化代谢产物[J].药学学报,2001,36(12):921-924.
[10] Vergote V,Dorpe S V,Premans K,et al.In vitro metabolic stability of obestatin:Kinetic and identification of cleavage products[J].Peptides,2008,29:1740-1748.
[11] 廖作庄,梁 钢,欧冰凝.表没食子儿茶素没食子酸酯体外代谢的方法研究[J].广西医学,2011,33(1):5-7.
[12] 崔升淼,赵春顺,高 坤,等.大鼠肝微粒体中葛根素的液相色谱-质谱测定法及药物代谢动力学[J].沈阳药科大学学报,2007,24(1:32-35.
[13] Huang J G,Si L Q,Fan Z Z,et al.In vitro metabolic stability and metabolite profiling of TJ0711hydrochloride,a new developed vasodilatoryβ-blocker,using a liquid chromatography-tandem mass spectrometry method[J].J Chromatography B,2011,879:3386-3392.
