MCAO大鼠梗死灶对侧皮层Nogo-A的动态变化及电针干预
2012-08-11梁艳桂吴海科万赛英王海侨王学文黄勋福韩福兰
梁艳桂, 谭 峰, 陈 杰, 吴海科, 万赛英王海侨, 王学文, 黄勋福, 韩福兰, 吴 强
目前,国内外急性脑梗死(acute cerebral infarction,ACI)的研究主要集中在如何减轻梗死灶局部神经损伤和增强周围组织的代偿能力方面,而对远隔病灶部位继发性损害极少关注。研究证实,ACI损害并不限于梗死灶局部,远隔部位也发生继发性损害,并阻碍神经功能的恢复[1,2]。我们的前期研究发现,Nogo-A参与ACI丘脑继发性损害,电针对高血压脑缺血损伤的保护作用可能与其下调神经抑制因子neurocan-mRNA与Nogo-A表达等机制有关[3~5]。但电针对ACI远隔损害有无影响?对Nogo-A抑制信号传导有何作用?能否通过调控Nogo-A抑制信号传导通路蛋白表达来减轻脑梗死远隔损害,促进CNS修复?这些问题还不清楚,国内外亦未见翔实的研究报道。本实验采用改良Zea Longa法制备大鼠大脑中动脉的缺血再灌注模型,应用免疫组织化学法及透射电镜技术观察电针对脑缺血再灌注大鼠脑梗死灶对侧皮层不同时期Nogo-A表达、细胞超微结构的影响,探讨电针促进神经功能修复的作用机制。
1 材料与方法
1.1 动物及分组 SPF级雄性SD大鼠130只,重(240±40)g,月龄3个月,由广东省实验动物中心提供,普通颗粒饲料和自来水喂养,室温控制在15℃ ~24℃。实验动物使用许可证号SCXK(粤)为2008-0002,实验动物质量合格证号为0065739。采用随机数字表法分为5组:电针组(30只)、假穴位组(30只)、模型组(30只)、假手术组(30只)和空白组(10只)。
1.2 试剂及仪器 兔抗大鼠 Nogo-A:Santa Cruz Biotechnology公司;SABC显色试剂盒:武汉博士德生物工程有限公司;多导生理记录仪:德国HU GO SACHSEL EKTONIK;JEM1200-EX型透射电镜:日本电子公司;显微镜:日本Olympus Ixto倒置显微镜;全自动图像分析仪:德国Kontron IBAS 2.0全自动图像分析系统;JVC ky-F30B 3-CCD彩色图像摄录输入仪。
1.3 MCAO模型制作 采用改良的Zea Longa法[6]制备左侧MCAO模型。用3%戊巴比妥钠(0.2 ml/100g)腹腔麻醉后,经颈部正中切口逐层分离组织,暴露和分离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(exterior carotid artery,ECA)和颈内动脉(interior carotid artery,ICA),结扎并游离ECA及其分支,沿ICA向下分离翼腭动脉(pterygopalatine artery,PPA)。于ECA残端起始部剪一小口,轻轻插入制备好的尼龙线,快到达PPA时,用镊子轻轻夹住PPA起始部,让尼龙线顺利进入ICA颅内段,尼龙线插入深度以CEA分叉处开始计算约为(18±0.5)cm。缝合皮肤。再灌注时外拉尼龙线使其球端回到ECA内即可恢复ICA和MCA的血供。术后单笼喂养观察(模型成功标准:参照文献[6]的方法,MCAO制模成功的标志为:大鼠在线栓后即出现左侧Horner综合征(左侧瞳孔缩小),麻醉清醒时出现右侧前肢或前后肢瘫痪。在规定缺血时限内(术后2~3h)未出现右侧肢体瘫痪或已经死亡的大鼠被剔除。再灌注成功的标准为线栓拔出后ICA和Willis环无血栓和出血)。动物死亡及时补充,保证每组动物数量。假手术组:只作颈总动脉分离,然后缝合皮肤,不作线栓处理。模型组:仅作MCAO缺血再灌注模型处理。电针组:缺血再灌注后每天给予电针治疗,按文献[7]方法定位大鼠督脉“百会、大椎”穴位。假穴位组(30只):缺血再灌注后每天选取督脉“百会、大椎”穴左侧旁开1cm处作电针治疗。空白组(10只):不作任何处理,一般喂养。
1.4 针刺及处理方法 选用30号1寸毫针,沿皮斜刺“百会、大椎”两穴,进针深度2~3mm。针柄接至G68051A针灸治疗仪电极上,复流后,通电留针30min,采用连续波,频率为3Hz,强度3V,以肢体抖动、但使动物不挣扎、嘶叫为度。电针1次/d,连续28d。假穴位组取督脉“百会、大椎”穴旁开1寸处作电针治疗,方法同上。假手术组、模型组、电针组和假穴位组大鼠分别于术后1d、7d、28d 3个不同时间点用3%戊巴比妥钠(0.2ml/100g)麻醉,经左心室向主动脉插管,灌注4℃生理盐水100ml,然后换用4℃ 4%多聚甲醛缓冲液100ml灌注,灌注后的动物开颅取脑,放于4%多聚甲醛溶液里浸泡固定24h。空白组大鼠则观察28d后用同样方法灌注固定后取脑检测。
1.5 观察项目及检测方法
1.5.1 Nogo-A采用免疫组织化学染色法(SABC法)。参照《大鼠脑立体定位图谱》[8]取缺血中心的大脑进行石蜡包埋,冠状切片,每个时间点的每只大鼠取5张切片,片厚3μm,按免疫组织化学染色步骤操作。对照实验:用PBS代替一抗进行实验。均采用阳性细胞记数法,在400倍光镜下选取梗死对侧皮层5个互不重叠的视野,每个时间点共计15个视野,用Kontron IBAS 2.0高清晰彩色病理图文分析系统,统计在400倍光镜下每个视野的单位面积阳性细胞数,将所得均数作为各组每个时间点的阳性细胞数。
1.5.2 神经元细胞形态及超微结构观察 分别于1d、7d及28d 3个时间点,从模型组、电针组和假穴位组中各随机抽取1只大鼠用3%戊巴比妥钠(0.2ml/100g)腹腔麻醉,迅速开胸,暴露心脏,左心室主动脉插管,快速灌注生理盐水100ml,然后用含4%多聚甲醛、2.5%戊二醛的磷酸盐缓冲液(PBS)100ml灌注固定30min。断头取脑,分别从左侧缺血区大脑皮层及对侧皮层相应部位各取组织块约1×1 ×1mm,放入4%多聚甲醛、2.5%戊二醛的0.1mol/L PBS溶液进行前固定3~4h;按常规电镜样品制备程序漂洗、脱水、浸透及环氧树脂包埋。超薄切片后,将切片捞至载网上干燥。透射电镜下观察切片上细胞形态及超微结构的改变并摄片。
1.6 统计学方法 采用SPSS13.0统计软件进行分析。所有计量资料均用均数±标准差()表示,组间比较采用单因素的方差分析。检验水准取α=0.05,以 P<0.05认为差异有统计学意义。
2 结果
2.1 电针对脑缺血再灌注大鼠不同时间点梗死灶对侧皮层神经元细胞形态及超微结构的影响空白组和假手术组大鼠脑皮层结构分明,神经元、胶质细胞及毛细血管等超微结构正常。模型组和假穴位组各时间点大鼠脑梗死灶对侧皮层呈现神经细胞胞体肿胀、细胞器水肿、核染色质轻度溶解、毛细血管内皮细胞肿胀、管腔狭窄等轻度病理改变,以缺血再灌注后第7天最明显,28d明显减轻。上述病理改变均较同期患侧皮层缺血区病变程度明显减轻,且不足以引起支配侧肢体神经功能缺失。电针组大鼠脑梗死灶对侧皮层神经元、胶质细胞及毛细血管等超微结构的改变均较同期模型组、假穴位组减轻。
2.2 电针对脑缺血再灌注大鼠不同时间点梗死灶对侧皮层Nogo-A表达的影响 免疫组织化学显示空白组和假手术组脑梗死灶对侧皮层Nogo-A阳性细胞呈基础表达,两组间比较差异无统计学意义(P >0.05)。模型组在 I/R 后1d、7d、28d各时间点大鼠脑梗死灶对侧皮层见Nogo-A阳性细胞表达反应性上调,7d最明显,28d后明显下降。电针组I/R后1、7d各时间点大鼠脑梗死灶对侧皮层Nogo-A阳性细胞表达量均低于同期模型组和假穴位组,差异有统计学意义(P<0.05);假穴位组与模型组同期对比差异无统计学意义(P>0.05)(见表1)。
表1 各组大鼠脑梗死灶对侧皮层Nogo-A阳性细胞数目比较(,n=9,个/cm2)
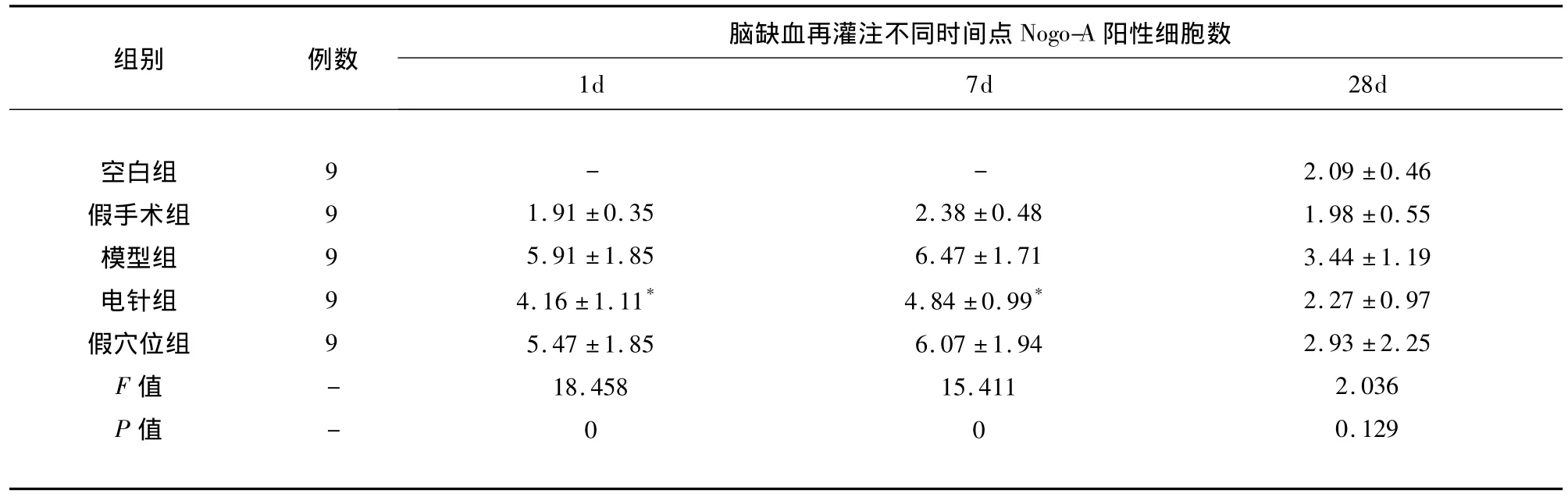
表1 各组大鼠脑梗死灶对侧皮层Nogo-A阳性细胞数目比较(,n=9,个/cm2)
与模型组、假穴位组同一时间点比较*P<0.05
脑缺血再灌注不同时间点Nogo-A阳性细胞数组别 例数1d 7d 28d空白组假手术组模型组电针组假穴位组F值P值99999---1.91 ±0.35 5.91 ±1.85 4.16 ±1.11*5.47 ±1.85 18.458 0-2.38 ±0.48 6.47 ±1.71 4.84 ±0.99*6.07 ±1.94 15.411 0 2.09 ±0.46 1.98 ±0.55 3.44 ±1.19 2.27 ±0.97 2.93 ±2.25 2.036 0.129
3 讨论
目前针对脑梗死的临床和实验研究主要集中在梗死灶及缺血半暗带神经组织的保护和修复,但疗效往往不尽人意。最近研究证实,ACI损害并不限于梗死灶局部,晚期由于远隔部位与梗死灶相联系的神经纤维出现华勒变性,导致远隔部位不可逆的进行性萎缩或变性,称之为远隔损害(secondary damage)。根据远隔损害的发生是脑梗死康复效果不理想、致残率高的重要原因之一,从而提出卒中治疗的新靶点[1,2]。
有关远隔梗死灶的脑组织发生继发性损害的确切机制尚未完全阐明,已有研究提示包括以细胞凋亡引起的迟发性细胞死亡、轴突退行性改变、神经营养障碍、神经生长抑制因子增加、局部脑血流量减少、神经递质调节失衡和蛋白合成抑制等为中心在内的多种因素参与其中[9~11]。
动物实验发现,大鼠大脑中动脉闭塞后远隔部位小脑皮质Nogo-A的表达明显升高,并发生继发性免疫损害[12]。肾血管性高血压大鼠(stroke-prone renovascular hypertensive rats,RHRSP)大脑皮层梗死后1~4w,梗死灶同侧丘脑的继发性损害与神经抑制因子Nogo-A增加有关,Nogo-A拮抗剂NEP1-40通过可对抗这种继发性损害而改善神经功能[5]。进一步地,我们在动物实验中也发现,RHRSP大脑皮层梗死后1~4w,梗死灶同侧丘脑、海马、中脑黑质及对侧脊髓前角神经元等远隔部位继发性损害与神经抑制因子 neurocan-mRNA 和 Nogo-A 有关[2~5]。
抗Nogo-A抗体能明显地增加未损伤的感觉运动皮层(SMC)来源的中线交叉的皮质脊髓束,并发出新的投射到患侧支配区,促进患肢功能恢复[13,14]。这表明Nogo-A参与ACI远隔损害,抑制神经再生。
本实验采用免疫组织化学法及透射电镜技术观察电针对脑缺血再灌注大鼠脑梗死灶对侧皮层不同时期Nogo-A表达、细胞超微结构的影响。结果显示,缺血再灌注后第1天,大鼠脑梗死灶对侧皮层可见Nogo-A阳性细胞表达呈反应性增多;第7天达到高峰,28d大致恢复到基础水平。透射电镜观察到脑缺血再灌注后各时间点大鼠脑梗死灶对侧皮层亦出现神经细胞胞体肿胀、细胞器水肿、核染色质轻度溶解、毛细血管内皮细胞肿胀、管腔狭窄等轻度病理改变。
上述病变程度均轻于病灶侧,且不足以引起支配侧肢体神经功能损伤。这提示与梗死灶坏死神经元有相关联系的对侧皮层神经元轴突也出现断裂、肿胀,随后发生髄鞘脱失、轴索溶解等华勒变性,同时伴随相关部位神经元丢失。此病理改变是否与Nogo-A动态变化相关?我们发现,电针治疗后,大鼠脑梗死灶对侧皮层Nogo-A的表达均低于同期假穴位组和模型组(P<0.05)。透射电镜显示电针组脑组织神经元、胶质细胞、毛细血管等超微结构的缺血性损伤均较假穴位组、模型组同期明显减轻。
由此可推测,Nogo-A参与梗死灶对侧皮层继发性损害,电针可减轻远隔损害与部分阻遏Nogo-A抑制性信号传导通路蛋白表达密切有关。其机制可能是电针在脑缺血早期通过稳定细胞内外离子浓度、抑制Ca2+内流、稳定神经递质的浓度等多种方式调节突触信号的传递,维持神经元的存活和促进神经突触的生长及抑制胶质瘢痕形成。而在后期少突胶质细胞主要以合成抑制因子和损伤因子为主,电针以双向调节的作用保护梗死灶对侧皮层少突胶质细胞及抑制少突胶质细胞的激活,减少突触抑制因子Nogo-A的合成和释放,阻断与其相关的抑制信号传导通路,从而减轻远隔部位的继发性损害。这为电针更好地治疗ACI患者、减轻ACI远隔损害、提升康复疗效提供了一定的理论依据。
[1]曾进胜.重视脑局部损伤后继发远隔部位损害的研究[J].中国神经精神疾病杂志,2007,33(12):705-706.
[2]李 蕃,张秀清.大脑中动脉供血区梗死的远隔损害[J].国际脑血管病杂志,2011,19(3):232-236.
[3]梁艳桂,谭 峰,陈 杰,等.电针对脑缺血再灌注大鼠皮层超微结构及Nogo-A表达的影响[J].中国中西医结合杂志,2012,32(2):224-228.
[4]谭 峰,万赛英,顾 卫,等.电针对高血压大鼠脑缺血后神经黏蛋白mRNA表达与细胞超微结构的影响[J].中国神经精神疾病杂志,2008,12(34):720-723.
[5]Wang F,Liang Z,Hou Q,et.al.Nogo-A is involved in secondary axonal degeneration of thalamus in hypertensive rats with focal cortical infarction [J].Neurosci Lett,2007,4(17):255-260.
[6]Zea Longa EL,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]李忠仁.实验针灸学[M].北京:中国中医药出版社,2004.327-329.
[8]George P,Charles W.The rat brainin stereotaxic coordinates[M].Academic Press,1998.25-27.
[9]熊 丽,余 剑,曾进胜,等.大脑皮层梗死后大继发鼠丘脑、中脑、脊髓和臂丛损害[J].中国神经精神疾病杂志,2008,34(1):1-5.
[10]Villa P,van Beek J,Larsen AK,et al.Reduced functional deficits,neuroinflammation,and secondary tissue damage after treatment of stroke by nonerythropoietic erythropoietin derivatives[J].J Cereb Blood Flow Metabol,2007,27(3):552-563.
[11]Onoue S,Kumon Y,Igase K,et al.Growth arrest and DNA damageinducible gene 153 increases transiently in the thalamus following focal cerebral infarction[J].Mol Brain Res,2005,134(2):189-197.
[12]孙广珍,车玉琴,窦文波,等.脑梗死后远隔部位小脑皮层Nogo-A 蛋白表达[J].免疫学杂志,2011,27(1):90-92.
[13]Peng XM,Zhou ZG,Hu J,et al.Soluble Nogo Receptor Down-regulates Expression of Neuronal Nogo-A to Enhance Axonal Regeneration[J].J Biol Chem,2010,28(5):2783-2795.
[14]Takei Y.Phosphorylation of Nogo receptors suppresses nogo signaling,allowing neurite regeneration[J].Sci Signal,2009,2(64):14.
