基底节区缺血性卒中患者初级运动皮层结构和功能连接相关性的fMRI研究
2012-08-11孟亮亮刘宁宁于春水
汪 洋, 张 敬, 林 琳, 孟亮亮, 刘宁宁, 秦 文, 于春水, 薛 蓉
脑卒中发病率逐年升高,其中运动功能障碍是致残的主要原因。研究显示急性缺血性卒中后,运动功能会有不同程度的恢复,但具体机制不详[1,2]。本研究选择运动功能恢复良好的慢性期基底节区缺血性卒中患者为研究对象,利用基于体素的形态学(voxelbased morphometry,VBM)分析方法,显示缺血性卒中所致的结构损伤;在此基础上利用静息态fMRI功能连接的分析方法,揭示结构损伤脑区功能连接变化,以此探讨缺血性卒中后运动功能恢复的神经机制。
1 对象与方法
1.1 研究对象 选取2006年1月~2010年6月我院神经内科就诊的缺血性卒中患者28例,男18例,女10例,年龄40~72岁,平均56.6±8.4岁,均为右利手,病程≥6个月,MRI证实基底节区单发梗死灶。参加本实验时患侧上肢Fugly-Meyer评分大于60分,提示运动功能恢复良好[3]。选取25名性别、年龄相匹配的健康对照,男14例、女11例,年龄47~72岁,平均56.8±6.9岁,均为右利手。所有被试均获知情同意,并签订知情同意书。
1.2 设备及成像方法 MRI扫描采用美国GE Signa HD-X 3.0T磁共振全身扫描仪及头部八通道相控阵线圈。扫描序列包括。
全脑高分辨率T1WI解剖像,3D BRAVO(3D BRAIN VOLUM)序列,扫描参数:TR7.8ms,TE 3.0 ms,FOV 256mm ×256mm,矩阵 256 ×256,层厚1.0 mm,0间隔,层数176层,扫描时间4min 5s。
静息态fMRI扫描,梯度回波单次激发回波平面成像(GRE-Single-shot EPI)序列,参数:TR2000ms,TE30ms,FOV240mm ×240mm,矩阵 64 ×64,层厚3.0mm,间隔 1.0mm,层数 38 层,采集 180 个时相,扫描时间7min 40s。
1.3 数据处理及统计分析 数据预处理前,采用Matlab 7.8软件将13例左侧基底节区的梗死灶翻转到右侧。这样就将右侧半球定义为患侧半球,左侧半球定义为健侧半球[4,5]。
1.3.1 VBM分析 采用SPM8软件对原始图像做配准、分割、平滑(6mm半高全宽高斯核)预处理。剔除原始图像中伪影较重以及配准结果较差的3例患者。采用两样本t检验比较缺血性卒中组和对照组灰质体积差异。受试者年龄、性别作为协变量,统计阈值为 P<0.05(False Discovery Rate Correction,FDR校正),大于连续200个体素的区域定义为有意义脑区,以灰质体积存在差异的脑区为感兴趣区(region of interesting,ROI),进行静息态功能连接分析。
1.3.2 静息态功能连接分析 先剔除静息态fMRI前10个时间点数据。然后采用SPM8软件进行预处理,包括时间、头动校正,去除头动>2mm和转动大于2°的2例患者和7例对照组数据。再进行空间标准化、空间平滑处理(6mm半高全宽高斯核)、去线性漂移、低频滤波(0.01 ~0.08Hz)。
采用REST软件,将VBM分析所得ROI与全脑做静息态功能连接分析。两样本t检验比较缺血性卒中组和对照组静息态功能连接差异。以年龄、性别作为协变量,采用随机效应模型进行分析,阈值为P<0.05(Alphasim校正),大于连续190个体素的区域定义为有意义脑。
2 结果
2.1 VBM分析结果 缺血性卒中组患侧半球初级运动皮层(M1区)、丘脑灰质体积较对照组减少(P <0.05)(见表1、图1)。
2.2 静息态fMRI功能连接分析 缺血性卒中组与患侧M1区功能连接增强的脑区为患侧半球M1区本身,但两者间仅部分重叠,应用SPM软件计算重叠区域体素数为19,重叠区占灰质体积减少区的21%,占功能连接增强区的9%。功能连接减弱的脑区为双侧前岛叶、眶额回、额下回、前扣带回、左侧缘上回(P<0.05)(见表2、见图2);应用MRIcron软件,将该区叠加到标准模板上(见图3)。
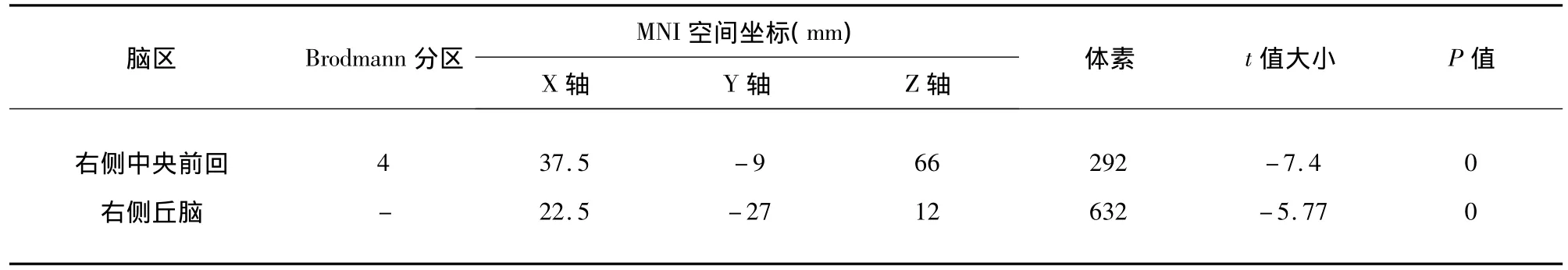
表1 缺血性卒中组与对照相比灰质体积减少的脑区
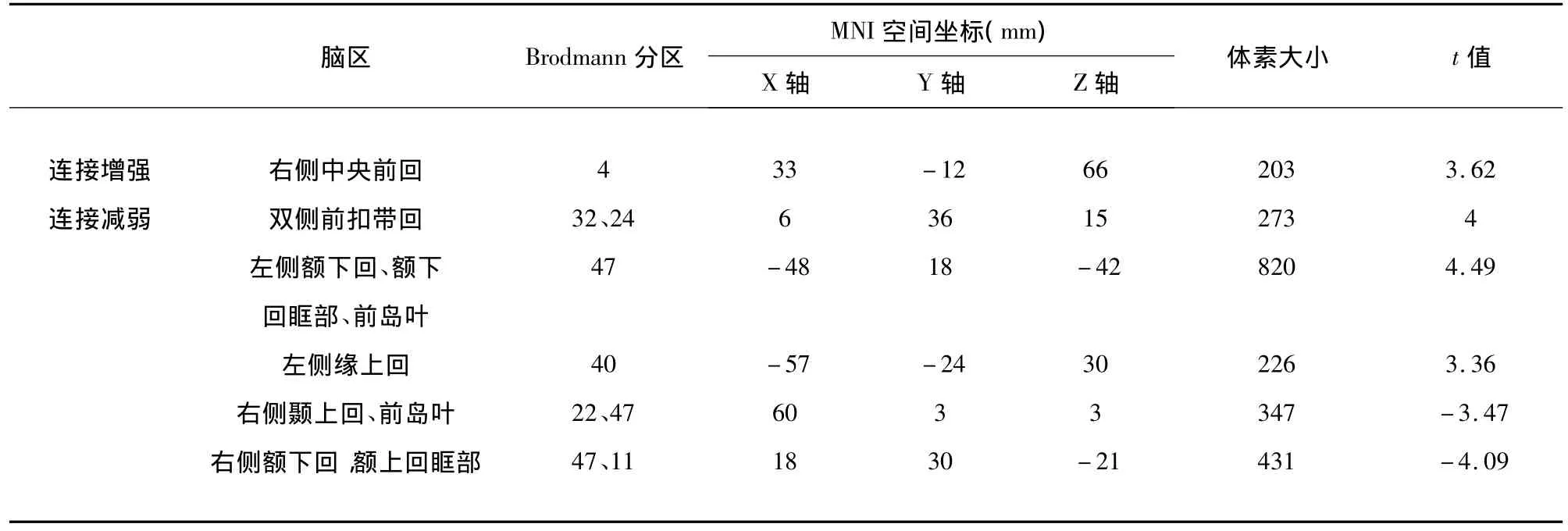
表2 缺血性卒中患者患侧M1区功能连接增强及减弱的脑区
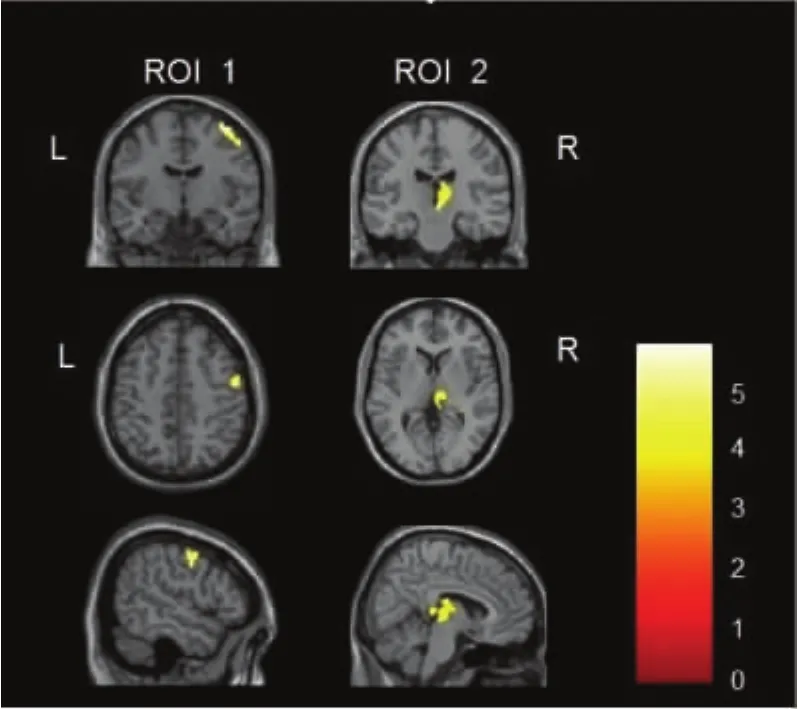
图1 VBM分析结果显示缺血性卒中组灰质体积减少的脑区为患侧M1区和丘脑
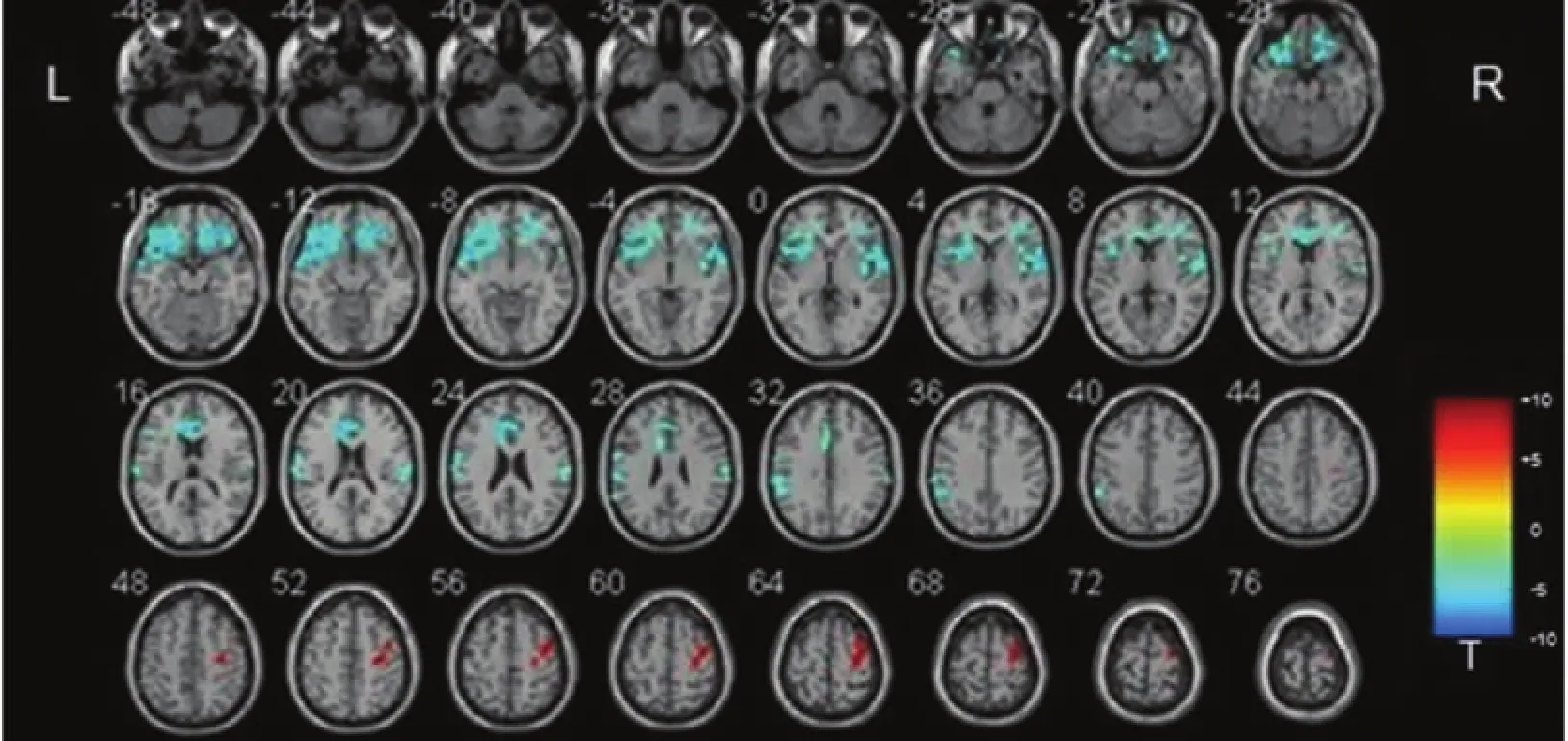
图2 功能连接分析结果显示缺血性卒中组与患侧M1灰质体积减少区功能连接增强的脑区为患侧M1区本身(红色)功能连接较弱的脑区为双侧前岛叶、眶额回、额下回、前扣带回、左侧缘上回(蓝色)
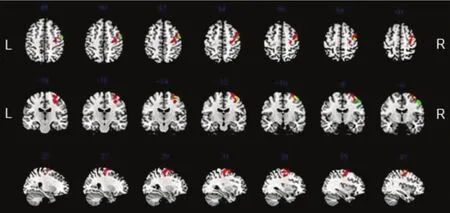
图3 缺血性卒中组患侧M1灰质体积减少区(绿色)与功能连接增强区(红色),两者间仅部分重叠(黄色)
3 讨论
VBM的分析方法可在全脑水平反应灰质体积的改变,不需要人为定义ROI,因此具有较高的客观性、准确性,已经越来越多地用于研究多种疾病导致的脑结构改变[6]。本研究结果显示基底节区缺血性卒中患者不仅邻近病灶的丘脑存在结构损伤,远离病灶的患侧M1区同样存在结构损伤。Dragansk[7]等研究发现截肢者对侧丘脑后外侧体积减少,认为这可能是由于来自身体特定部位的感觉神经纤维传入信息减少所致。Krarmer[8]等则认为梗死区以外的灰质体积减少,可能是由于体积萎缩脑区与梗死灶之间的神经纤维束发生变性所致,缺血性卒中后脑干的华勒氏变性就是最好证据。
本组患者病灶多累及内囊,虽然运动功能恢复良好,但对运动通路均有损伤,导致患侧M1区传入或传出冲动减少,进而引起结构萎缩。
少数研究显示缺血性卒中后接受正规康复治疗的患者,如强制性运动治疗、虚拟训练等,可出现患侧感觉运动区灰质体积增加,激活增强[9,10],代表脑可塑性。本研究中未发现灰质体积增加的脑区。可能与本组患者虽然运动功能恢复良好,但均未接受正规康复治疗有关。此外是否发生脑可塑性,还与发病当时运动功能损伤的严重程度有关。Kononen[11]等发现缺血性卒中患者肢体瘫痪越严重,接受强制性运动治疗后,其患侧感觉运动区越容易出现可塑性改变。
M1区是运动相关脑网络中最重要的节点,不仅参与运动的执行,还参与运动的计划、准备和学习的过程,在运动功能恢复中也起非常重要的作用。
本研究显示患侧M1结构损伤区与其自身的功能连接增强,但两者并不完全重叠,连接增强区主要位于结构损伤区的背内侧。基于任务态的fMRI研究显示,皮层区缺血性卒中患者病灶周围脑区存在过度激活[12]。静息态fMRI研究也发现梗死灶与其周围脑区的功能连接增强[13]。基于细胞水平的研究发现,脑梗死后病灶周围皮层可出现大量新生轴突,产生新的纤维投射,可帮助恢复梗死灶与其他脑区之间的神经联系[14,15]。
大鼠缺血性脑卒中模型显示梗死周围脑组织不仅出现新生轴突,而且该处神经元增生,并出现大量新生毛细血管[16]。因此,缺血性卒中后患侧M1区结构损伤区与周围正常脑组织的血氧水平依赖(blood oxygen level dependent,BOLD)信号的同步性增强,即功能连接增强,从而发挥对结构损伤的代偿,是功能恢复的主要机制。M1区可分为两个亚区,即腹侧的BA4a区与背侧的BA4p区。BA4a区主要参与执行运动功能[17]。BA4p区具有感觉功能,并通过感觉对运动做出调整,该区的激活有助于运动功能的改善[18~20]。Loubinous[21]等对 8 例脑梗死患者进行纵向研究发现,脑梗死早期BA4p区激活越强,梗死后一年患者的运动功能恢复越好。Ward[20]等发现患侧BA4p区激活程度与患侧皮质脊髓束的完整性呈正相关,因此,推测该区激活可代偿部分损伤的运动功能。
本研究中患者运动功能恢复良好,而且功能连接增强区主要位于结构损伤区的背内侧,即更靠近BA4p区,这提示BA4p区可能对运动功能的恢复具有更加重要的作用。
与对照组相比,缺血性卒中组患侧ROI与双侧前岛叶、眶额回、额下回、前扣带回的功能连接减弱。前岛叶、额下回及前扣带回是突显网络(salience network,SN)的重要节点。SN能够从来自体内、外大量的认知或情感信息中正确鉴别当前最显著的信息,并指导相应系统及网络的活动[22],主要参与注意、工作记忆、高级控制任务的启动。研究发现,缺血性卒中导致的血管性痴呆患者双侧额颞叶、扣带回的灰质体积均有不同程度的萎缩[23,24]。
本研究中,缺血性卒中患者患侧M1区与双侧前岛叶、眶额回、额下回、前扣带回(突显网络的节点)功能连接减弱,说明缺血性卒中在损伤运动系统的同时,可能对患者的认知功能也会产生不同程度的影响,如注意力、记忆力等。但本研究未对入组的缺血性卒中患者进行认知功能评价,是研究缺陷。
本研究将VBM与静息态功能连接的分析方法相结合,显示了慢性期基底节区缺血性卒中患者在远离病灶的患侧M1区存在结构损伤,该区域通过与其周围正常M1区的功能连接增强,发挥对结构损伤的代偿,是运动功能恢复的主要神经机制。结构和功能相结合的分析方法,可为深入探讨缺血性卒中后运动功能恢复的神经机制提供有力手段。
[1]Ward N.Assessment of cortical reorganisation for hand function after stroke[J].J Physiol,2011,589(23):5625-5632.
[2]Dijkhuizen RM,der Marel K,Otte WM,et al.Functional MRI and diffusion tensor imaging of brain reorganization after experimental stroke[J].Transl Stroke Res,2012,3(1):36-43.
[3]Gladstone DJ,Danells CJ,Black SE.The fugl-meyer assessment of motor recovery after stroke:a critical review of its measurement properties[J].Neurorehabil Neural Repair,2002,16(3):232-240.
[4]Ertelt D,Small S,Solodkin A,et al.Action observation has a positive impact on rehabilitation of motor deficits after stroke[J].Neuroimage,2007,36(Suppl 2):164-173.
[5]Cramer SC,Shah R,Juranek J,et al.Activity in the peri-infarct rim in relation to recovery from stroke[J].Stroke,2006,37(1):111-115.
[6]Shen S,Andre J,Sterr A.VBM lesion detection depends on the normalization template:a study using simulated atrophy[J].Magnetic Resonance Imaging,2007,25(10):1385-1396.
[7]Draganski B,Moser T,Lummel N,et al.Decrease of thalamic gray matter following limb amputation[J].Neuroimage,2006,31(3):951-957.
[8]Kraemer M,Schormann T,Hagemann G,et al.Delayed shrinkage of the brain after ischemic stroke:preliminary observations with voxelguided morphometry[J].J Neuroimaging,2004,14(3):265-272.
[9]Lynne V,Taub E,Perkins C,et al.Remodeling the brain plastic structural brain changes produced by different motor therapies after stroke[J].Stroke,2008,39(5):1520-1525.
[10]Saleh S,Student Member IEEE,Bagce H,et al.Mechanisms of neural reorganization in chronic stroke subjects after virtual reality training[J].Conf ProcI EEE Eng Med Biol Soc,2011,2011:8118-8121.
[11]Kanen M,Tarkkac IM,Niskanen E,et al.Functional MRI and motor behavioral changes obtained with constraint-induced movement therapy in chronic stroke[J].Eur J Neurol,2012,19(4):578-586.
[12]Feydy A,Carlier R,Roby-Brami A,et al.Longitudinal study of motor recovery after stroke:recruitment and focusing of brain activation[J].Stroke,2002,33(6):1610-1617.
[13]Steven C,Shah R,Juranek J,et al.Activity in the peri-infarct rim in relation to recovery from stroke[J].Stroke,2006,37(1):111-115.
[14]Carmichael ST.Cellular and molecular mechanisms of neural repair after stroke:making waves[J].Ann Neurol,2006,59(5):735-742.
[15]Carmichael ST.Themes and strategies for studying the biology of stroke recovery in the poststroke epoch[J].Stroke,2008,39(4):1380-1388.
[16]Kleim JA,Barbay S,Cooper NR,et al.Motor learning-dependent synaptogenesis is localized to functionally reorganized motor cortex[J].Neurobiol Learn Mem,2002,77(1):63-77.
[17]Rathelot JA,Strick PL.Subdivisions of primary motor cortex based on cortico-motoneuronal cells[J].Proc Natl Acad Sci U S A,2009,106(3):918-923.
[18]Sharma N,Jones PS,Carpenter TA,et al.Mapping the involvement of BA 4a and 4p during motor imagery[J].Neuroimage,2008,41(1):92-99.
[19]Conforto AB,Cohen LG,dos Santos RL,et al.Effects of somatosensory stimulation on motor function in chronic cortico-subcortical strokes[J].J Neurol,2007,254(3):333-339.
[20]Ward NS,Newton JM,Swayne OBC,et al.Motor system activation after subcortical stroke depends on corticospinal system integrity[J].Brain,2006,129(3):809-819.
[21]Loubinoux I,Dechaumont-Palacin S,Castel-Lacanal E,et al.Prognostic value of fMRI in recovery of hand function in subcortical stroke patients[J].Cereb Cortex,2007,17(12):2980-2987.
[22]Feydy A,Carlier R,Roby-Brami A,et al.Longitudinal study of motor recovery after stroke:recruitment and focusing of brain activation[J].Stroke,2002,33(6):1610-1617.
[23]Glenn T,David L,Wang CS,et al.Gray matter atrophy in patients with ischemic stroke with cognitive impairment[J].Stroke,2008,39(3):785-793.
[24]Chuanming L,Hanjian D,Jian Z,et al.A Voxel-based morphometric analysis of cerebral gray matter in subcor-tical ischemic vascular dementia patients and normal aged controls[J].Int J Med Sci,2011,8(6):482-486.
