2种替米沙坦制剂的人体生物等效性研究
2012-08-07穆晓涛成小蔓重庆市第九人民医院重庆400700
穆晓涛,徐 明,成小蔓(重庆市第九人民医院,重庆 400700)
替米沙坦(Telmisartan,TMST)为非肽类血管紧张素Ⅱ受体(AT1)拮抗药,作用强度大、应用剂量小、作用时间长、耐受性好,是一种疗效较好的抗高血压药,对各种程度高血压患者都有较好疗效[1]。为评价重庆市莱美药物技术有限公司研发的四类新药替米沙坦胶囊在健康男性受试者的药动学特征及与市售德国勃林格殷格翰国际公司产品替米沙坦片(美卡素)是否等效,笔者建立了可靠的血药浓度测定方法,并对国产胶囊与进口片的药动学及生物等效性进行了研究。
1 材料
1.1 仪器
高效液相色谱仪,包括LC-10泵系统、SPD-10A型可调波长紫外检测器和C-R7Ae plus积分仪(日本岛津公司);无油真空泵(天津奥特赛恩斯仪器有限公司);VXH-3微型涡旋混合器(上海跃进医疗器械厂);电热恒温水浴锅(上海仪表(集团)供销公司);B160型医用低速离心机(安新县白洋离心机厂);超声波清洗器(天津奥特赛恩斯仪器有限公司)。
1.2 试药
受试制剂:替米沙坦胶囊(重庆市莱美药物技术有限公司研制,重庆福瑞制药有限公司生产,规格:每粒40 mg,批号:040301,含量:99.6%);参比制剂:替米沙坦片(德国勃林格殷格翰国际公司,规格:每片80 mg,批号:304144,批准文号:进口药品注册证号:X20010324);替米沙坦标准对照品(重庆市莱美药物技术有限公司,批号:040101D,含量:99.6%);内标:地西泮对照品(DZP,湖北制药厂);甲醇、磷酸二氢铵、磷酸、乙醚均为分析纯,水为三次蒸馏水。
2 方法
2.1 色谱条件
色谱柱:Hypersil C18(200 mm×5.0 mm,5µm);流动相:甲醇∶磷酸盐缓冲液(0.01 moL·L-1NH4H2PO4,用H3PO4调pH值至约3.0)=70∶30;流速:1.0 mL·min-1;固定进样量:50 µL;紫外检测波长:228 nm;内标:DZP;柱温:室温。
2.2 标准贮备液的配制
准确称取替米沙坦标准对照品15.4 mg,用适量甲醇溶解,置于25 mL容量瓶中,加甲醇至刻度,混匀,即得浓度为616µg·mL-1的替米沙坦标准贮备液。另准确称取DZP对照品40.5 mg,用适量甲醇溶解,置于50 mL容量瓶中,加甲醇至刻度,混匀,即为810µg·mL-1的DZP标准贮备液,使用时用甲醇稀释为8.1 µg·mL-1的工作浓度。
2.3 受试者选择
20名男性健康志愿者,汉族,平均年龄(20.7±0.91)岁,平均体重(61.7±6.94)kg;平均身高(172.9±4.52)cm。试验前所有受试者经肝肾功能、血压、心电图检查均正常。
2.4 给药方法及血样采集
根据国家食品药品监督管理局新药临床研究批件(批件号:2003L04294),经重庆市第九人民医院医学伦理委员会批准,20名健康男性受试者在知情情况下填写知情同意书,并实施试验。采用随机交叉试验设计,单剂量口服给药。将20名受试者随机分为A、B组,每组10名,在Ⅰ、Ⅱ阶段分别交叉服药,交叉服药前经3周清洗期。试验前禁食12 h后,于次日晨8:00时空腹吞服国产胶囊或进口片剂80 mg(200 mL温开水服药)。服药当日统一进标准餐(服药4 h后进早餐)。受试期间禁止剧烈活动、吸烟、饮酒及含酒精、咖啡因类饮料,试验期间禁止使用一切非试验药物,并由医护人员进行健康监护。采集服药后0.5、1.0、2.0、3.0、4.0、8.0、12、24、48、72、96、120、144 h时静脉血3.0 mL,分离血浆,低温(-20℃)保存,及时测定。间隔3周后交换口服另一种制剂,按前述方法采取静脉血。
2.5 样品处理
取受试者血浆1 mL,加内标溶液25 μL,加乙醚4 mL,旋摇1 min,静置,取有机层置30℃水浴中用氮气吹干,100 μL流动相复溶,进样50 μL。
2.6 统计学方法
采用3p97软件(中国数学药理学会),计算各个体的药动学参数,cmax、tmax以实测值计算,AUC按梯形面积法计算。对2种制剂的AUC、cmax、tmax以方差分析、双单侧t检验、1-2α置信区间法进行统计分析,判断是否有生物等效性。
3 结果
3.1 色谱图
在本试验所采用的色谱条件下,血浆中替米沙坦与DZP的保留时间分别约为5、6 min左右(见图1),二者峰形良好,且不受血浆内源性物质的干扰。高效液相色谱图见图1。
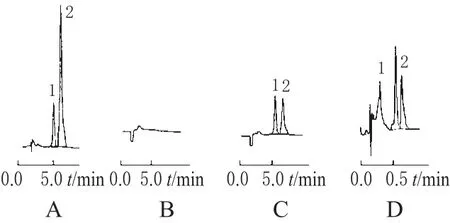
图1 高效液相色谱图A.对照品溶液;B.空白血浆;C.空白血浆+替米沙坦对照品溶液+内标溶液;D.志愿者服药80 mg后2 h血浆样品;1.替米沙坦;2.DZPFig 1 HPLC chromatogramsA.reference standard solution;B.blank plasma;C.blank plasma+telmisartan control+internal standard;D.plasma sample of volunteers 2 h after oral administration of 80 mg telmisartan preparation;1.telmisartan;2.diazepam
3.2 标准曲线与最低定量浓度
在空白血浆中分别添加替米沙坦使血药浓度相当于7.392、3.696、1.848、0.924、0.462、0.231、0.115 5 μg·mL-1,按“2.5”项下方法操作,进样测定,记录色谱。以替米沙坦面积和DZP面积的比值(Y)与替米沙坦浓度(X)进行线性回归,得到回归方程为:Y=0.706 2X-0.041 51(r=0.999 8,n=5)。结果表明,替米沙坦血药浓度在0.115 5~7.392 μg·mL-1范围内线性关系良好。最低定量浓度为0.115 5µg·mL-1(n=5,RSD=17.35%)[2]。
3.3 回收率及精密度试验
于空白血浆中加入低、中、高(0.231、0.924、3.696 µg·mL-1)3种浓度的替米沙坦对照品溶液,评价本法测定血浆中替米沙坦含量的回收率及日内、日间RSD。3种浓度血浆中药物的方法回收率为87.12%~111.69%;日内RSD分别为2.12%、3.75%、7.33%,日间RSD分别为7.50%、2.98%、7.86%。
3.4 稳定性考察
将含药血浆反复冷冻(-20℃)、融化,按“2.5”项下方法操作后测定,1周内测定3次。结果表明,血浆样品1周内反复冻融的稳定性良好((1.28±0.66)µg·mL-1,RSD=5.16%)。
3.5 药-时曲线
20名受试者交叉口服国产胶囊或进口片剂80 mg后,2组平均药-时曲线见图2。

图2 20名健康受试者单剂量口服替米沙坦国产胶囊或进口片剂80 mg后的平均药-时曲线Fig 2 Mean plasma concentration-time curves of domestic Telmisartan capsule or imported Telmisartan tablet 80 mg in 20 healthy volunteers after a single oral administration
3.6 药动学参数及生物利用度
采用3p97计算机软件,计算各个体的药动学参数,cmax、tmax以实测值计算,AUC按梯形面积法计算。采用各受试者的国产胶囊与进口片剂的AUC0~t分别计算相对生物利用度(F),有关药动学参数见表1。结果表明,一室血管外给药模型较佳。
表1 2种替米沙坦制剂在人体内的药动学参数比较(±s ,n=20)Tab 1 Comparison of pharmacokinetic parameters of 2 kinds of telmisartan preparation(s±s ,n=20)

表1 2种替米沙坦制剂在人体内的药动学参数比较(±s ,n=20)Tab 1 Comparison of pharmacokinetic parameters of 2 kinds of telmisartan preparation(s±s ,n=20)
*实测值*measured value
参数t1/2Ka/h t1/2Ke/h tmax*/h cmax*/µg·mL-1 AUC0~∞/µg·h·mL-1 AUC0~144 h/µg·h·mL-1 F/%国产胶囊0.25±0.27 74.23±25.11 2.08±1.64 2.10±1.36 141.35±53.34 116.25±55.97 93.80±12.24进口片剂0.25±0.26 79.18±23.27 2.02±0.86 1.95±1.08 147.42±69.93 123.94±65.66
3.7 生物等效性评价
用双单侧t检验分析2 种制剂的cmax和AUC0~t,t1、t2均有显著性差异(P<0.05),1-2α(α=0.05)置信区间分别为86.7%~122.4%和89.9%~99.1%,表明2种制剂的cmax和AUC0~t均生物等效(α=0.05)。tmax用非参数统计分析(Wilcoxon法)结果表明2种制剂间差异无显著性(P>0.05)。以上结果表明2种制剂生物等效。
4 讨论
替米沙坦人体血药浓度测定及生物等效性研究国内已有报道[3~5]。本试验在现有试验条件下,对厂家提供的替米沙坦质量标准中的高效液相色谱的系统适用性的色谱条件加以改进,建立了便捷、灵敏、重复性较好的高效液相色谱-紫外检测法,能满足临床药动学及生物等效性研究的要求。
20名健康男性受试者单剂量空腹口服本品80 mg后,体内药动学过程属一室模型。由图2和表1可见,2种替米沙坦制剂在人体内吸收、分布、消除较为接近,国产替米沙坦胶囊的相对生物利用度为(93.80±12.24)%,且2种制剂的血药浓度分别平均在(2.08±1.64)、(2.02±0.86)h达到峰值(2.10±1.36)、(1.95±1.08)µg·mL-1,t1/2Ke分别为(74.23±25.11)、(79.18±23.27)h。同时,由图2和表1可见替米沙坦的血药浓度个体差异较大,临床用药时应考虑个体差异的影响。tmax与国内文献[5]报道较一致;而cmax与t1/2Ke与文献报道有差异,前者是否与受试者的来源有关还有待进一步研究,后者可能与取血时间的长短有关。本试验为国产替米沙坦胶囊的临床应用提供了依据。
[1]田 鑫,贾琳静,乔海灵,等.国产替米沙坦片健康人体生物等效性评价[J].中国医院药学杂志,2005,25(4):318.
[2]曾经泽.生物药物分析[M].北京:北京医科大学中国协和医科大学联合出版社,1998:214.
[3]陈伟力,许剑安,徐红蓉,等.国产与进口替米沙坦片的人体生物等效性[J].中国临床药学杂志,2004,13(6):335.
[4]沈 颖.国产与进口替米沙坦制剂在人体内的药动学及生物等效性[J].中国新药与临床杂志,2007,26(12):884.
[5]谭文明,刘 灿,黄 荻,等.人血浆中替米沙坦的LCMS法快速测定及其制剂的生物等效性研究[J].药学进展,2005,29(2):78.
