瑞替加滨的研究进展Δ
2012-08-07张文彦马京京贾庆忠河北医科大学石家庄050017河北省卫生厅卫生监督局石家庄050071开滦总医院河北唐山063000
张文彦 ,马京京 ,贾庆忠 (1.河北医科大学,石家庄 050017;2.河北省卫生厅卫生监督局,石家庄050071;3.开滦总医院,河北 唐山 063000)
瑞替加滨(RTG)又称依佐加滨(Ezogabine),是由万安特公司和葛兰素史克公司联合开发的一种用于治疗癫痫的药物,商品名为Potiga/Trobalt,化学名为N-[2-氨基-4-(4-氟苄氨基)苯基]氨基甲酸乙酯。其结构与20世纪80年代在德国上市的镇痛药氟吡汀(Flupirtine)相似,基本母核属于氨基吡啶类化合物,其作用靶点是KCNQ型钾离子通道,主要通过增强KCNQ2/3亚型钾通道功能,调节神经兴奋性而治疗癫痫。RTG作为第1个上市的KCNQ型钾通道开放剂,其成功开发吸引了许多以此为靶点的新药研究,同时其一些不良反应或毒副作用也逐渐暴露。本文通过查阅文献,主要从RTG的药效学、毒理学及机制方面进行综述,以期为临床使用和新药开发提供帮助。
1 抗癫痫动物研究
1.1 急性癫痫[1]
根据美国国立卫生研究院(NIH)提供的抗癫痫药试验的一般程序,RTG在急性癫痫动物模型中的主要试验内容包括:最大电惊厥休克试验(MES)和化学物质致惊厥试验,其中在MES试验中RTG不同给药方式的半数有效量(ED50)分别为:大鼠:2.87(ig)、5.1(ip)mg·kg-1,小鼠:26.8(ig)、9.3(ip)mg·kg-1;提高电惊厥耐受阈值50%的腹腔注射剂量为1.6mg·kg-1。抗化学物质致惊厥试验中,小鼠腹腔注射RTG后的ED50分别为13.5(sc,戊四唑(PTZ))、18.6(sc,苦味毒)、4.4~9.8(iv,N-甲基-D-天冬氨酸(NMDA))mg·kg-1,提高对PTZ耐受阈值出现Ⅰ、Ⅱ、Ⅳ癫痫症状的腹腔注射给药的起始剂量分别为:18.2、5.0、7.0mg·kg-1;另外,对海人藻酸以及遗传动物模型DBA/2小鼠(听源性惊厥动物)也均有效。但对抗荷包牡丹碱和士的宁所诱导的惊厥不是很敏感,腹腔注射给药的ED50均>30 mg·kg-1。由于上述实验模型出现典型全身强直症状是癫痫大发作的主要表现形式,提示RTG对癫痫大发作有效。
1.2 慢性点燃癫痫[2,3]
通过电刺激或化学物质诱导制备的动物点燃癫痫模型是研究抗癫痫药常用的方法,具有可诱导、反复发作等特点,是模拟人类癫痫部分发作的理想动物模型。在大鼠杏仁核电刺激点燃模型中,RTG腹腔注射2.5~5mg·kg-1或经口给药10~15mg·kg-1,可剂量依赖性地改善点燃动物惊厥症状;200mg·kg-1可显著改善行为学评分值;甚至在经口给药0.01mg·kg-1剂量时就可明显提高点燃过程中出现的后放电阈值。在幼年大鼠海马点燃的模型上,使用3个年龄段的幼鼠(P1、P21、P35)分别按照2.5、5、5mg·kg-1剂量腹腔注射RTG,可以提高后放电的阈值,缩短后放电的时程,降低行为学评分。在快速点燃不同年龄段大鼠模型中,通过与左乙拉西坦、拉莫三嗪、托吡酯进行比较,发现RTG对起效的年龄范围比托吡酯更广。在对拉莫三嗪耐药的杏仁核点燃大鼠上,RTG仍可能降低大鼠癫痫行为学评分和后放电时程。虽然丙戊酸钠、氯硝西泮、左乙拉西坦也同样有效,但卡马西平、苯妥英、托吡酯却不明显。在精神运动型癫痫模型中,RTG可以阻断32、44m A电流刺激引起的惊厥,ED50分别为26、44mg·kg-1;如果与其他抗癫痫药比较,如苯妥英、拉莫三嗪等,在高电流刺激下RTG的效价更高,其他药可能需要3~50倍剂量才能控制癫痫症状,而RTG所需剂量更低。点燃试验提示,RTG对癫痫反复发作或部分发作有效。
1.3 其他
1.3.1 颞叶癫痫[4]。此类癫痫是由于病灶神经元放电或损害影响到整个或部分颞叶的癫痫发作,通常为部分发作以及继发性全身性发作或混合发作,经常发作会引起记忆损伤,反映在临床中最常见的神经病理变化是海马齿状回颗粒细胞树突出现苔藓纤维发芽。在一项由多个抗癫痫药比较实验中,主要观察癫痫引起的神经退行性病变,虽然还没有更翔实的数据证明RTG可以有效防止神经病理性改变,但是在一项离体的大鼠脑片试验中,发现用高钾或γ-氨基丁酸A型(GABAA)受体阻滞药(Picrotoxin)引发的癫痫样放电和神经元的硬化损伤中,RTG因为能有效地抑制簇状放电(IC50=3.1mmol·L-1)而减轻神经元老化病变的过程。
1.3.2 听源性惊厥[5]。虽然目前还不清楚听源性惊厥真正的致痫基因,但RTG对于模型动物表现出一定的疗效。RTG按照3、10mg·kg-1剂量腹腔注射对于有癫痫倾向的大鼠可起到有效预防作用,在DBA/2型听觉癫痫的小鼠试验中其有效的防治ED50为3~10mg·kg-1。
1.3.3 失神性癫痫[6]。这样的动物模型一般很难进行评价,因为无明显特征,但是通过监测缺失的脑电图中有特征性的癫痫波(6~11 Hz,持续>1 s)的方法可以作为佐证的一种手段。RTG经口给药在剂量<10mg·kg-1时没有明显的改善效果,更高剂量下又会影响大鼠的行为特征,对照药乙琥胺(25~300 mg·kg-1)、地西泮(0.3~3 mg·kg-1)、丙戊酸钠(200~400mg·kg-1)呈剂量依赖性地抑制癫痫波的出现,这就提示RTG可能对失神性癫痫发作无效。
在所有类型的癫痫中,持续发作是最严重的一种形式,在意识未完全恢复时又频繁再发,若不及时治疗,可因高热、循环衰竭或神经元兴奋毒性导致不可逆的脑损伤,致残率和病死率很高。早在1988年,Walton等用钴导致皮层损伤大鼠外周神经方法注射DL-高半胱氨酸硫内酯(D,L-HCT),可以模拟产生癫痫持续状态,并且一些药物如苯妥英、丙戊酸钠、苯巴比妥对其均有效,而拉莫三嗪无效;5mg·kg-1的RTG腹腔注射可明显延迟因为注射D,L-HCT引起的癫痫,也可降低痫样脑电(EEG)簇状放电,但不能完全阻止发作。
2 体外研究
RTG除了有明显的抗癫痫作用外,还有中枢神经保护作用,在体外培养PC12细胞,RTG 10mmol·L-1可能抑制由L-谷氨酸导致的细胞死亡,但不能阻止左旋多巴导致的细胞调亡[7]。近期在海马脑片培养的神经细胞上进行观察,发现RTG在0.01~10mmol·L-1范围内可能浓度依赖性地防止撤血清导致齿状回部位细胞的死亡,IC50为0.4mmol·L-1,但对NMDA和再充氧所引起的CA1区的细胞毒无明显作用。并且认为RTG的这一神经保护作用并不受KCNQ2/3通道阻滞药的影响,认为是由于其所具有的抗氧化发挥的作用[8]。在一项麻醉大鼠海马CA1区的微透析实验研究中,RTG可以减少4-氨基吡啶(4-AP)引起的谷氨酸释放,防治应用4-AP后24 h CA1区神经损伤,但不能改变EEG。
RTG对疼痛表现出一定的治疗作用,例如它能减轻辣椒素(Capsaicin)引发的小鼠内脏疼痛与酸刺激引发的大鼠肌纤维痛、机械敏感性痛和热痛[9]。在结扎小鼠腰5脊神经引起的疼痛模型上,10mg·kg-1的RTG与100mg·kg-1的加巴喷丁和10mg·kg-1曲马多一样能有效缓解机械刺激与热刺激引起的痛觉过敏[10]。RTG还可剂量依赖性地减轻阵发性肌张力障碍和左旋多巴导致的运动功能障碍症。
3 作用机制
RTG作用的靶点为KCNQ通道蛋白,这是一种电压依赖性钾离子通道,目前已发现5个亚型,RTG对其中KCNQ2和KCNQ3这2种亚型选择性高。其可以浓度(0.1~10mmol·L-1)依赖性地增强KCNQ2/3电流(EC50:(1.68±1.5)mmol·L-1),使通道激活电压及V1/2向超极化方向平移,膜电位负值增大,加快通道激活速度,减慢去活速度[11]。RTG对不同亚型的KCNQ通道选择性顺序如下:KCNQ3>KCNQ2/3>KCNQ2>KCNQ4>KCNQ5,其EC50值分别为0.6、1.6、2.5、5.2、6.4mmol·L-1[12]。由于KCNQ类型的基因在组织分布不同,KCNQ1主要分布在心肌心胞,KCNQ2、KCNQ3和KCNQ5主要分布在中枢及外周神经组织,KCNQ4主要分布在内耳毛细胞、血管平滑肌。因此RTG主要表现为中枢的调节作用,而对心血管影响较小。RTG开放KCNQ通道的是与KCNQ2~5型通道(6TM,IP)第S6跨膜区甘氨酸、S5色氨酸,导致通道稳定在开放状态[13]。但于KCNQ1缺乏这样的氨基酸,所以RTG对KCNQ1作用不明显,甚至表现出一定的抑制效果。单通道膜片钳分析发现,RTG只是增加通道开放的几率,而不改变通道开放的电导,从通道动力学方面观察,RGT可明显加快激活的速率(τact),减慢去活,尤其是慢去活的过程(τslow)[14],这一现象意味着在膜电位不变的前提下会有更多KCNQ通道停留在开放状态。实验也证实,10mmol·L-1的RTG促进钾外流的作用就足以使细胞膜电位从-63mV向超极化方向发展到-70mV[15],这样的一个作用会使神经细胞兴奋性大大降低。
RTG对神经细胞上的钙通道和钠通道作用不明显,其抑制Nav+或Cav2+的IC50值均>100mmol·L-1。在对KCNQ2/3显效的浓度下(10mmol·L-1)对谷氨酸受体(NMDA、AMPA、Ka)均无影响。对GABAA受体有较弱的激动作用,可引起阴离子内流,但与苯二氮类的作用位点不同。
细胞水平研究揭示,RTG通过开放KCNQ通道,可促进钾外流,降低膜电位,抑制异常兴奋,一般在10mmol·L-1左右就可发挥明显地调节作用。与传统抑制钠、钙通道或调节谷氨酸、GABA受体活性的抗癫痫药比较有所不同:一是RTG选择性相对强;二是作用靶点新;三是中枢药物浓度高,提示有较好的开发潜力。
组织器官水平上可利用脑片体外观察RTG对神经兴奋性的影响,在灌流液内加入4-AP、荷包牡丹碱(Bicuculline)、NMDA或低Mg2+灌流液在脑片上诱发的癫痫样放电,均可被10~100mmol·L-1浓度范围内的RTG所减弱。在脑片钳记录分析系统还可观察到,RTG对海人藻酸在内嗅皮质层细胞诱导的癫痫样放电有抑制作用。甚至有人对癫痫患者因手术取下的新脑皮层进行研究,也发现RTG能有效降低脑细胞的自发放电现象[16]。这些研究为分析RTG对神经放电规律的影响提供了有参考意义的数据。
4 安全性评价
RTG临床的主要不良反应有尿潴留、神经精神症状(包括头晕、困倦、眼花、幻觉、精神错乱,甚至自杀倾向)、停药反应及心电图(ECG)QT间期延长导致的心律失常等。
4.1 急性毒性实验
小鼠和大鼠灌胃的半数致死量(LD50)分别为1 000、100 mg·kg-1左右,最小致死剂量分别为临床最大暴露量的0.8和4倍。长期毒性试验包括小鼠13周、大鼠26周、犬52周和猴子10 d反复用药的试验,观察到的最小无毒剂量(NOAEL)见表1。主要症状包括:中枢神经系统异常(大鼠)活动增强或减少、共济失调、阵挛性惊厥,(犬)还表现出流涎、肌张力下降、反射消失、体温下降等现象。泌尿系统毒性表现为(大鼠)膀胱膨大、膀胱壁加厚、炎症、膀胱结石、尿道上皮增厚。进一步影响肾脏等其他器官表现为骨盆增大、肾乳头坏死、肾小管退变、再生、扩张及局部出血,停药6周可恢复。胆囊和肝脏毒性方面,RTG可导致(犬)胆囊扩张、肝细胞变性或炎症并伴有谷丙转氨酶(ALT)升高,肝毒性与胆囊扩张有关,胆囊的扩张与进食无关,可能是由RTG对KCNQ通道调节所造成。由胆囊扩张引起的肝脏毒性作用暴露剂量比临床用低10倍。针对啮齿类动物肝脏毒性主要表现为肝肿大、肝小叶中心细胞肥厚,这可能与药物代谢的酶有关。甲状腺腺泡腔肥大,T3、T4、TSH增高。
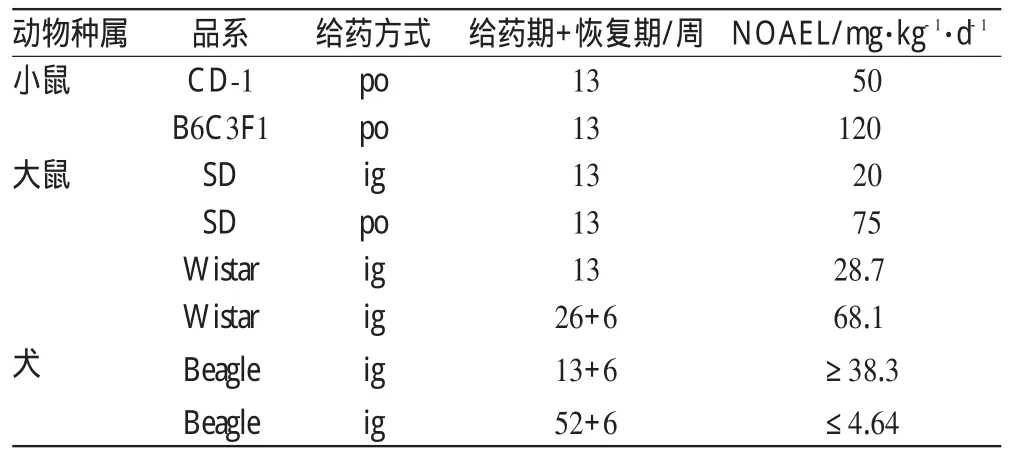
表1 RTG急性毒性汇总
4.2 安全药理实验
RTG对中枢神经系统的影响非常明显,最突出的表现是中枢抑制,尤其是与麻醉药合用可轻微延长异丙酚大鼠的睡眠时间(约1.4倍),明显延长硫酚妥钠大鼠的睡眠时间(约14倍)。转棒试验评价其产生神经毒性的TD50分别为:小鼠为63.4(ig)、20.5(ip)mg·g-1,大鼠为83.5(ig)、9.96(ip)mg·g-1[1]。随给药剂量的逐渐增加,对中枢影响越明显,包括功能性亢进或减退、共济失调、震颤、步态僵硬甚至在最高剂量还会引起动物惊厥、死亡等。
RTG对心脏的影响,是因为在心肌上分布有KCNQ1这种亚型的钾通道基因,KCNQ1与KCNE1共同构成Ks钾电流在心肌复极化过程中发挥重要的调节作用,RTG对KCNQ1亚型选择性差,影响不明显。据报道,随着药物浓度加大(>1 mmol·L-1),RTG表现出对KCNQ1/KCNE1的抑制效应越明显。同时,对复极化的另外一个钾通道,hERG电流影响的IC50为59~100mmol·L-1,是临床最高剂量(1 200mg·kg-1)血药浓度的50倍以上。初步的研究数据表明,在治疗剂量范围内,对离体的豚鼠心肌QTc间期和犬经口给药38mg·kg-1,1周的遥测ECG均无影响。为了观察长期用药对ECG的影响,对RTG及它在体内的主要代谢物N-乙酰化产物(NAMR)进行了52周和13周的犬多次给药(100mg·kg-1·d-1)试验,安全范围分别为<0.8和<2.4,所以不排除在大剂量长期应用时对心脏的影响。
在血管平滑肌上分布有KCNQ4亚型,理论上RTG能引起血管平滑肌舒张血压下降,但无论是动物试验还是临床试验,发现在治疗剂量下对血压影响均不明显,其原因可能与血药浓度不高有关。但随着剂量增加,RTG表现出一定的心血管效应,例如在清醒犬的遥控试验中,随剂量增加血压可降低21%、心输出量减少11%、心率下降42%、左心室收缩力降低36%。
RTG对呼吸系统的影响,给麻醉的豚鼠静脉注射RTG(10 mg·kg-1),呼吸顺应性会降低20%,犬皮内给药(100mg·kg-1)可引起气道阻力轻度升高、呼吸频率和潮气量增加,但无显著性差异。但由于在肺动脉上分布有KCNQ通道,RTG很有可能引起肺血管扩张,降低肺动脉压[17]。RTG对小鼠的胃肠系统无明显影响,但对啮齿类的泌尿系统尤其是膀胱平滑肌有明显影响,RTG对膀胱平滑肌和胆道平滑肌的松弛作用很明显,并且有种属差异,小鼠、大鼠最敏感,其次是犬,最后是猴。小鼠引起的尿潴留还会导致肾盂积水,犬和猴子的肾脏无类似病理改变。
4.3 RTG的三致实验
目前完成了生殖毒性、遗传毒性、致癌的初步评价。RTG对一般生殖毒性(Ⅰ段)试验中的雌、雄大鼠的生殖无影响;在致畸敏感期试验中(Ⅱ段)大鼠和家兔均未出现畸胎现象;围产期试验(Ⅲ段)RTG对子代的影响除了高剂量组出现生长迟缓外,未出现其他明显的发育毒性。
遗传毒性试验,体外的Ames试验呈阴性结果,在哺乳动物细胞体外基因突变试验中,观察RTG对人类淋巴细胞增殖分裂的S9时期处理3或4 h,未引起染色体畸变,但处理20或22 h可引起一定的畸变。体内试验研究,小鼠微核和大鼠肝细胞评价均为阴性。另外一项采用人和大鼠造血细胞进行的体内染色体损伤试验,发现在大于临床最大给药剂量1 000倍左右时可见一定的细胞毒作用。
致癌试验,在5、20、50mg·kg-1·d-1剂量下,对大鼠灌胃2年,未发现RTG有致癌影响。RTG的给药方式包括静脉注射、灌胃、门静脉局部刺激,与对照组比较无区别,认为无刺激性。RTG在豚鼠的被动皮肤过敏试验呈阴性,皮肤Buehler试验中皮肤未显示有明显的刺激性。
5 临床抗癫痫研究
在一项针对279例部分发作的癫痫患者完成的随机、双盲、多中心临床试验研究中,观察RTG作为辅助药物进行为期16周的疗效观察(8周强制治疗,8周维持治疗),使用剂量分为600、900、1 200mg·d-13组,并设安慰剂组进行比较,结果发现RTG中、高剂量均可有效改善癫痫的发作情况,有效率分别达23%、32%(P=0.021)、33%(P=0.016)[18]。
近期开展的另一项针对癫痫患者部分发作的临床试验,通过随机、双盲、安慰剂对照方法,对305例患者进行为期18周的临床观察(先是6周的强制治疗,然后是12周的维持治疗),RTG 1 200mg·d-1(n=153)和安慰剂(n=152)进行比较,癫痫患者部分发作频率平均减少分别为44.4%和17.8%(P<0.001)。256名患者(RTGn=119;安慰剂n=137)进入到12周的维持治疗阶段,其有效率分别为55.5%和22.6%(P<0.001)[19]。
针对顽固性部分发作癫痫患者,给予1~3种抗癫痫药进行配伍观察。第1个研究超过6周,RTG的用量为1 200mg·d-1,其有效率为45%,对照组为18%。在第2个研究中,RTG的用量在2~4周内逐渐递增到600或900mg·d-1,其反应率分别为31.5%和39.5%,对照组为17.3%。RTG在上述临床试验中常见的副作用主要有头晕、嗜睡、疲劳、共济失调等[20]。
其他可能的适应证,现有的证据显示RTG不仅有抗癫痫作用,对其他疾病也有一些疗效,例如神经性疼痛、偏头痛、情感障碍、痉挛、腿多动综合征等。RTG可减轻疼痛模型大鼠的伤害性疼痛。有趣的是,RTG 1mg·kg-1可显著抑制安非他命+氯氮引起的自发活动,显示了其可能的抗躁狂作用。RTG还可抑制由可卡因、哌甲酯和苯环利定对大鼠所引起的神经兴奋作用,显示了治疗成瘾性的潜力。此外,还有报告显示RTG对阿尔茨海默病的治疗有益。但在最近一项RTG主要针对带状疱疹后引起疼痛的临床治疗研究中,采用187例患者日剂量用药300和900mg的试验方案未能证实其有效性,因此以KCNQ为靶点的镇痛药物研发风险增大。
总之,RTG作为第1个以KCNQ为靶点的药物,与其他抗癫痫药作用机制完全不同,它的出现是抗癫痫药的一个新亮点,引起了人们极大的兴趣。其他方面的生理作用如神经保护、神经疼痛、高血压(尤其是肺动脉高压)、脑卒中等方面的机制还有待研究。现有实验数据提示RTG相对安全,在中枢和泌尿系统出现的不良反应或毒性作用对临床研究有重要的提示意义。
[1]Rostock A,Tober C,Rundfeldt C,etal.D-23129:a new anticonvulsant with a broad spectrum activity in animal models of epileptic seizures[J].Epilepsy Res,1996,23(3):211.
[2]Sankar R,Auvin S,Kwon YS,etal.Evaluation of development-specific targets for antiepileptogenic therapy using rapid kindling[J].Epilepsia,2010,51(Suppl3):39.
[3]MazaratiA,Wu J,Shin D,Kwon YS,et al.Antiepileptogenic and antiictogenic effects of retigabine under conditions of rapid kindling:an ontogenic study[J].Epilepsia,2008,49(10):1 777.
[4]Smith MD,Adams AC,Saunders GW,et al.Phenytoin and carbamazepine-resistant spontaneous bursting in rat entorhinal cortex is blocked by retigabine in vitro[J].Epilepsy Res,2007,74(2-3):97.
[5]De Sarro G,DiPaola ED,Conte G,etal.Influence of retigabine on the anticonvulsantactivity of some antiepileptic drugsagainstaudiogenic seizures in DBA/2mice[J].Naunyn Schmiedebergs Arch Pharmacol,2001,363(3):330.
[6]Marescaux C,MichelettiG,Vergnes M,et al.A model of chronic spontaneous petitmal-like seizures in the rat:comparison with pentylenetetrazol-induced seizures[J].Epilepsia,1984,25(3):326.
[7]Seyfried J,Evert BO,RundfeldtC,etal.Flupirtine and retigabine prevent L-glutamate toxicity in rat pheochromocytoma PC 12 cells[J].Eur J Pharmacol,2000,400(2-3):155.
[8]Boscia F,Annunziato L,TaglialatelaM,Retigabine and flupirtine exert neuroprotective actions in organotypic hippocampal cultures[J].Neuropharmacology,2006,51(2):283.
[9]Munro G,Erichsen HK,Mirza NR.Pharmacological comparison of anticonvulsant drugs in animalmodels of persistent pain and anxiety[J].Neuropharmacology,2007,53(5):609.
[10]Dost R,Rostock A,Rundfeldt C.The anti-hyperalgesic activity of retigabine ismediated by KCNQ potassium channel activation[J].Naunyn Schmiedebergs Arch Pharmacol,2004,369(4):382.
[11]Main MJ,Cryan JE,Dupere JR,et al.Modulation of KCNQ2/3 potassium channels by the novelanticonvulsant retigabine[J].MolPharmacol,2000,58(2):253.
[12]Tatulian L,Delmas P,Abogadie FC,etal.Activation of expressed KCNQ potassium currents and native neuronal M-type potassium currents by the anti-convulsant drug retigabine[J].JNeurosci,2001,21(15):5 535.
[13]Schenzer A,Friedrich T,Pusch M,et al.Molecular determinantsof KCNQ(Kv7)K+channelsensitivity to the anticonvulsant retigabine[J].JNeurosci,2005,25(20):5 051.
[14]Tatulian,L.Brown DA.Effect of the KCNQ potassium channel opener retigabine on single KCNQ2/3 channels expressed in CHO cells[J].JPhysiol,2003,549(Pt1):57.
[15]Wickenden AD,YuW,Zou A,etal.Retigabine,a novelanti-convulsant,enhances activation of KCNQ2/Q3 potassium channels[J].Mol Pharmacol,2000,58(3):591.
[16]Straub H,Köhling R,Höhling J,etal.Effects of retigabine on rhythmic synchronous activity of human neocortical slices[J].Epilepsy Res,2001,44(2-3):155.
[17]Joshi S,Sedivy V,Hodyc D,et al.KCNQ modulators reveal a key role for KCNQ potassium channels in regulating the tone of rat pulmonary artery smooth muscle[J].J Pharmacol Exp Ther,2009,329(1):368.
[18]Porter RJ,Partiot A,Sachdeo R,et al.205 Study Group.Randomized,multicenter,doseranging trialof retigabine for partial-onsetseizures[J].Neurology,2007,68(15):1 197.
[19]French JA,Abou-Khalil BW,Leroy RF,et al.Randomized,double-blind,placebo-controlled trial of ezogabine(retigabine)in partial epilepsy[J].Neurology,2011,76(18):1 555.
[20]Brodie MJ,Lerche H,Gil-NagelA,etal.Efficacy and safety of adjunctive ezogabine(retigabine)in refractory partial epilepsy[J].Neurology,2010,75(20):1 817.
