精制银翘解毒片中对乙酰氨基酚的溶出度测定
2012-08-06泰州市食品药品检验所江苏泰州225300
屈 蓉(泰州市食品药品检验所,江苏泰州 225300)
精制银翘解毒片收载于《卫生部药品标准(中药成方制剂)》第三册[1],是由对乙酰氨基酚、桔梗、连翘、淡豆豉、甘草、淡竹叶、金银花、牛蒡子、荆芥穗、薄荷脑等组成的中西复方制剂,具有清热散风、解表退热的功效。用于治疗流行性感冒、发冷发热、四肢酸懒、头痛咳嗽、咽喉肿痛。对乙酰氨基酚为其主要成分之一,标准中仍以崩解时限作为该药的检查项之一,而崩解时限合格并不说明生物利用度合格。为了稳定和提高产品质量,确保药效的充分发挥,本文建立了该品种中对乙酰氨基酚含量的高效液相色谱(HPLC)测定方法,并参照日本“药品品质再评价”工程在溶出度研究中所拟定的模拟人体消化道内体液的4中基本介质[2],采用浆法,转速为75 r·min-1,测定国内3个厂家不同包衣片剂的体外溶出度,以为改进其生产工艺,评价其内在质量提供方法和参考依据。
1 仪器与试药
RC-3B药物溶出仪(天津市天大天发科技有限公司);1260 HPLC仪(美国安捷伦科技有限公司);AG135电子天平(瑞士梅特勒-托利多仪器有限公司);pHS-25型酸度计(北京华瑞博远科技发展有限公司);对乙酰氨基酚对照品(中国食品药品检定研究院,批号:100018-200408);精制银翘解毒片(A厂:糖衣片,批号:20100101;B厂:糖衣片,批号:10215001;C厂:薄膜衣片,批号:091101);甲醇为色谱纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 对乙酰氨基酚含量测定方法建立
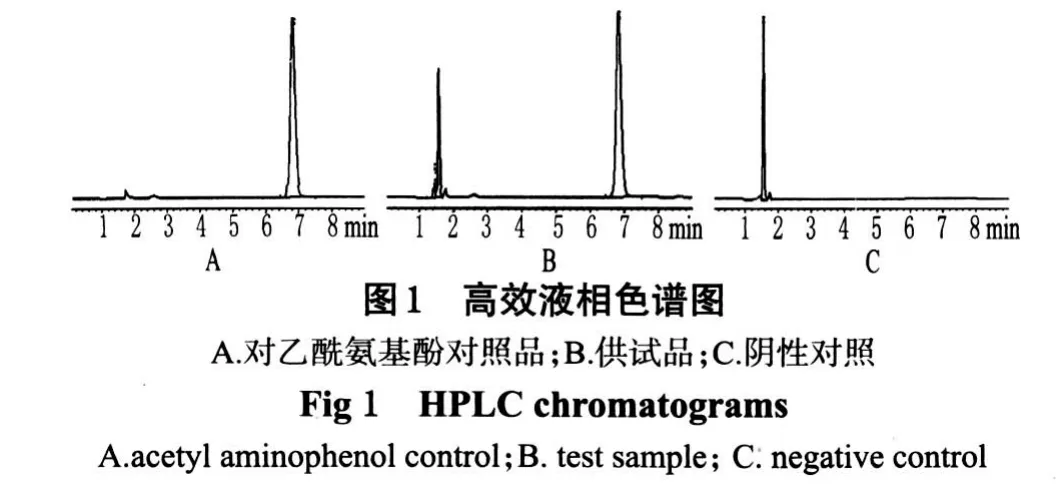
2.1.1 色谱条件与系统适用性试验色谱柱:岛津C18(150 mm×4.6 mm,5 μm);流动相:甲醇-水(20∶80);检测波长:249 nm;流速:1.0 mL·min-1;进样量:10 μL;柱温:30 ℃。对乙酰氨基酚的保留时间为6.788 min,阴性对照在对乙酰氨基酚色谱峰相应的保留时间处无吸收峰。理论板数按对乙酰氨基酚色谱峰计算应为6 500。色谱见图1。
2.1.2 溶出介质的制备[2]溶出介质Ⅰ(pH 1.2人工胃液):取氯化钠2.0 g,加水适量使溶解,加盐酸7 mL,再加水稀释至1 000 mL,即得;溶出介质Ⅱ(pH 4.0醋酸盐缓冲液):0.05 mol·L-1醋酸-0.05 mol·L-1醋酸钠(16.4∶3.6);溶出介质Ⅲ(pH 6.8磷酸盐缓冲液):取磷酸二氢钾3.4 g和无水磷酸氢二钠3.55 g,加水适量使溶解,定容至1 000 mL,再用水稀释1倍,即得;溶出介质Ⅳ(水):纯化水。
2.1.3 标准曲线的制备 取对乙酰氨基酚对照品约25 mg,精密称定,置200 mL量瓶中,分别用上述4种介质溶解后定容,作为贮备液。分别精密量取各贮备液0.1、0.5、2.5、10、25、50、75、100 mL,置100 mL量瓶中,加各溶出介质稀释至刻度,配成浓度约为0.125、0.625、3.125、12.500、31.250、62.500、93.750、125.000 μg·mL-1的系列溶液,按上述色谱条件分别进样测定。以不同溶出介质中乙酰氨基酚检测浓度(c)为横坐标,峰面积积分值(A)为纵坐标,制备标准曲线,得对乙酰氨基酚在溶出介质Ⅰ~Ⅳ中的回归方程分别为A=36.465c-0.196 5(r=0.999 9)、A=36.282c+2.132 4(r=0.999 9)、A=35.940c-3.384 3(r=0.999 9)、A=36.419c+3.427 3(r=0.999 9)。结果表明,对乙酰氨基酚检测浓度在0.125~125.000 μg·mL-1范围内与峰面积积分值呈良好线性关系。
2.1.4 供试品溶液的制备 取供试品10片,除去包衣,研细,取约1/3片重量,精密称定,置200 mL量瓶中,加各溶出介质适量,超声(功率:200 W,频率:53 kHz)处理20 min,放冷,用相应的溶出介质定容,取干燥滤纸迅速过滤,弃去初滤液,取续滤液,即得。
2.1.5 精密度试验 取“2.1.3”项下各溶出介质中浓度为93.750 μg·mL-1的对照品溶液,分别重复进样6次,测定对乙酰氨基酚的峰面积。结果,RSD分别为0.1%、0.1%、0.5%、0.4%(n均为6),表明仪器精密度良好。
2.1.6 重复性试验 取C厂样品适量,按“2.1.4”项下方法分别加4种溶出介质制得供试品溶液各5份,照“2.1.1”项下色谱条件进样分析。结果,RSD分别为1.1%、0.8%、1.3%、1.5%(n均为5),表明方法重复性良好。
2.1.7 稳定性试验 取“2.1.4”项下供试品溶液,按“2.1.1”项下色谱条件测定,分别于0、2、4、8、12 h进样,测定对乙酰氨基酚峰面积。结果,RSD分别为0.1%、0.3%、1.0%、0.5%(n均为5),表明供试品溶液均在12 h内稳定。
2.1.8 加样回收率试验 称取1/6片样品(C厂,每片中对乙酰氨基酚标示量为44 mg)约50 mg,共6份,精密称定,分别精密加入对乙酰氨基酚对照品约8 mg,按“2.1.1”项下色谱条件测定,计算加样回收率。结果,4种介质下对乙酰氨基酚的平均回收率分别为100.4%、100.9%、100.1%、100.9%,RSD分别为1.6%、2.1%、1.7%、2.0%(n均为6)。
2.1.9 定量限 以信噪比10∶1为指标,测得定量限为0.015 μg·mL-1。
2.1.10 样品含量测定 取A、B、C厂家的样品各10片,按“2.1.4”项下方法制备供试品溶液,照“2.1.1”项下色谱条件进样分析,以外标法计算样品中对乙酰氨基酚的含量(按标示量计算),结果见表1。

表1 样品含量测定结果Tab 1 Results of content determination of sample
2.2 溶出度考察
2.2.1 溶出介质的制备[1]同“2.1.2”项下方法制备。
2.2.2 溶出介质体积的选择 以水为溶出介质,选用浆法测定,介质体积选用600、900 mL[3],转速为75 r·min-1,分别对3个厂家的样品进行考察。结果,A、B厂样品在取样时间为10 min时的供试品溶液浓度未能达到仪器的定量限,故溶出介质体积选用600 mL。
3.1.3 溶出度测定 根据2010年版《中国药典》(二部)附录溶出度测定法,选用第二法浆法测定。取A、B、C 3个厂家的样品各6片,分别以不同溶出介质Ⅰ~Ⅳ各600 mL为溶出介质,转速为75 r·min-1,温度为(37±0.5)℃,依法测定。取样时间为10、20、30、45、60、90、120、150、180 min,每次取样5 mL,经0.45 μm微孔滤膜滤过,同时补充同体积同温度的溶出介质。取供试品溶液按HPLC法分别测定,计算出每片的累积溶出率。溶出曲线见图2。
2.3 数据处理及分析
采用美国FDA推荐使用的相似因子法。相似因子法的基本假设是试验制剂与对照制剂的累积溶出度差的平方和最小,相似因子(f2)的数学表达式为:
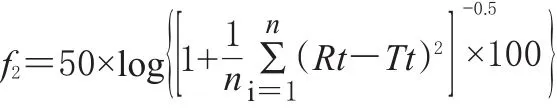
式中:f2为相似因子;Rt为t时间参比制剂累积溶出百分率;Tt为t时间受试制剂累积溶出百分率;n为取点数目。
f2值在50~100之间时可以认为样品与参比制剂之间的溶出行为具有相似性,其值越接近100,相似性越高;越接近0,相似度越低;f2值<50时,则说明样品与参比制剂的溶出度不相似。选用A厂的产品为对照,评价其他两家药厂的产品在各个溶出介质条件下的溶出度,统计分析结果见表2;以溶出介质Ⅰ为对照,评价各药厂制剂在其他3个溶出介质中的溶出度,统计分析结果见表3。

图2 不同厂家精制银翘解毒片在不同溶出介质中的溶出曲线A.A厂;B.B厂;C.C厂Fig 2 Dissolution curve of Prepared yinqiao jiedu tablets produced by different manufacturers in different medium factoryA.factoryA;B.factory B;C.factory C
从HPLC图中可看出,除对乙酰氨基酚峰外,其余仅检出1~2个色谱峰,说明在本文所考察的4种溶出介质中,样品大部分成分未能溶出。由于本文仅对对乙酰氨基酚的溶出指标进行测定,未考察其余成分适宜的溶出介质,故该方法下一步可继续深入研究。
试验中考察了转篮法和浆法两种方法,采用转篮法时,发现制剂的包衣会附着于转篮的篮网上,影响片剂的溶出,因此选用浆法。
在进行溶出度测定时,B厂制剂在溶出介质Ⅳ中一开始出现倒溶现象,10 min时溶出率为0.6%,而20 min时溶出率为0.2%,在溶出介质Ⅲ中也存在此现象,可能是药物中添加的辅料导致了药品释放的不稳定,尚有待进一步研究,但仍建议该厂对影响制剂溶出度的辅料及生产工艺进行改进,以进一步提高产品质量。
试验中发现,A厂和B厂制剂在60 min后对乙酰氨基酚的溶出率才能达到40%以上,120 min达到85%以上,而C厂制剂在30 min后溶出率已能达到40%以上,90 min后能达到85%以上,说明薄膜衣较糖衣体外溶出快,但是否会引起体内生物利用度及临床疗效不同,有待进一步研究证实。
中药制剂生产多为传统工艺,产品质量参差不齐,出现的问题也比化学药品多。因此,药品标准中有必要增加溶出度检查项目,对制剂质量进行控制。

表2 以A厂制剂为对照的其他各药厂制剂的相似因子Tab 2 f2of preparations from different factories using factoryAas control
由表2可看出,以A厂制剂为对照,仅仅B厂产品在溶出介质Ⅰ中的f2值>50,其余所得f2值均<50,说明各药厂制剂质量水平存在显著性差异。由表3看出,以溶出介质Ⅰ为对照,A药厂制剂在溶出介质Ⅱ、Ⅳ中f2值均>50,在溶出介质Ⅲ中f2值也接近50,说明A厂制剂在患有该疾病的各种体质人群中溶出情况相似,其质量较稳定;而B药厂和C药厂制剂在溶出介质Ⅱ、Ⅲ、Ⅳ中的f2值均<50,说明B药厂和C药厂制剂在不同体质人群中的溶出情况存在显著性差异。

表3 以溶出介质Ⅰ为对照的其他各溶出介质中的相似因子Tab 3 f2of different mediums using mediumⅠas control
3 讨论
[1]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂(第三册)[S].1991:198.
[2]谢沐风.简介日本“药品品质再评价”工程(溶出度研究系列一)[J].中国药品标准,2005,6(6):42.
[3]张 波,李清箐,潘庆东.益肝灵滴丸溶出度测定[J].中国药房,2010,21(43):4 103.
