江南卷柏中的黄酮碳苷类成分研究Δ
2012-08-06朱田密陈科力黎莉湖北中医药大学省部共建中药资源与中药复方教育部重点实验室武汉430065湖北省中医院药事部武汉430061武汉工程大学化工与制药学院武汉430073
朱田密,陈科力,黎莉(1.湖北中医药大学省部共建中药资源与中药复方教育部重点实验室,武汉430065;2.湖北省中医院药事部,武汉 430061;3.武汉工程大学化工与制药学院,武汉 430073)
江南卷柏(Selaginella moellendorffiiHieron.)是卷柏科卷柏属药用植物,多年生草本,具有清热利湿、止血之功效[1]。已知其化学成分有异茴芹素、银杏素等[2,3]。卷柏属含有丰富的双黄酮类化合物,而黄酮碳苷很少报道,史社坡[4]2003年首先从卷柏中得到了芹菜素-6,8-二-C-β-葡萄糖苷;笔者于2008年在硕士学位论文中报道在江南卷柏中发现了4种黄酮碳苷[5];申健2010年的硕士学位论文中亦报道从布朗卷柏中分离得到了芹菜素6,8-二-C-β-D-葡萄糖苷以及芹菜素6-C-β-D-葡萄糖-8-C-α-L-阿拉伯糖苷[6]。本文详细报道3种黄酮碳苷的提取分离方法和结构鉴定过程。
1 仪器与试药
INOVA600核磁共振仪(美国Varian公司);7.0T傅里叶变换离子回旋共振质谱仪(美国IonSpec公司);U-2001紫外分光光度计(日本Hitachi公司);5700FFIR红外分光光度计(美国Nicolet公司);P680高效液相色谱仪(美国Dionex公司)。
江南卷柏全草于2005年7月采自湖北恩施,由湖北中医药大学陈科力教授鉴定为江南卷柏Selaginella moellendorffiiHieron.,标本留存于湖北中医药大学中药标本中心。聚酰胺粉(60~100目,武汉药科新技术开发有限公司);Sephadex LH-20(瑞士Pharmacia公司);聚酰胺薄膜(20×20 cm,浙江台州路桥四青生化材料厂);薄层色谱硅胶G(青岛海洋化工厂);其他试剂均为分析纯。
2 提取与分离
江南卷柏干燥全草12 kg,切段,依次用15倍量95%、90%、80%乙醇各提取3 h,滤过,减压回收乙醇,浓缩成浸膏,用蒸馏水分散,依次用石油醚、乙酸乙酯、水饱和正丁醇萃取,得到正丁醇部位浸膏120 g。取正丁醇部位浸膏113 g,上样于聚酰胺柱(60~100目,86 cm×9 cm),以不同浓度的水-乙醇梯度洗脱,每500 mL为一流分,共收集279份流分,用硅胶G薄层和聚酰胺薄膜检识,合并相同流分,得28个部分(Fr1~Fr28)。取Fr6(纯水洗脱部分)、Fr7(5%乙醇洗脱部分)经Sephadex LH-20柱色谱(甲醇,60 cm×2.2 cm)纯化,流分结晶后得化合物Ⅰ(40 mg);采用相同方法,Fr9(10%~15%乙醇洗脱部分)纯化得复合结晶Ⅱ和Ⅲ(16 mg)。此外,Fr8(10%乙醇洗脱部分)和Fr10(15%乙醇洗脱部分)经过Sephadex LH-20柱色谱后,再用半制备高效液相色谱分离,亦得到复合结晶Ⅱ和Ⅲ(10mg)。
3 结构鉴定
化合物Ⅰ:淡黄色粉末(甲醇),UV(MeOH)λmax:272、333 nm;IR(KBr)νmax:3 383(br,OH)、2 927(CH2)、1 651(Ar-C=O)、1 626、1 574、1 511、1 481(芳环骨架振动)、829(苯环对位二取代)cm-1;HR ESI-MS(m/z595.1 657[M+H]+,计算值595.1 663)推断分子式为C27H30O15(Ω=13)。三氯化铁反应阳性,喷三氯化铝显色剂于紫外光灯下显黄色荧光,提示可能为黄酮类化合物;氨气熏后黄色荧光不变亮,为黄酮苷;常规酸水解条件下不能被水解,表明为碳苷。其核磁共振氢谱(1H-NMR,DMSO-d6,600 MHz)见表1;核磁共振碳谱(13C-NMR,DMSO-d6,150 MHz)见表2。δC低于140的碳原子数有6个,说明黄酮母核除C-2、C-4、C-9外,还有3个碳原子连有氧原子,这和1H-NMR中显示3个-OH信号相符。糖基碳原子δ低至81,是碳苷的表现。HSQC中δC73.9、73.2分别与δH4.81(1H,d,J=10.8 Hz)、4.76(1H,d,J=10.2 Hz)相关,是2个碳苷端基C、H信号。根据13C-NMR中的12个糖碳信号,DEPT谱δC59.7、61.2显示的2个CH2,1H-NMR中糖基所有氢原子的偶合常数JH-H值都大于5Hz以及2个端基氢的偶合常数(J=10.8 Hz,10.2 Hz),说明2个糖单元都为β-D-吡喃葡萄糖,并且各自连在母核上。HMBC中端基H-1″与母核C-5、C-6、C-7远程相关,端基H-1′″与母核C-7、C-8、C-9远程相关,表明2个糖基分别连在母核C-6和C-8位;另有远程相关信号确定了3个-OH取代位置在母核C-5、C-7、C-4′位。综合上述分析,并与文献对照[7],确定其为芹菜素-6,8-二-C-β-D-吡喃葡萄糖苷。
复合物Ⅱ和Ⅲ:黄色粒状结晶(甲醇),UV(MeOH)λmax:272、330 nm;三氯化铁反应阳性,三氯化铝反应紫外光灯下显黄色荧光,提示可能为黄酮类化合物;其1H-NMR(DMSO-d6,600 MHz)见表1;13C-NMR(DMSO-d6,150 MHz)见表2。糖基碳原子δC低至81,表明为碳苷。δC59~81有22个C信号(δC70.3为重叠),表明有4个糖基(2个六碳糖和2个五碳糖)。HMQC可确定4个端基C-H:δC75.2、73.6、74.9、73.9分别与δH5.02(1H,d,J=9.0 Hz)、4.74(1H,d,J=9.6 Hz)、4.65(1H,d,J=9.0 Hz)、4.55(1H,d,J=9.6 Hz)相关。4个端基碳都处于较高场δC73~75,说明4个糖基与母核以碳键相连,为碳苷。端基氢的偶合常数(J=9.0 Hz,9.6 Hz)说明4个糖基都是β构型;DEPT谱显示 4 个CH2:δC59.7、61.2、70.3(2个CH2叠加),1H-NMR(600 MHz)任意2个H的JH-H值都不小于3 Hz,以及表2数据表明4个糖基为2个β-D-吡喃葡萄糖和2个β-D-吡喃木糖[8~10]。母核碳信号个数为24(部分重叠),大于15,且多数信号成对出现,提示分子中可能含有2个黄酮单元,或者是2个化合物的复合物。据HMBC糖端基H与母核C-6、C-8位的远程相关,确定了4个糖基分别连在母核上的6,8位;结合HMQC,1H-NMR确定了C-5、C-7、C-4′位有-OH取代,C-3位有H。因所有位置均有归属,2个黄酮单元无处相连,判断其为一对同分异构体复合物。这个判断经质谱得到了证实:HR ESI-MS在300~1 300分子量范围内只显示一个准分子离子峰(m/z563.1 395[M-H]-,计算值563.1 401),证实了该晶体是一对分子式为C26H28O14(Ω=13)的同分异构体,确定其为芹菜素-6-C-β-D-吡喃葡萄糖-8-C-β-D-吡喃木糖苷和芹菜素-6-C-β-D-吡喃木糖-8-C-β-D-吡喃葡萄糖苷的复合物。化合物结构式及HMBC相关性表达见图1。

表 1化合物Ⅰ、Ⅱ、Ⅲ的 1H-NMR 数据(600 MHz,(J)HzDMSO-d6)Tab 1 1H-NMR data of compoundⅠ、Ⅱ、Ⅲ(600 MHz,(J)Hz,DMSO-d6)

表2 化合物Ⅰ、Ⅱ、Ⅲ的13C-NMR数据(150 MHz,DMSO-d6)Tab 2 13C-NMR data of compoundⅠ、Ⅱ、Ⅲ(150 MHz,DMSO-d6)
4 化合物抑制环氧化酶(COX-2)活性测试
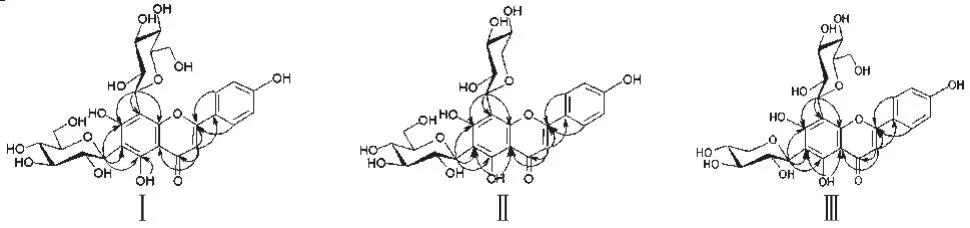
图1 化合物结构式及HMBC相关性表达Ⅰ.芹菜素-6,8-二-C-β-D-吡喃葡萄糖苷;Ⅱ.芹菜素-6-C-β-D-吡喃葡萄糖-8-C-β-D-吡喃木糖苷;Ⅲ.芹菜素-6-C-β-D-吡喃木糖-8-C-β-D-吡喃葡萄糖苷Fig 1 Structures and key correlations for compoundsⅠ.6,8-di-C-β-D-glucopyranosylapigenin;Ⅱ.6-C-β-D-glucopyranosyl-8-C-β-D-xylopyranosylapigenin;Ⅲ.6-C-β-D-xylopyranosyl-8-C-β-D-glucopyranosylapigenin
选择化合物Ⅰ进行抑制COX-2的活性测试。参照文献方法[11],将化合物Ⅰ作用于培养的人结肠癌细胞(HT-29),配成不同浓度的试验组(终浓度分别为12.5、25.0、50.0 μg·mL-1),同时设空白对照组、阳性对照姜黄素组(3.125 μg·mL-1)做对比,继续培养,提取总RNA。采用RT-PCR技术检测药物作用前、后HT-29细胞中COX-2 mRNA的表达,扩增产物的电泳结果见图2。以灰度值即COX-2 275bp电泳带与内参β-actin 234 bp电泳带的吸光度值的比值来反映COX-2 mRNA的相对含量(计算公式:COX-2 mRNA灰度值=COX-2 mRNA密度/β-actin mRNA密度)(见表3)。结果,样品组的灰度值与其浓度之间呈负相关,相关系数为-0.944,说明化合物Ⅰ可在mRNA水平抑制HT-29COX-2的表达。

图2 电泳图M.DL2000 DNA Marker;1.空白对照组;2.阳性对照姜黄素 3.125 μg·mL-1;3.化合物Ⅰ 12.5 μg·mL-1;4.化合物Ⅰ 25.0 μg·mL-1;5.化合物Ⅰ50.0 μg·mL-1Fig 2 ElectrophoretogramM.DL2000 DNA Marker;1.blank control group;2.curcumin positive control 3.125 μg·mL-1;3.compoundⅠ 12.5 μg·mL-1;4.compoundⅠ25.0 μg·mL-1;5.compoundⅠ 50.0 μg·mL-1

表3 灰度值测定结果Tab 3 Results of gray scale determination
5 讨论
除以上3种黄酮碳苷外,笔者还从江南卷柏正丁醇部位分离鉴定了一个新的黄酮氧苷:系由上述聚酰胺柱色谱40%乙醇洗脱部分,经Sephadex LH-20柱(甲醇)纯化、结晶而得(51 mg),经理化性质和波谱分析,鉴定为5-羧甲基-4′-羟基-黄酮-7-O-β-D-吡喃葡萄糖苷,是首次发现的5-羧甲基取代的黄酮类型,这一研究发表在Chinese Chemical Letters[12];之后,这一黄酮类型又有新发现:Cao Y[13]等2010年从江南卷柏、申健[6]从布朗卷柏中分别发现了新化合物:5-羧甲基-4′,7-二羟基黄酮,Cao Y等[13]还得到了它的乙酯和丁酯,也是2个新化合物并具抗乙型肝炎病毒活性。申健[6]还分离得到了与江南卷柏相同的成分:4′-羟基-5-羧甲基黄酮-7-O-β-D-葡萄糖苷。至此,卷柏属中已报道了4种5-羧甲基取代的黄酮类化合物。
[1]全国中草药汇编编写组.全国中草药汇编(上册)[M].北京:人民卫生出版社,1975:339
[2]陈德钊,余竞光.江南卷柏化学成分分析[J].中草药,1986,17(1):4.
[3]Sun CM,Syu WJ,Huang YT,et al.Selective cytotoxicity of ginkgetin fromSelaginella moellendorffii[J].J Nat Prod,1997,60(4):382.
[4]史社坡.卷柏化学成分研究[D].郑州:河南中医学院,2003.
[5]朱田密.江南卷柏的生药学研究Ⅱ-黄酮苷类成分的分离鉴定[D].武汉:湖北中医学院,2008.
[6]申 健.布朗卷柏化学成分研究[D].长沙:中南大学,2010.
[7]张嫚丽,李作平,贾湘曼.麻叶荨麻化学成分研究[J].天然产物研究与开发,2005,17(2):175.
[8]Rancon S,Chaboud A,Darbour N,et al.A new C-glycosyl xanthone isolated fromDavallia solida[J].Phytochemistry,1999,52(8):1 678.
[9]Feng J,Yang XW,Wang RF.Bio-assay guided isolation and identification ofα-glucosidase inhibitors from the leaves ofAquilaria sinensis[J].Phytochemistry,2011,72(2-3):244.
[10]李晓亮,汪 豪,刘 戈,等.广金钱草的化学成分研究[J].中药材,2007,30(7):802.
[11](美)萨姆布鲁克,(美)拉塞尔著.黄培堂译.分子克隆实验指南[M].第3版.北京:科学出版社,2002:676.
[12]Zhu TM,Chen KL,Zhou WB.A new flavone glycoside fromSelaginella moellendorffiiHieron.[J].Chin Chem Lett,2008,19(12):1 456.
[13]Cao Y,Tan NH,Chen JJ,et al.Bioactive flavones and biflavones fromSelaginella moellendorffiiHieron.[J].Fitoterapia,2010,81(4):253.
