消旋体药物生物等效性研究中的立体选择性
2012-08-06何海云黄华王慧李鸿忠重庆医科大学重庆40006重庆医药工业研究院重庆40006
何海云,黄华,王慧,李鸿忠(.重庆医科大学,重庆40006;.重庆医药工业研究院,重庆40006)
手性药物在生物体体内具有药效学立体选择性和药动学立体选择性。临床常用的手性药物中90%以外消旋体给药,从立体化学角度看,消旋体药物的2个对映体实际上是2种完全不同的药物,这种给药方式所产生的问题引起了越来越广泛的关注和重视。
消旋体药物对映异构体在体内的作用复杂,剂型、剂量、生理、病理等因素的变化均会导致异构体在体内过程产生差异。生物等效性(BE)的研究是评价制剂质量的重要手段,BE研究中,如果忽略对映异构体的药效学与药动学行为的不同,将外消旋体药物当做单一化合物来处理,可能会对药物等效性结果产生错误的结论[1]。因此消旋体药物BE研究中是否采用立体选择性分析方法,是影响等效性评价结果的一个重要因素。
BE研究中,是否应采用立体选择性分析方法,国内、外没有统一的规定,且一直存在着争议,各国也都没有建立相应的评价标准[2]。本文概述了各国对消旋体药物BE研究的相关规定,重点讨论剂量、剂型、赋形剂的改变,以及手性药物的吸收、分布、代谢、排泄过程的立体选择性对BE结果的影响,并说明是否使用立体选择性分析方法。

表1 口服给药后具有不同程度立体选择性药动学的消旋体药物
1 各国对消旋体药物BE研究的相关规定
由于消旋体药物对映异构体在药理学及药效学作用差异,立体选择性分析方法应用于药效学、药动学及药物相互作用等的研究已达成了共识。但各国的相关指导原则中对是否使用立体选择性分析方法,其规定有着一定的差异。
1991年,瑞典医药管理局首先提出立体选择性分析方法应用于消旋体药物BE的研究[3],指出:(1)当每个异构体的治疗作用不明时,分别测定异构体;(2)活性来源于其中一个异构体,测定有活性的异构体;(3)异构体之间发生相互作用与相互转化时,分别测定对映异构体;(4)异构体具有相似的治疗活性,测定总体药量。
1993年与2001年,欧洲相关指导原则均指出,BE研究中推荐使用立体选择性分析方法,但如果对映异构体含量相同、稳定且活性为单个异构体,或消旋体药物中对映异构体均为线性药动学,则使用非立体选择性分析方法[4]。
2000年,加拿大医药管理局在手性药物发展中的立体选择性问题中指出,相同剂型的制剂可不进行立体选择性分析,但不同剂型的制剂,例如缓释、控释制剂,由于立体选择性非线性首过代谢等因素,吸收或释放速率影响体内对映异构体的比值时,应用立体选择性分析[5]。
2003年,美国食品与药物管理局(FDA)在口服给药生物利用度与生物等效性的指导原则中指出,BE研究中,同时满足以下4个条件则使用立体选择性分析方法:(1)对映异构体具有不同的药理活性;(2)对映异构体具有不同的药动学特性;(3)含量少(浓度低)的对映异构体为提供药理疗效和安全性的主体;(4)至少有1个对映异构体呈非线性吸收[6]。
我国在生物利用度与生物等效性研究的指导原则中,没有提及是否使用立体选择性分析方法。在化学药物非临床药动学研究技术指导原则中,仅指出关于手性药物,为评价单一对映体或对映体混合物的药动学,建立适用于体内样品对映体选择性分析的定量方法。
2 立体选择性影响因素
对于无药效学或药动学立体选择性差异的手性药物,BE研究只需测量总体药量。但大多数消旋体药物,立体选择性差异大小各不相同,如表1所示[2]。
消旋体药物BE研究,不能单凭总体药物水平判断是否等效。是否使用立体选择性分析方法,依据相关的文献[7~10]总结,其立体选择性影响因素包括制剂因素(剂量、剂型、赋形剂)和药物体内过程立体选择性因素(吸收、分布、代谢、排泄过程)。
2.1 剂型因素
2.1.1 手性赋形剂。药物制剂中,许多药用辅料,例如糖类、纤维素、藻朊酸盐、环糊精等具有光学活性,并很有可能与有光学活性的消旋体药物发生作用,导致药物立体选择性释放。在对映体体外立体选择性释放的研究中,王胜浩与曾苏认为,手型辅料与对映体相互作用的差异是立体选择性释放的重要原因,而手性辅料规格、辅料与药物的比例均有可能对立体选择性释放造成影响[11]。例如,酮洛芬外消旋体与手性辅料HPMC组成骨架片,其体外释放研究,S-对映体的溶出速率大于R-对映体(S/R>1)。而以非手性骨架辅料如甲基丙烯酸三甲铵乙酯-甲基丙烯酸酯共聚物(Eudragit RL)替代HPMC,药物释放的立体选择性消失[11]。
但是,一些研究结果表明,消旋体药物制剂虽然存在明显的立体选择性释放,但体内吸收的差异并不明显。例如对苯噻丙酸缓释胶囊进行的试验发现,药物的体外释放具有较大的立体选择性(29%),但这并未导致体内生物利用度的不同[12]。但是基于手性药物与手性辅料的立体相互作用,BE研究过程中应当考虑辅料对结果的影响。
2.1.2 剂量。对于非线性药动学的消旋体药物,剂量的改变,异构体浓度比值可能发生改变。例如大鼠静脉注射不同剂量的西酞普兰(Citalopram),达到稳态后血清中S-对映体与R-对映体浓度的比值随剂量增加而降低;脑中药物浓度高,但对映体浓度的比值不随剂量改变;剂量对R-对映体的影响大[13]。此类药物的BE研究中,应当检测对映异构体。
2.1.3 剂型。剂型的改变导致对映异构体立体选择性药动学的改变,主要表现为具有特殊传递系统的制剂或缓控释制剂。例如,与速释制剂与缓释制剂相比,以ORSR®为释药系统的dl-苏-哌醋甲酯,可以调节哌醋甲酯的立体选择性代谢,使低活性的l-异构体系统传递减少,从而异构体比值改变,药物的治疗指数增加[14]。又如,对美托洛尔及其代谢物的立体选择性药动学研究中,分别对比缓释、常释、速释与该药的口服溶液,发现与其他剂型相比,速释制剂的吸收相与消除相具有更加明显的立体选择性[15]。
对于释药速率的改变,对映体比值发生改变的药物,应对对映异构体进行检测。
2.2 药物体内过程的立体选择性因素
2.2.1 吸收过程的立体选择性。很多药物由胃肠道的吸收是被动转运过程,其吸收仅与药物浓度成正比,与药物的立体结构无关。而需载体媒介转运(主动转运或促进扩散)吸收的手性药物,由于对映体与细胞膜转运载体的结合具有立体选择性,对映体间会出现的吸收差别。具有立体选择性吸收的药物有甲氨蝶呤、甲酰四氢叶酸、L-多巴胺、头孢氨苄、特布他林等。
反式曲马朵(trans T)在大鼠小肠中吸收的立体选择性研究中,发现在低浓度时(+)-trans T的吸收分数明显低于(-)-trans T;在高浓度时trans T对映体的吸收分数均降低,(+)-trans T与(-)-trans T的吸收分数无明显差别[16]。由此可知trans T小肠中吸收具立体选择性,且随剂量或释药速率的不同,其异构体在体内的浓度比值不同。
吸收的立体选择性导致总体药量的AUC、cmax、tmax与异构体的AUC、cmax、tmax有差异或相应的R/S比值发生改变时,BE中建议使用立体选择性分析方法。
2.2.2 分布过程的立体选择性。手性药物对映体与血浆蛋白和组织蛋白结合率的不同,或对映体竞争性地与血浆蛋白、酶或受体结合,都可能引起对映体体内分布的立体选择性。例如醋硝香豆素,呈线性药动学,但异构体的体内分布不同。生物等效性研究中对比总体药量和对映异构体的测定结果发现,总体药物和R-对映体的药-时曲线相似,根据总体药物的参数可以认为2种制剂具有生物等效性(差异为17%),但是根据S-对映体的cmax则不能认为2种制剂具有生物等效性(差异为36%)[8,17]。对于非线性药动学药,例如维拉帕米、布洛芬、丙吡胺,释药速率改变,异构体在体内的分布改变,R/S比值发生改变[8,18]。
体内具有立体选择性分布过程的药物见表2[2],当消旋体药物显示出不同的体内分布时,生物等效性的研究应当考虑其对结果的影响,特别是改变释药速率对异构体的分布产生影响的药物,生物等效性研究应使用立体选择性分析方法。

表2 非肠道给药后呈立体选择性分布的消旋体药物
2.2.3 代谢和排泄过程的立体选择性。药物的消除过程包括药物代谢和排泄。由于药物在体内代谢都有酶的参与,药物代谢酶对代谢底物和代谢产物往往都具有一定的立体选择性。例如细胞色素P4502D6是一种重要的细胞色素药物代谢酶,参与多种药物的代谢且对手性药物的代谢还呈现立体选择性[19]。
2.2.4 药物代谢过程的立体选择性。有研究表明,非线性代谢可能是由于口服给药药物进入肝门静脉的速率所影响,缓释制剂可能没有首关代谢饱和现象,但是速释制剂有饱和现象[15]。首关代谢是影响对映异构体体内浓度比值变化的一个重要因素,是异构体产生药动学立体选择性差异的主要原因。
Karim将立体选择性首关代谢药物分为以下几类,Ⅰ类:无明显的首关代谢或为非立体选择性首关代谢的药物;Ⅱ类:药理活性低的对映体有明显的首关消除;Ⅲ类:药理活性高或毒性强的异构体有明显的首关消除。依据这3种分类,BE中需进行立体选择性分析的药物见图1[10]。

图1 依据首关代谢,判断消旋体药物BE研究是否使用立体选择性分析方法
例如,酮洛芬与氟比洛芬无首关代谢为Ⅰ类药物;而β受体拮抗药普萘洛尔,R-异构体较易发生首关代谢,而药理活性较强的S-异构体则较少发生,为Ⅱ类药物;与之相反的是维拉帕米、依托度酸,活性强的对映体首关消除较多,为Ⅲ类药物[10,20]。
2.2.5 药物排泄过程的立体选择性。肾脏是药物排泄的主要器官,肾排泄涉及肾小球被动过滤、肾小管主动转运及肾代谢等过程,药物肾排泄立体选择性与后2个过程有关,与被动转运过程无关。表3为具有立体选择性清除率的药物[2]。
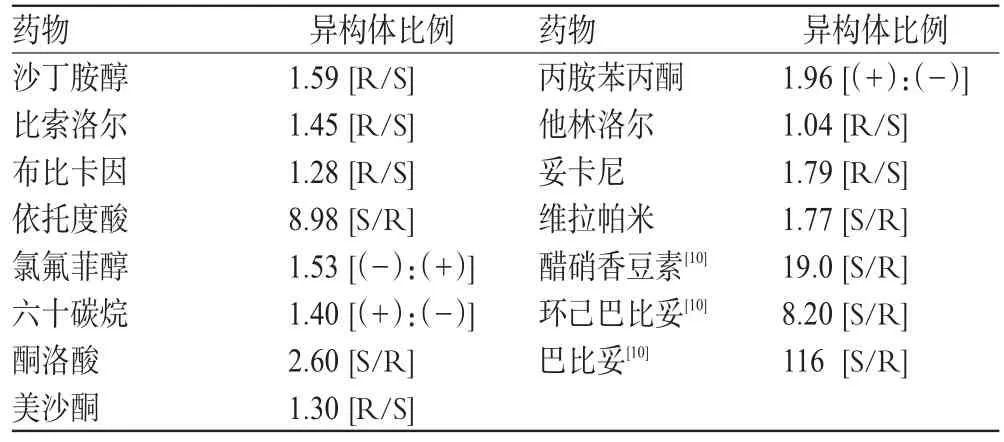
表3 具有立体选择性清除率的药物
2.2.6 异构体转化与相互作用。在体内一些药物可以从一种异构体转变为另一种异构体。例如口服消旋体布洛芬后,在胃肠道中无活性的R-布洛芬转化为有活性的S-布洛芬,药物在胃肠道的停留时间越长,转化程度越大。布洛芬对映体比值S/R呈现出剂型依赖性,cmax和AUC的S/R因制剂不同而有所差别,服用布洛芬消旋体缓释颗粒剂后对映体S/R型的AUC之比(7.3±1.5)要显著高于混悬剂(3.6±1.1)和溶液剂(3.5±0.2)[21]。又如,其他药物苯洛芬(benoxaprofen)、非诺洛芬(fenoprofen)、沙丁胺醇(salbutamol)、氯吡格雷(clopidogre)等在人体内均产生异构体转化[18]。对于该类药物制剂BE研究应采用立体选择性的分析方法。
一些药物在不同的药动学环节上存在着异构体相互作用,如新抗凝、尼群地平(代谢)、布洛芬、丙吡胺(白蛋白结合)等[8,17]。如果在治疗剂量下,该种相互作用能引起依赖于吸收速率的异构体血浆浓度比值改变,建议在BE研究时采用立体选择性的分析方法。
2.3 其他
种属、性别、年龄等对手性药物药动学过程也存在立体选择性差异。例如Hooper等[22]给4个不同年龄、性别的受试组服mephobarbital消旋体,结果发现年轻男性组与其他3组相比,R-对映体的总体清除率非常高,而且消除半衰期明显降低,证明在该消旋体的消除过程中存在着明显的年龄和性别差异。又例如维拉帕米在男性体内比在女性体内清除率低,而普萘洛尔消旋体在男性体内比在女性体内的清除率高,给予相同剂量普萘洛尔时,女性体内的稳态浓度几乎是男性的2倍[23]。
因此,如果不对比立体选择性PK,BE的研究不能证明遗传因素的多样性。当消旋体药物药动学存在种属、性别、年龄的差异时,建议在BE研究时采用立体选择性的分析方法。
3 小结
BE研究中,药物的立体选择性影响因素是复杂的,然而它们又是相互联系的。首关代谢的改变,可能改变药物在体内的分布与消除;吸收的改变亦影响药物的代谢与分布;药动学因素的线性与非线性,是消旋体药物剂型依赖性重要影响因素。而且1种药物可能同时存在多种立体选择性过程,例如维拉帕米、布洛芬、丙胺苯丙酮的吸收、分布、代谢过程均存在立体选择性。因此,是否使用立体选择性分析方法进行BE研究,不能孤立的考虑其中1种因素。应从总体来考虑,考虑异构体在体内的总体过程是线性还是非线性,考虑对映异构体比值R/S是否与剂型因素、释药速率相关。
随着手性生物分离分析技术,如高效液相色谱(HPLC)、高效毛细管电泳(HPCE)、超临界流体色谱法、质谱等的快速发展,其在对映体的分离测定以及药动学-药效学研究中的应用越来越广泛。建立适合于消旋体药物生物等效性研究的分析方法以及药政部门建立统一的相关指导原则,对制剂质量控制具有重要意义。
[1]Jamali F.Stereochemistry and bioequivalence[J].Clin Pharmacol,1992,32(10):930.
[2]Brocks DR.Drug disposition in three dimensions:an update on stereoselectivity in pharmacokinetics[J].Biopharm Drug Dispos,2006,27(8):387.
[3]Midha KK,Mckay G,Rawson MJ,et al.The impact of stereoisomerism in bioequivalence studies[J].J Pharm Sci,1998,87(7):797.
[4]European Agency for the evaluation of medicinal products(EMEA),committee for Proprietary Medicinal Product(CPMP).Note for guidance on the investigetion of bioavailability and bieoequivalence[EB/OL].http://www.egagenerics.com/doc/emea_bioquiv-1401-98.pdf.2001-07-26.2010-07-15.
[5]Health Canada.Guidance for industry stereochemical issues in chiral drug development[EB/OL].http://www.hc-sc.gc.ca/dhp-mps/prodpharma/applic-demande/guide-ld/chem/stereo-eng.php.2000-02-14.2010-07-15.
[6]Food and Drug Administration.Guidance for industry on bioavailability and bioequivalence studies for orally administered drug products-general considerations[EB/OL].http://google2.fda.gov/search?q=guidance+for+industry+bioavailability+and+bioequivalence+studies&client=FDA gov&site=FDAgov&lr=&proxystylesheet=FDAgov&output=xml_no_dtd&getfields=*&x=10&y=6.2003-10-01.2010-07-15.
[7]Srinivas NR.Role of stereoselective assays in bioequivalence studies of racemic drugs:have we reached a consensus?[J].J Clin Pharmacol,2004,44(2):115.
[8]Mehvar R,Jamali F.Bioequivalence of chiral drugs.Stereospecific versus non-stereospecific methods[J].Clin Pharmacokinet,1997,33(2):122.
[9]刘会臣.手性药物的药代动力学立体选择性及其影响因素[J].中国临床药理学杂志,2003,19(5):380.
[10]Karim A.Enantioselective assays in comparative bioavailability studies of racemic drug formulations:nice to know or need to know?[J].J Clin Pharmacol,1996,36(6):490.
[11]王胜浩,曾 苏.手性药物制剂递释的对映体立体选择性作用[J].中国药学杂志,2005,40(1):10.
[12]Vakily M,Jamali F.Human pharmacokinetics of tiaprofenic acid after regular and sustained release formulations:lack of chiral inversion and stereoselective release[J].J Pharm Sci,1994,83(4):495.
[13]Kugelberg FC,Apelqvist G,Carlsson B,et al.In vivo steady-state pharmacokinetics outcome following clinical and toxic doses of racemic citalopram to rats[J].Br J Pharmacol,2001,132(8):1 683.
[14]Srinivas NR,Hubbard JW,Korchinski ED,et al.Enantioselective pharmacokinetics of dl-threo-methylphenidate in humans[J].Pharm Res,1993,10(1):14.
[15]Mistry B,Leslie JL,Eddington ND.Influence of input rate on the stereospecific and nonstereospecific first pass metabolism and pharmacokinetics of metoprolol extended release formulations[J].Chirality,2002,14(4):297.
[16]刘会臣,李保欣.反式曲马朵在大鼠小肠中吸收的立体选择性[J].药学学报,2003,38(12):893.
[17]刘会臣.立体选择性分析方法在手性药物制剂生物等效性研究中的应用[J].中国临床药学杂志,2000,9(5):325.
[18]García-Arieta A,Abad-Santos F,Rodríguez-Martínez MA,et al.An eutomer/distomer ratio near unity does not justify non-enantiospecific assay methods in bioequivalence studies[J].Chiralty,2005,17(8):470.
[19]陈丽芳,娄建石.与细胞色素P4502D6相关的药物相互作用研究[J].中国药房,2008,19(29):2 300.
[20]胡 辉,阮红梅,李振江,等.手性药物与药物的手性[J].中国药房,2002,13(17):438.
[21]Sattari S,Janali F.Evidence of absorption rate dependency of ibuprofen inverseon in the rat[J].Chirality,1994,6(5):435.
[22]Hooper WD,Qing MS.The influence of age and gender on the stereoselective metabolism and pharmacokinetics of mephobarbital in humans[J].Chirality,1996,8(1):18.
[23]邓 鸣,刘会臣.性别对药代动力学的影响[J].中国临床药理学杂志,2004,20(1):68.
