VEGF基因沉默对肝癌HepG2细胞侵袭和迁移的影响
2012-08-05宋向芹司秀文赵延婷
宋向芹,司秀文,张 芳,赵延婷
(滨州医学院临床学院,山东滨州256603)
研究表明[1,2]肝癌的发生是一个多基因参与、通过不同基因表达进行调控的复杂过程,癌细胞早期侵袭转移是肝癌患者死亡的重要因素之一[3]。血管内皮细胞生长因子(VEGF)是目前已知在原发性肝癌血管生成中作用最强的血管生成诱导因子,可通过作用于血管内皮细胞、提高血管的通透性、促进肝癌细胞的增殖促进肝癌的发生、发展[4]。2011年1月~2012年1月,我们采用RNA干扰技术沉默VEGF基因,观察其对人肝癌细胞株HepG2迁移和侵袭的影响,为肝癌的临床治疗提供理论和实验依据。现将相关研究报告如下。
1 材料与方法
1.1 主要试剂 PCR引物(由上海生工生物工程技术服务有限公司合成),脂质体转染试剂 (Lipofectami 2000,Invitrogen公司),质粒提取试剂盒(北京天根公司),凝胶回收试剂盒和反转录试剂盒[宝生物工程(大连)有限公司]。质粒pGenesil-1和人肝癌细胞株HepG2由本实验室保存。
1.2 HepG2的培养 HepG2培养于含有10%胎牛血清、100 U/mL青霉素和 100 U/mL链霉素的DMEM完全培养基中,在37℃、5%CO2饱和湿度培养箱内孵育。显微镜下观察细胞生长情况。当细胞生长融合80% ~90%时,用0.25%的胰酶消化传代,选用对数生长期细胞实验。
1.3 VEGF-siRNA重组载体的构建、转染和VEGF基因沉默 采用siRNA技术沉默HepG2细胞内VEGF基因。由上海吉玛制药技术有限公司合成针对VEGF的3种siRNA和1个阴性对照,对pGenesil-1质粒进行双酶切,再进行pGenesil-1质粒酶切大片段产物的回收与纯化,用 T4DNA连接酶将干扰片段与pGenesil-1载体连接起来,成功构建3种siRNA表达载体和1个阴性对照,分别命名为pGenesil-1-VEGF-shRNA-1、2、3 和 pGenesil-1-VEGF-shRNA-scramble。用0.25%的胰酶消化 HepG2,将细胞接种于6孔板中,5×105/孔,当细胞的融合至70% ~80%时Lipofectamin 2000)介导将pGenesil-1-VEGF-shRNA-1、2、3分别转染 HepG2。转染前24 h更换为无抗生素的DMEM完全培养基,转染6 h更换为正常的DMEM培养液。用RT-PCR法[5]筛选出沉默效果最好(即VEGF表达量最少)的siRNA片断即pGenesil-1-VEGF-shRNA-2(见图1)。
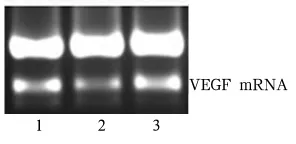
图1 HepG2中VEGF mRNA表达量
1.4 细胞创伤愈合试验 根据文献[6]的方法,将pGenesil-1-VEGF-shRNA-2转染HepG2(观察组),以转染pGenesil-1空质粒细胞(空载组)和未转染的空白细胞(空白组)作为对照。将三组细胞分别接种于24孔板中(5×105/孔),待细胞生长至单层完全融合时,以100 μL微量移液枪头在单层细胞上呈“一”形划痕,制造细胞创伤模型,每组平行3个样本,记录划痕区相对距离。PBS冲洗2~3次后继续培养。24 h后在显微镜下监测创伤愈合程度,并于200倍视野下拍照。用电子尺软件分别测量每组在0、24 h划痕两侧细胞间的距离,按公式计算迁移速度(迁移速度=迁移距离/迁移时间)。
1.5 Transwell小室体外侵袭试验 根据文献[7]的方法进行三组细胞体外侵袭试验。比较三组穿膜细胞数。
1.6 统计学方法 采用SPSS13.0统计学软件,数据用¯x±s表示,采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
观察组细胞迁移速度为(3.02 ±0.03)μm/h,明显慢于空载组的(8.67±0.02)μm/h和空白组的(8.78 ±0.03)μm/h,P 均 <0.05。观察组穿膜细胞数为(14.0±1.3)个,显著低于空载组的(35.0±2.3)个和空白组的(36.0 ±2.5)个,P 均 <0.05。
3 讨论
肝癌的发生发展与肿瘤血管生成有密切的联系[8]。肝癌组织中VEGF的表达显著高于正常肝组织[9],且随着肝癌的进展呈上升趋势。已有研究表明VEGF是潜在的肝癌预后分子之一[10]。因此,抑制VEGF的表达是抗肝癌血管生成治疗的有效途径之一。
RNA干扰是近年来发现的利用外源性或内源性双链RNA以高度序列特异性方式抑制基因表达的过程,具有高靶向性、高稳定性、高效率性、高特异性及高穿透性等特点。它是通过双链RNA的介导特异地降解相应序列的mRNA,从而阻断相应基因表达的转录后水平,使基因沉默[11]。
本研究采用siRNA技术沉默VEGF mRNA,成功构建针对VEGF的3种siRNA表达载体和1个阴性对照,在相同条件下转染相同细胞,产生的干扰效果有差异,其中以pGenesil-1-VEGF-shRNA-2干扰效果最好,其抑制效果接近80%,可作为下一步分析研究的优选干扰片断。本研究中细胞创伤愈合试验显示,观察组即pGenesil-1-VEGF-shRNA-2重组质粒细胞迁移速度较空载体组和空白组明显减慢(P均<0.05),说明VEGF与肝癌细胞的迁移有关。细胞体外侵袭试验能间接反映HepG2的侵袭能力。Transwell小室试验结果表明转染 pGenesil-1-VEGF-shRNA-2细胞即观察组穿膜细胞数明显减少,与空载组和空白组相比,P均<0.05。这表明VEGF下调可以显著降低肝癌细胞株HepG2的体外侵袭能力。VEGF基因与肝癌细胞株HepG2的发生、发展密切相关,VEGF基因 siRNA表达载体可以抑制HepG2细胞的迁移和侵袭,因此VEGF在HepG2的生长转移过程中起重要作用,为临床靶向干预VEGF信号通路,抑制肝细胞癌转移提供分子生物学基础,但是导致这些改变的分子机制仍有待进一步研究。
总之,我们采用 RNA干扰技术成功合成的VEGF siRNA,证实能特异、有效地抑制体外肝癌HepG2细胞中VEGF的表达,并可望通过靶向阻断VEGF表达途径以阻断VEGF促血管形成,从而阻止肝癌的生长与转移,为肝癌治疗开辟新途径。
[1]Kang CS,Pu PY,Li YH,et al.An in vitro study on the suppressive effect of glioma cell growth induced by plasmid-based small interference RNA(siRNA)targeting human epidermal growth factor receptor[J].J Neurooncol,2005,74(3):267-273.
[2] Stevenson M.Therapeutic potential of RNA interference[J].NEJM,2004,351(17):1772-1777.
[3]Kashef E,Roberts JP.Transplantation for hepacellular carcinoma[J].Semin Oncol,2001,28(5):497-499.
[4]李鸣,游建,金鑫,等.DLL4和血管内皮生长因子在肝细胞癌的表达及其在肿瘤血管生成的作用[J].中华实验外科杂志,2010,27(8):1094-1096.
[5]徐恒瑰,赵永福,苗小艳,等.VEGF-A siRNA对人肝癌HepG2细胞体外增殖、侵袭及化疗敏感性的影响[J].解剖科学进展,2009,15(1):40-43.
[6]Patela O,Dumesnya C,Giraud AS,et al.Stimulation of proliferation and migration of a colorectal cancer cell line by amidated and glycine-extend gastrinireleasing peptide via the same receptor[J].Bio chem Pharmacol,2004,68(2):129-142.
[7]罗庚求,文继舫,李景和,等.Twist对胃癌细胞系 MKN28迁移和侵袭能力的影响[J].中南大学学报,2008,33(2):174-178.
[8]El-Assal ON,Yamanoi A,Soda Y,et al.Clinical significance of microvessel density and vascular endothelial growth factor expression in hepatocellular carcinoma and surrounding liver:possible involvement of vascular endothelial growth factor in the angiogenesis of cirrhotic liver[J].Hepatology,1998,27(6):1554-1562.
[9]张大红,朱卫国,岳顺.血管内皮生长因子在原发性肝癌组织中的表达及临床意义[J].细胞与分子免疫学杂志,2011,27(2):199-202.
[10]Niizei T,Smie S,Torimura T,et al.Serum vascular endothelial growth factor as a predictor of response and survival in patients with advanced hepatocellular carcinoma undergoing hepatic arterial infusion chemotherapy[J].J Gastroenterol,2012,47(6):686-695.
[11]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
