阻断肾素—血管紧张素—醛固酮系统不同环节对肝纤维化大鼠肝组织的影响
2012-08-05焦占江崔忠林钱建平曾德华
焦占江,周 杰,崔忠林,钱建平,曾德华
(1南方医科大学南方医院,广州510515;2福州军区总医院)
肝纤维化是诸多肝病共同的病理改变。肾素—血管紧张素—醛固酮系统(RAAS)在肝纤维化形成中起着重要的作用。RAAS除了存在于循环系统中外,还存在于许多组织器官中,如心、肾、肺、胰、肝等[1]。研究表明[2],肝内 RAAS 参与肝纤维化的发展。2011年~2012年,我们通过研究阻断RAAS不同环节对肝纤维化大鼠肝组织的影响,从病理学角度探讨拮抗RAAS不同环节抗肝纤维化的实验依据。现将相关研究报告如下。
1 材料与方法
1.1 主要材料 ①药品及主要试剂:氯沙坦钾片(杭州默沙东制药有限公司产品),卡托普利片(湖南湘雅制药有限公司产品),螺内酯片(杭州民生药业集团有限公司产品);Masson三色染色试剂盒购于福建迈新生物技术开发有限公司。②实验动物:6周龄清洁级SD大鼠(福建医科大学动物实验中心提供)50只,雌雄不拘,体质量180~220 g,室温18~25℃,湿度30% ~50%,精制饲料喂养。
1.2 动物分组、模型制备及用药 将50只大鼠按随机区组设计分为正常组、模型组、卡托普利组、氯沙坦组和螺内酯组,各10只。正常组皮下注射橄榄油,余大鼠予40%CCl4腹壁皮下注射,3 mL/kg,首剂加倍,1次/3 d,复制大鼠肝纤维化模型;次日,卡托普利组用血管紧张素转换酶抑制剂卡托普利60 mg/kg、氯沙坦组用血管紧张素Ⅱ的Ⅰ型受体阻断剂氯沙坦10 mg/kg、螺内酯组用醛固酮受体拮抗剂螺内酯100 mg/kg(均用10 mL生理盐水稀释后)灌胃,模型组和正常组用10 mL生理盐水灌胃,均1次/d,于第8周处死所有动物,取右肝组织,液氮保存,备测。
1.3 观察指标 ①观察大鼠体质量、精神、饮食、活动、死亡等一般情况。②肝组织病理学改变:肝组织用10%多聚甲醛固定,常规石蜡包埋,5 μm厚连续切片,行HE和Massion染色。行 Kondell评分[3]并对肝纤维化程度进行分级,0级:无纤维化;1级:汇管区纤维化;2级:汇管区纤维化扩大;3级:桥接样纤维化;4级:肝硬化。采用Image-pro计算机图像分析软件测定肝胶原面积,计算其占视野总面积的百分比,测6次,取均值为肝纤维化面积比。
1.4 统计学方法 采用SPSS11.0统计软件。数据以¯x±s表示,计量资料比较采用方差分析,计数资料采用秩和检验。P≤0.05表示差异有统计学意义。
2 结果
2.1 各组动物一般状态 正常组大鼠精神良好,毛色光泽,运动活泼,反应敏锐,进食、饮水正常,体质量增加;模型组大鼠精神萎靡,活动少,反应迟钝,进食、饮水少,体质量下降明显;卡托普利组、螺内酯组、氯沙坦组大鼠精神、活动、反应、饮食、体质量均较模型组好。
2.2 肝组织病理变化 HE染色:正常组见肝细胞以中央静脉为中心向周围呈放射状排列,结构完整;模型组肝细胞索排列紊乱,肝细胞呈弥漫性脂肪变性,空泡形成,汇管区扩大,汇管区和肝小叶内可见淋巴细胞浸润,假小叶形成;卡托普利组、氯沙坦组、螺内酯组见肝细胞坏死及空泡变性减少,淋巴细胞浸润减少。Masson染色:正常组胶原纤维在血管周围少量表达;模型组胶原纤维增生明显,纤维间隔形成,可见弓形纤维,部分区域形成假小叶;卡托普利组、氯沙坦组、螺内酯组胶原纤维减少,形成的纤维间隔和假小叶明显减少。各组大鼠肝纤维化程度分级比较见表1,肝纤维化面积比、Kondell评分比较见表2。
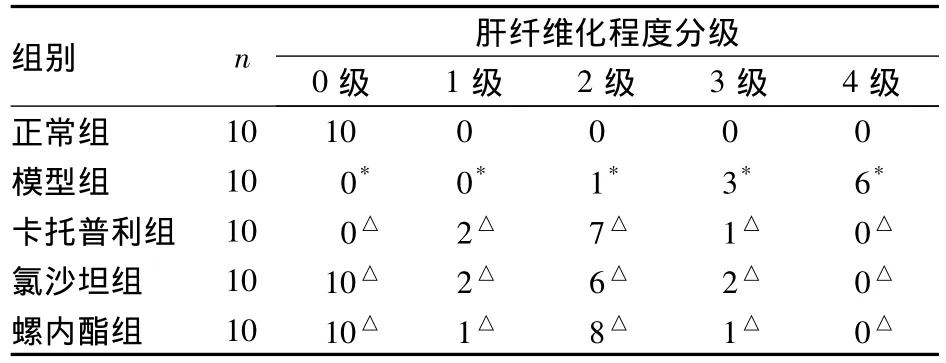
表1 各组肝纤维化大鼠肝纤维化程度分级(例)

表2 各组肝纤维化面积比、Kondell评分比较(¯x±s)
3 讨论
肝纤维化是肝细胞肝癌的危险因素之一[4]。不同病因(如病毒、乙醇、寄生虫、铜铁沉积等)引起的慢性肝损伤最终会导致以胶原为主的细胞外基质(ECM)各成分合成增多,降解相对不足,过多沉积在肝内,引起肝纤维化[4,5]。肝纤维化的特征不仅是肝组织中基质蛋白浓度的增加,包括胶原、弹力蛋白、结构糖蛋白、蛋白多糖及透明质酸,而且是基质成分的改变。其中,肝星状细胞是肝纤维化过程中生成纤维的主要细胞。在正常肝组织中,肝星状细胞主要用来储存维生素A[5]。受伤后,肝星状细胞激活转变为肌成纤维细胞,能产生一系列的促纤维化、促炎症反应的细胞因子和化学因子,也能产生纤维组织的ECM成分,在肝纤维化的发生发展中起着关键性的作用。
RAAS是机体调节血管张力和钠水代谢的内分泌系统。器官和组织也能合成RAAS的全部或大部分成分,称为局部RAAS,其主要与组织纤维化和(或)重构过程有关,如心肌梗死后纤维化、心肌肥厚、肾纤维化和皮肤纤维化等。肝脏亦存在局部RAAS。研究表明[1],随着肝脏的受损,可观察到RAAS的成分如血管紧张素原、肾素、血管紧张素转换酶、血管紧张素Ⅰ和血管紧张素Ⅱ的上调或重新分布。局部组织RAAS在组织纤维的形成中具有重要的促进作用,其效应分子血管紧张素Ⅱ和醛固酮是重要的致炎因子,可促进成纤维细胞增殖和ECM的合成[6]。亦有研究表明,RAAS的主要活性物质血管紧张素Ⅱ和醛固酮作用于肝星状细胞,通过激活转化生长因子(TGF)-β1、血小板衍生因子(PDGF)等细胞因子或直接促进肝星状细胞分裂增生、分泌ECM等机制,促进纤维化的发生[7]。人体和动物实验表明,与对照组比较,肝硬化组内血浆肾素浓度和活性以及它的作用底物血管紧张素原的浓度和活性都有所增加[8]。血管紧张素Ⅱ在正常动物中既存在于血浆又可存在于肝组织中,在鼠肝病模型和肝硬化患者中,血管紧张素Ⅱ含量显著增加[9]。血管紧张素Ⅱ是肝纤维化形成的主要介质之一,它既参与了炎症细胞的聚集[10],又参与了肝星状细胞活化表型的转变[1]。醛固酮是纤维化的重要发病因素[11]。研究表明,醛固酮作用于肝星状细胞株HSC-T6 48 h后可以促进Ⅰ、Ⅲ型胶原蛋白及组织金属蛋白酶抑制因子的表达(呈剂量依赖性),发挥促肝纤维化的作用[12]。
近年认识到肝纤维化甚至肝硬化在去除病因、经过恰当治疗后可能逆转[13]。虽然RAAS系统在肝病中的作用还没有被完全阐明,但RAAS可能是抗肝纤维化治疗的潜在靶点。
CCl4诱导的肝纤维化动物模型在形态学、病理生理学某些方面与人肝纤维化相似[14]。本实验运用CCl4诱导制备大鼠肝纤维化模型,病理学检查显示,模型组、卡托普利组、氯沙坦组、螺内酯组肝纤维化程度高于正常组;卡托普利组、氯沙坦组和螺内酯组肝纤维化程度相近,均较模型组明显减轻,提示阻断RAAS不同环节对肝纤维化大鼠具有相同的抑制肝纤维化的作用。
[1]Bataller R,Sancho-Bru P,Gines P,et al.Activated human hepatic stellate cells express the renin-angiotensin system and synthesize angioteasin Ⅱ[J].Gastroenterology,2003,125(1):117-125.
[2]Paizis G,Gilbert RE,Coope rME,et al.Efects of angiotensinⅡtype 1 receptor blockade on experimental hepatic fibrogenesis[J].Hepatol,2001,35(3):376-385.
[3]Brunt EM.Grading and staging the histopathological lesions ofchronic hepatitis:the Knodell histology activity index and beyond[J].Hepatology,2000,31(1):241-246.
[4]Gines P,Cardenas A,Arroyo V,et al.Management of cirrhosis and ascites[J].NEJM,2004,350(16):1646-1654.
[5]Friedman SL.Liver fibrosis-from bench to bedside[J].J Hepatol,2003,38(Suppl1):38-53.
[6]Struthers AD.Aldosterone escape during angintensin converting enzyme inhi-bitor therapy in choronic heart failure[J].Card Fail,1996,2(1):47-54.
[7]Wamoek DG.Prevention protection and the intrarenal renin-angiotensin system[J].Semin Nephrol,2001,21(6):593-602.
[8]Rincon-Sanchez AR,Covarrubias A,Rivas-Estilla AM,et al.PGE2 alleviates Kidney and liver damage,decreases plasma renin activity and acute phase response in cirrhotic rats with acute liver damage[J].Exp Toxicol Pathol,2005,56(4-5):291-303.
[9]Asbert M,Jimenez W,Gays J,et al.Assessment of the lenin-angiotensin system in cirrhotic patients.Comparison between plasma renin activity and direct measurement of immunoreactive renin[J].Hepatol,1992,15(1-2):179-183.
[10]Sewnath ME,Van der PT,van Ncorden CJ,et al.Cholestatie interleukin-6-deficient mice succumb to endotoxiuinduced liver injury and pulmonary inflammation[J].Res Pir Crit Care Med,2004,169(3):413-420.
[11]Lomb M,Alfaidy N,Engone E,et al.Prerequisite for cardiac aldosterone action mineralocorticoid receptor and 11 beta-hydroxysteroid dehydro-genase in the human heart[J].Circulation,1995,92(2):175-182.
[12]王磊,刘海林,黄欣,等.醛固酮对肝星状细胞Ⅰ、Ⅲ型胶原合成及组织金属蛋白酶抑制因子-1mRNA表达的作用[J].中华肝脏病杂志,2004,12(5):308-310.
[13]Siegmund SV,Schwabe RF.Endocannabinoids and liver disease.Ⅱ.Endocannabinoids in the pathogenesis and treatment of liver fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2008,294(2):357-362.
[14]王晓萍.肝纤维化动物模型制作的研究进展[J].甘肃中医,2006,19(1):13.
