开口箭根茎中甾体类化合物的研究
2012-08-02邬昊洋刘呈雄
邬昊洋 王 倩 刘呈雄 邹 坤
(三峡大学 化学与生命科学学院 天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
开口箭 (TupistrachinensisBak.)系 百 合科(LiLiaceae)铃兰族(Convallarieae)开口箭属(Tupistra)植物.开口箭属植物在全球约有20种,我国有12种,是该属植物的分布中心,其主要分布于我国中部和西南部,主产于湖北三峡库区及神龙架林区[1].医书记载,开口箭以根状茎入药,具有清热解毒、祛风除湿、散瘀止痛的功效[2],现代药理实验研究表明其具有较强的抗肿瘤[3-4]、抗炎[5]、抑菌[6]、醒酒[7]等活性.为了深入研究开口箭中甾体皂苷类成分,以期寻找新的抗肿瘤活性成分,以开口箭根茎为原料,采用现代分离方法对其甾体皂苷类成分进行了系统研究,在前期工作的基础上又从其乙醇提取物的正丁醇部位分离得到8个甾体化合物,其中化合物1和2为首次从该属植物中获得.
1 仪器与材料
多功能强制渗漉罐,温州鸿驰化工医药设备有限公司;低温冷冻干燥箱,美国LABCONCO公司;红外光谱仪,美国Nicoler Auatar Speltrometer series FT 360;高效液相色谱仪,Varian公司;中压制备色谱柱YMC(20mm×250mm,5μm),半制备色谱柱 YMC(10mm×250mm,5μm),分析型色谱柱 YMC(4.6 mm×250mm,5μm);质谱用Finnigin电喷雾质谱仪测定;核磁共振用Bruker A-500核磁共振仪测定,TMS为内标,氘代吡啶作溶剂;反相硅胶为YMC RP-C18;高效液相用甲醇、乙腈均为色谱纯,水为三蒸水.
开口箭根茎采自湖北长阳乐园,其原植物标本于2002年7月采自同一地区,经三峡大学化学与生命科学学院陈发菊教授鉴定为TupistrachinensisBak.,植物标本现保存于天然产物研究与利用湖北省重点实验室(编号:2002ZW07408).
2 方法与结果
2.1 提取与分离
开口箭根茎10kg切片,用95%乙醇渗漉提取,反复提取5次,合并滤液,减压浓缩至浸膏状,加少量水混悬,用石油醚(60~90℃)、乙酸乙酯和正丁醇依次萃取,将正丁醇萃取液合并,减压浓缩至棕色浸膏状,取300g浸膏用水溶解,用大孔吸附树脂纯化,分别采用水和70%乙醇水洗脱,70%乙醇水洗脱物即为总皂苷.取总皂苷50g,经常压反相硅胶柱(46mm×600mm)进行分离,用乙腈-水进行梯度洗脱,得到90个流份,将第6个流份用中压制备液相(50%甲醇/水,100min,4.0mL/min,203nm)进行分离得到化合物1(13mg),5(10mg),6(8mg),将第39个流份用中压制备液相(59%甲醇/水,100min,4.0mL/min,203nm)进行分离得到化合物2(20mg),将第81-86个流份用中压制备液相(65%甲醇/水,95min,4.0mL/min,203nm)进行分离得到化合物 3(18 mg).将第27个流份用中压制备液相(52%甲醇/水,95min,4.0mL/min,203nm)进行分离得到化合物4(16mg).将第11个流份用中压制备液相(51%甲醇/水,100min,4.0mL/min,203nm)进行分离得到化合物7(8mg),8(6mg).
2.2 结构鉴定
化合物1白色无定型粉末,正离子ESI-MS显示准分子离子峰 m/z 663.4[M+ Na]+.Molish 和Liebermann-Burchard反应均显示阳性.1H-NMR(in C5D5N,500MHz)显示3个甲基的质子信号δ0.83(3H,s),1.11(3H,d,J=6.5Hz),1.72(3H,s),和1个糖端基质子信号δ5.29(1H,d,J=7.5Hz).13CNMR(in C5D5N,125MHz)共显示33个碳信号,除糖的6个碳信号外(包括端基碳信号δ103.7),还有27个碳信号,以上信息提示化合物1为含一个单糖的甾体皂苷.
13C-NMR显示皂苷元上4个特征碳信号:1个半缩醛碳信号δ109.4(C-22)和3个含氧碳信号δ81.4(C-16),63.0(C-17)和65.1(CH2,C-26),另显示8个连氧碳信号δ78.2(C),67.0,67.2,71.7,73.6,75.6,78.2,79.6(7个 CH)和2个特征烯碳信号δ149.3(C),106.5(CH2),DEPT谱显示其为末端双键.化合物1的13C-NMR和1H-NMR数据与文献报道[8]的化合物3的数据一致.因此将该化合物的结构鉴定为1β,2β,3β,4β,5β-五羟基-螺 甾-△25(27)-烯-5-O-β-D-吡喃葡萄糖苷.该化合物为首次从开口箭属植物中获得,结构式见图1.
化合物2白色无定型粉末,正离子ESI-ES显示准分子离子峰 m/z 515.3[M+Na]+.1H-NMR (in C5D5N,500MHz)显示3个甲基的质子信号δ0.98(3H,s),1.29(3H,s),2.32(3H,s).13C-NMR(inC5D5N,125MHz)共显示 27 个碳信号,结合DEPT谱提示该化合物共有4个季碳原子,12个叔碳原子,8个仲碳原子和3个伯碳原子,其中包括两个双键碳信号δ144.8和δ155.4,以及一个羰基碳信号δ196.4.化合物2的13C-NMR和1H-NMR数据与文献报道[9]的化合物1的数据一致,所以鉴定化合物2的结构为 1β,3β-二羟基-5β-孕甾-△16(17)-烯-20-酮-3-O-β-D-吡喃葡萄糖苷.该化合物为首次从该属植物中分离得到,结构式见图1.
化合物3白色无定型粉末,正离子ESI-ES显示准分子离子峰 m/z 533.5[M+Na]+.Liebermann-Buchard反应显示阳性.13C-NMR(in C5D5N,500 MHz)和DEPT谱表明其有27个碳信号,包括3个甲基,8个亚甲基,11个次甲基和5个季碳,同时还显示双键碳信号δ144.5和δ109.4,DEPT谱显示其为末端双键.其碳谱数据和氢谱数据与文献报道化合物[10]完全一致,所以化合物3结构鉴定为1β,2β,3β,4β,5β,6β,7α-七羟基-5β-呋甾-△25(27)-烯.结构式如图1所示.
化合物4白色针状结晶(甲醇),Liebermann-Buchard反应显阳性.其ESI-MS显示准分子离子峰m/z 531.5[M+Na]+.1H-NMR(in C5D5N,500MHz)显示3个甲基的质子信号δ0.88(3H,s),1.45(3H,s),1.07(3H,d,J=6.5Hz).13C-NMR(in C5D5N,125MHz)共显示27个碳信号,以上信息提示化合物4为甾体皂苷元.
13C-NMR显示其有甾体皂苷元4个特征碳信号:半缩醛碳信号δ109.5(C-22),81.3(C-16),62.9(C-17)和65.0(CH2,C-26),另显示6个连氧碳信号δ76.5,67.9,75.5,71.2,86.3,75.2;还显示1个羰基碳信号δ211.1和2个特征烯碳信号δ144.4(qC),108.6(CH2).化合物4的13C-NMR和1H-NMR数据与文献报道[11]的化合物1的数据一致,所以鉴定化合物4的结构为1β,2β,3β,4β,5β,7α-六羟基-6-氧化-螺甾-△25(27)-烯.结构式见图1.
化合物5白色无定型粉末,Molish和Liebermann-Burchard反应均显示阳性,正离子ESI-MS显示准分子离子峰m/z 813.2[M+Na]+.1H-NMR(in C5D5N,500MHz)显示4个甲基的质子信号δ0.89(3H,s),1.02(3H,d,J=6.5Hz),1.54(3H,s),1.31(3H,d,J=7.0Hz),另显示糖的质子信号δ5.10-3.70,包括2个糖端基质子信号δ4.98(1H,d,J=8.0Hz)和δ4.79(1H,d,J=8.0Hz).13C-NMR(in C5D5N,125MHz)共显示39个碳信号,除2个糖信号外,还有27个碳信号,以上信息提示化合物5为甾体双糖皂苷.
13C-NMR显示其甾体皂苷元有4个特征碳信号:半缩醛碳信号δ110.7(C-22),81.2(C-16),63.9(C-17)和 75.5(CH2,C-26),另显示 3 个连氧碳δ73.0,75.4,75.5;还显示2个端基碳信号δ105.1,102.9.化合物5的13C-NMR和1H-NMR数据与文献报道[12]的化合物1的数据一致.故将该化合物的结构鉴定为3-O-β-D-吡喃葡萄糖基-(25S)-1β,3β,5β,22α,26-五羟基-5β-呋甾-26-O-β-D-吡喃葡萄糖苷.结构式见图1.
化合物6白色无定型粉末,Molish和Liebermann-Buchard反应均显示阳性,正离子ESI-MS显示准分子离子峰 m/z 795.4 [M+Na]+.1H-NMR(in C5D5N,500MHz)显示4个甲基的质子信号δ0.70(3H,s),1.62(3H,s),1.54(3H,s),1.03(3H,d,J=6.5Hz),另显示糖的质子信号δ5.10-3.70,包括2个糖端基质子信号δ4.83(1H,d,J=7.5Hz)和5.00(1H,d,J=7.5Hz).13C-NMR (in C5D5N,125 MHz)共显示39个碳信号,除2个糖信号外,还有27个碳信号,以上信息提示化合物6为甾体双糖皂苷.
13C-NMR显示皂苷元没有半缩醛碳信号δ110,但有甾体皂苷元2个特征碳信号δ84.4(C-16)和64.6(C-17),另显示4个连氧碳δ73.0,75.4,75.2,75.2和2个特征烯碳信号δ152.5(C-22),103.5(C-20),在δ102.9和105.1处显示两个糖的端基碳信号.化合物6的13C-NMR和1H-NMR数据与文献报道[13]的化合物3的数据一致.因此将该化合物的结构鉴定为3-O-β-D-吡喃葡萄糖基-(25S)-1β,3β,5β,26-四羟基-5β-呋甾-△20(22)-烯-26-O-β-D-吡喃葡萄糖苷.结构式见图1.
化合物7白色无定型粉末,Molish和Liebermann-Buchard 反 应 均 显 示 阳 性.13C-NMR (in C5D5N,125MHz)共显示39个碳信号,除2个糖信号外,还有27个碳信号,以上信息提示化合物7为甾体双糖皂苷.
13C-NMR显示其甾体皂苷元有3个特征碳信号:半缩醛碳信号δ110.7(C-22),81.1(C-16)和64.1(C-17),另显示3个连氧碳δ72.4,74.7,75.3;还显示2个端基碳信号δ105.2,101.4.化合物7的13C-NMR和1H-NMR数据与文献报道[13]的化合物1的数据一致.故将该化合物的结构鉴定为3-O-β-D-吡喃葡萄糖基-(25S)-1β,3β,26-三 羟 基-5β-呋 甾-26-O-β-D-吡 喃葡萄糖苷.结构式见图1.
化合物8白色无定型粉末,Molish和Liebermann-Burchard 反 应 均 显 示 阳 性.13C-NMR (in C5D5N,125MHz)共显示39个碳信号,除2个糖信号外,还有27个碳信号,以上信息提示化合物8为甾体双糖皂苷.
13C-NMR显示其甾体皂苷元有3个特征碳信号:半缩醛碳信号δ110.7(C-22),81.1(C-16)和64.1(C-17),另显示3个连氧碳δ72.4,74.7,75.3;还显示2个端基碳信号δ105.2,101.4和2个特征烯碳信号δ139.8(C),124.4(CH).化合物8的13C-NMR和1HNMR数据与文献报道[14]的化合物1的数据一致.故将该化合物的结构鉴定为3-O-β-D-吡喃葡萄糖基-(25R)-1β,3α,26-三羟基-△5(6)-烯-5β-呋甾-26-O-β-D-吡喃葡萄糖苷.结构式见图1.
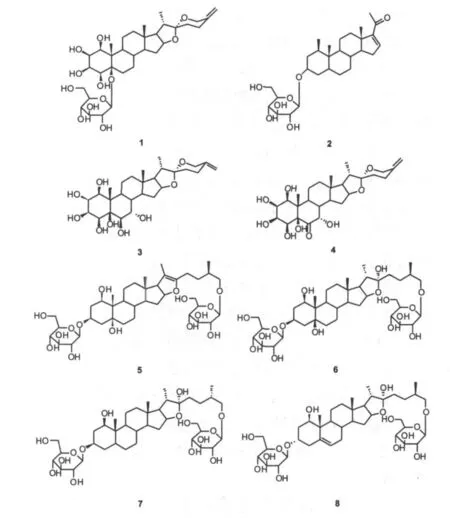
图1 化合物1-8的化学结构式
3 结 语
甾体类化合物具有较好的抗炎、抗肿瘤活性,深入研究开口箭药材中的甾体类化合物成分,以期寻找具有抗炎、抗肿瘤活性的先导化合物,从而为新药开发打下一定的基础.
[1]傅书遐.中国科学院武汉植物研究所编.湖北植物志[M].武汉:湖北科学技术社,2002:498-499.
[2]国家中医药管理局《中华本草》编委会.中华本草:第8册22卷[M].上海:上海科学技术出版社,1999:178-180.
[3]Shen Ping,Wang Sanlong,Yang Chongren,et al.Polyhydroxylated Steroidal Sapogenins from Tupistra Wattii[J].Acta Botanica Sinica,2003,45(5):626-629.
[4]Shen Ping,Wang Sanlong,Liu Xikui,et al.Steroidal Saponins from Rhizomes of Tupistra Wattii Hook.f[J].Chem Pharm Bull,2003,51(3):305-308.
[5]邱 教,董卫国.开口箭提取物对大鼠实验性结肠炎的治疗机制研究[J].山东医药,2005,45(26):4-6.
[6]吴光旭,刘爱媛,魏孝义,等.开口箭甾体皂甙元的分离鉴定及其抗荔枝霜疫霉菌活性[J].武汉植物学研究,2007,25(1):89-92.
[7]汤子春,邹 坤,汪鋆植,等.开口箭、筒鞘蛇菰提取物对小鼠血液中乙醇含量的影响[J].中国民族民间医药杂志,2006,(82):289-291.
[8]Yang Q X,Yang C R.Steroidal Constituents of Aspidistra Elatior from Yongshan,Yunnan[J].Acta Botanica Yunnanica,2000,22:109-115.
[9]徐 鑫,付宏征.吉祥草的化学成分研究[J].中国中药杂志,2008,20(33):2347-2350.
[10]吴光旭,刘爱媛,魏孝义,等.开口箭甾体皂甙元的分离鉴定及其抗荔枝霜疫霉菌活性[J].武汉植物学研究,2007,25(1):89-92.
[11]吴光旭,刘爱媛,魏孝义,等.开口箭甾体皂甙元的分离鉴定及其抗荔枝霜疫霉菌活性[J].武汉植物学研究,2007,25(1):89-92.
[12]Guo Zhiyong,Zou Kun,Wang Junzhi,et al.Structural Elucidation and NMR Spectral Assignment of Three New Furostanol Saponins from the Roots of Tupistra Chinensis[J].Magn.Reson.Chem.,2009,47,613-616.
[13]Zou Kun,WangJunzhi,Guo Zhiyong,et al.Structural Elucidation of Four New Furostanol Saponins from Tupistra Chinensis by 1Dand 2DNMR Spectroscopy[J].Magn.Reson.Chem.,2009,47,87-91.
[14]Yang Q X,Zhang Y J,Li H Z,et al.Polyhydroxylated Steroidal Constituents from the Fresh Rhizomes of Tupistra Yunnanensis[J].Steroids,2005,70:732-737.
