可吸入颗粒中金属元素对DNA的氧化性损伤
2012-08-01刘彦飞邵龙义于倩李光岩许丹宋晓焱
刘彦飞 ,邵龙义,于倩,李光岩,许丹,宋晓焱
(1.黑龙江科技学院 资源与环境工程学院,黑龙江 哈尔滨,150027;2.中国矿业大学(北京)地球科学与测绘工程学院,北京,100083;3.华北水利水电学院 资源与环境学院,河南 郑州,450011)
大气颗粒物对人体健康具有毒性作用[1-2],普遍认为其毒性是过渡金属与其催化氧化生成的有机、无机自由基(ROS)及人体应激反应产生的活性氧(ROS)[3-5]之间对核物质所产生的氧化损伤和水解损伤[6]。PM10样品中提取的Fe的NO3-和SO42-盐类成分能够对沙门氏菌产生诱变[7],且起作用的是Fe2+[8],Cu2+,Cr3+等也能够被氧化为高价态的金属元素,他们在活性氧作用下使DNA发生脂质氧化[1,9-11],从而引发DNA的损伤[12-13]。目前,对颗粒物中过渡金属的毒性研究主要集中在单一元素上,如颗粒物中的元素V与急性肺炎之间、元素Ni与蛋白质的渗出性之间的具有相关性[2],水溶性Zn可以对DNA产生氧化损伤[13]、且与城市心脏病的发病率之间具有相关性[14]等,而且所关注的大多为人为源元素[15]。通常,水溶性Zn2+的毒性明显小于水溶性的Fe,Cu和Ni等[16],但另外的实验结果表明,细胞中的Zn的浓度增加或降低,均可导致Cr6+对DNA的氧化损伤能力的变化[17]。这表明,颗粒物中的金属元素之间可能会产生某种协同损伤作用[18]。另外,颗粒物中存在着一定量的稀土元素,具有遗传毒性[19],但其在颗粒物中所起到的毒性作用还不清楚。本文作者采用等离子质谱(ICP-MS)测定了PM10和PM2.5全样和水溶样中58种元素,采用质粒DNA评价法评价了样品的生物活性,并采用SPSS软件分析PM样品的生物活性(本文指颗粒物对于生物物质——质粒DNA产生的损伤效应)与样品中金属离子之间的关系,以判断颗粒物中的主要相关性元素及其作用行为。
1 材料与方法
1.1 采样及制样
设置3个采样点:市区采样点设置在市区内的黑龙江科技学院嵩山校区主楼5楼顶;近郊区采样点设置在松花江北岸黑龙江科技学院江畔宾馆5楼顶;背景点设在哈尔滨市第二水源地。采用Negretti切割器,流量为100 L/min;滤膜为纤维膜,连续采集20~30 d,然后将滤膜置于硅胶干燥器中,得质量恒定后,小心剥离膜表面的颗粒层。
准确称取一定量的颗粒样品约4 mg,装入10 mL离心管中,同时加入HPLC级H2O配制成颗粒物浓度为1 mg/mL,并置于旋涡振荡器上缓慢振荡6 h。然后,将振荡后的样品分为4份。第1份用于颗粒物全样质粒DNA实验;第2份经过高速离心(13 000 r/min)60 min后吸取上清液,用于颗粒物水溶样质粒DNA实验;第3份也经过60 min高速离心后,吸取上清液用于颗粒物中水溶组分的ICP-MS实验;第4份做全样的ICP-MS实验。
1.2 ICP-MS和质粒DNA分析
将制备好的用于ICP-MS水溶样和全样样品各1 mL分别加入0.5 mL铑(50×10-9)标准溶液和5 mL(2%,体积分数)稀硝酸溶液,然后进行ICP-MS(PerkinElmer Elan 5000)分析,检测22个样品中的58种微量元素。
依据质粒DNA评价法[18],对配制不同剂量(质量浓度,μg/mL)的颗粒物样品的全样和水溶样对质粒DNA( μX174-RF)进行损伤实验,并通过凝胶电泳和紫外成像系统(SynopticsLtd, Cambridge, UK)、Syngene-Genetools程序统计样品对质粒DNA损伤率,最后应用线性回归的方法获取样品的TD40值(TD40值为造成40%的DNA损伤所需的颗粒剂量,TD40值越小,颗粒物的生物活性越高)。
2 结果
2.1 PM10和PM2.5水溶样和全样对质粒DNA的损伤
使用质粒DNA评价法研究了哈尔滨市区和郊区、背景点采集的PM10和PM2.5样品的水溶样和全样的生物活性,样品信息见表1,经线性回归分析获得的样品TD40值见表2和表3。
表2和表3表明,PM10和PM2.5水溶样和全样对质粒DNA都具有活性,而且其损伤的TD40值的变化范围较大,反映了样品的时空变化导致其TD40值的变化较大;最小值为67.9 μg/mL,最大值为1 570 μg/mL,且大多数样品的全样较水溶样具有更强的损伤能力(TD40值较小),但也有部分样品的损伤能力正好相反。这表明,PM的生物活性主要与其来源和性质有关。
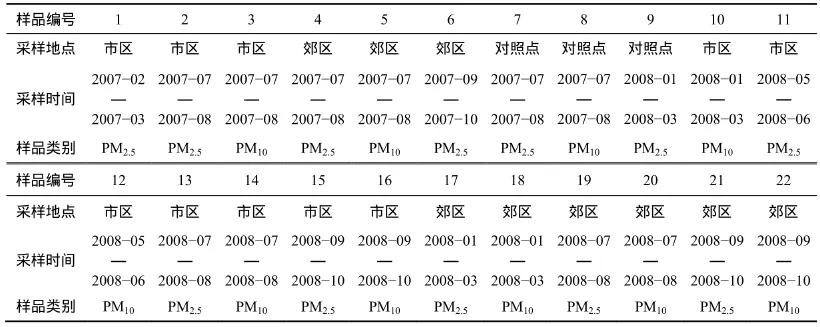
表1 样品信息Table1 Sample information
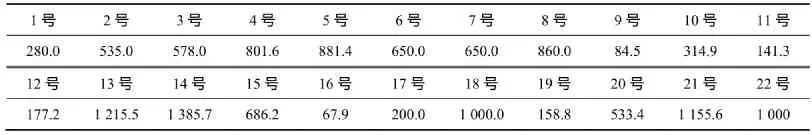
表2 哈尔滨市市区、郊区和清洁对照点采集的大气颗粒物水溶样对质粒DNA的损伤Table2 Quantification of oxidative DNA damage induced by soluble fraction of airborne PM samples collected in Harbin urban area, a suburban sites and a clean air area TD40/(μg·mL-1)
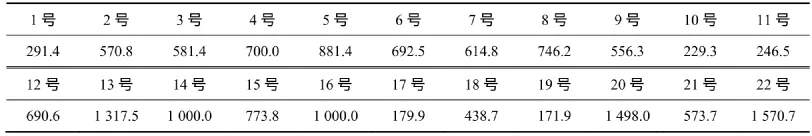
表3 哈尔滨市市区、郊区和清洁对照点采集的大气颗粒物全样对质粒DNA的损伤Table3 Quantification of oxidative DNA damage induced by airborne PM whole samples collected in Harbin urban area, a suburban sites and a clean air area TD40/(μg·mL-1)
2.2 PM10和PM2.5中微量元素的富集因子分析
采用双重归一化的富集因子法方法,判断元素在大气颗粒物中的富集程度和来源[20]。其富集因子F为:
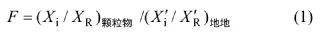
式中:(Xi/XR)颗粒物为即颗粒物中待考元素i与参比元素R的相对浓度;为地地中相应元素i(中国土壤元素含平均值)和R的平均丰度求得的相对浓度,参比元素R为Al[21]。当某种元素的F值大于10时,该元素被富集与人为污染源有关[22]。经实测PM中58种元素含量及对计算结果统计,不同地区和季节所采集的PM样品中,Pb,Sb,Zn,Cd,Sn,Tl,Te,Bi,V,As,Ag,In,Mo,Cu,Ga,Cr,W等17种元素的富集因子平均值大于10,即这些颗粒主要来自人为污染。
2.3 PM10和PM2.5水溶样TD40值与样品微量元素之间的回归分析
利用SPSS.11软件对各样品的TD40值与其所含58种微量元素之间进行多元线性分析,得出回归方程(2)和(3):
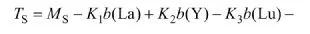
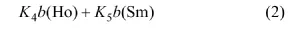
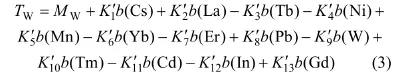
式中:TS和TW为水溶样和全样的TD40值;M为常量;K为系数;b为质量摩尔浓度,μmol/g。
除了Y为第Ⅲ副族元素外,式(2)方程中其他相关性元素都是镧系元素,且均为稀土元素;与方程(2)相比,方程(3)中的相关元素明显增多,其中Cs,In,Cd为主、副族元素,其他均为过渡金属元素(包括稀土)。表4和表5所示分别为哈尔滨市PM样品水溶样和全样回归方程中相关性元素的ICP-MS实测值。根据其富集因子可知,除了Pb,W,Cd,In 4种元素为人来源外,其余均为自然源。由此可见,全样品中的生物活性元素可来源于人为源和自然源,而且涵盖了过渡金属、碱金属或其他主族类,但稀土金属对颗粒物的生物活性影响显著。
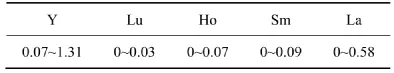
表4 哈尔滨市可吸入颗粒物中5种元素的质量分数Table4 Mass fraction of five elements in PM samples collected in Harbin μg/g
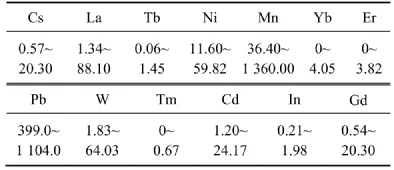
表5 哈尔滨市可吸入颗粒物全样中13种元素的质量分数Table5 Mass fraction of thirteen elements in whole PM samples collected in Harbin μg/g
经方差分析与检验,水溶样TD40值与La,Y,Lu,Ho,Sm之间、全样TD40值与Cs,La,Tb,Ni,Mn,Yb,Er,Pb,W,Tm,Cd,In,Gd之间有直线关系。水溶样中,TD40与元素Y正相关,即随着元素Y浓度的增加,颗粒的生物活性将降低,而在对损伤质粒DNA的作用行为上,Y拮抗La,Lu,Ho,Sm的损伤作用;在全样中,TD40与全样中元素Cs,La,Mn,Pb,Tm,Gd浓度呈正相关,与元素Tb,Ni,Yb,Er,W,Cd,In浓度负相关,在损伤行为上,元素Cs,La,Mn,Pb,Tm,Gd协同拮抗元素Tb,Ni,Yb,Er,W,Cd,In的损伤行为。
3 讨论
3.1 可吸入颗粒TD40回归值的误差分析
应用ICP-MS测试数据,根据式(2)和(3),可回归计算出水溶样和全样对DNA损伤的TD40值及其与实测值间的相对误差,结果见表6。从表6可知:在PM全样中,除了16号样品的回归值与实测值间的相对误差较大外,其他样品的相对误差都较小,表现出较好的拟合效果;而在PM水溶样中,回归值与实测值相对误差较全样的大。但从总体上看,样品的实测值和回归值计算值相差不大,表明回归方程的计算结果比较可信。
3.2 金属元素对质粒DNA损伤能力分析
金属元素对质粒DNA损伤,主要是以八面体水合离子对DNA的脱氧核糖糖环、碱基进行攫氢氧化和直接进攻磷酸二酯键引起DNA的水解2种形式进行的。
一般地,单价态金属阳离子优先与核酸的磷酸基配位,但作用位置选择性不强,而二价阳离子与磷酸基和碱基都能配位,特别是过渡金属有d轨道,可与DNA 碱基直接键合。在生理酸碱度和一定H2O2浓度下,Fe2+,V4+,Cr3+,Cu2+,Co2+,Ni2+,Pb2+,Cd2+等均能对8-羟基脱氧嘌呤的产生损伤,而且Fe2+产生羟基自由基能力远大于其他金属的能力[23];过渡金属与DNA之间形成八面体金属配合物,并使DNA碱基产生氧化和断裂[24]。过渡金属还易以插入的方式或静电结合的方式与DNA的含O基团结合,特别是稀土离子具有更小的离子半径、较高的电荷及离子势,其结合和损伤能力更强。
一般认为,稀土金属都有遗传毒性[25-27]。低浓度的钇等离子可以强烈抑制人体红细胞膜过氧化作用,高浓度时具有明显的促进作用[28]。钇和镨的氯化物均可使淋巴细胞DNA受损[29]。Y能够对大鼠脑组织和外周血淋巴DNA产生损伤[30-31],在高浓度喂养下,子代小鼠脑、内脏组织中的Cu,Cd,Pb含量没有变化,而其组脑组织中稀土Y含量、脾脏中Se含量却显著增加,肝、肾中Se也有略有增加趋势;低浓度喂养时,脑组织中Cu,Cd,Pb含量无明显变化、而脾脏中Se的含量显著增加,表明稀土钇可进入幼鼠脑组织中、稀土的长期摄入不会增加Cd和Pb等有害元素的摄入和吸收,而且稀土元素Y的抗氧化性可能与增加Se的吸收有关[32]。因此,Y虽然具有一定的遗传毒性,但Y与DNA结合后,可能一定程度上抑制了其他元素与DNA的结合和断裂作用,从而在PM水溶样(低浓度)中的作用行为表现为拮抗。
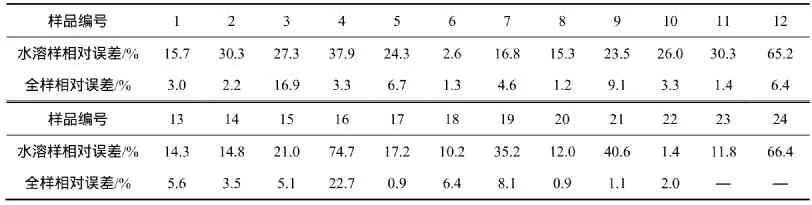
表6 哈尔滨市可吸入颗粒DNA氧化损伤TD40回归值的相对误差Table6 Relative error study on regression value of inhalable particles DNA oxidative damage TD40 in Harbin
对于其他镧系金属,低浓度的Ce(No3)3能够对DNA产生损伤[33];低剂量氯化钬染毒时,不能使小鼠肝脏细胞DNA凋亡(apoptosi),高剂量染毒时,小鼠肝脏细胞凝胶电泳有弥散性拖尾现象[34];对大鼠进行镧暴露,子代大鼠脑组织发生脂质过氧化损伤[35];Ce(Ⅲ)和 Nd(Ⅲ)对脾脏细胞氧化损伤和毒性作用超过Ce(Ⅲ)和La(Ⅲ)[36],这表明稀土元素之间具有协同损伤作用。在本研究中,水溶样和全样中La的作用正常相反,在低浓度(水溶样)时为表现为损伤作用,而在高浓度(全溶样)时表现为拮抗作用,进一步研究结果表明,由于竞争结合作用,各种金属的作用行为与其浓度作用范围有关。
4 结论
(1)受时空变化影响,哈尔滨市PM10和PM2.5的生物活性变化较大,其TD40值最小为67.9 μg/mL,最大为1 570 μg/mL;PM的生物活性主要与其来源和性质有关。
(2)PM10和PM2.5水溶样和全样的TD40值与样品中部分微量元素之间具有线性关系,水溶样中元素Y拮抗La,Lu,Ho,Sm的协同损伤作用。全样中元素Cs,La,Mn,Pb,Tm,Gd协同拮抗Tb,Ni,Yb,Er,W,Cd,In的协同损伤作用。
(3)过渡金属、碱金属或其他主族金属元素都具有较强的生物活性作用,其中稀土元素对颗粒物的生物活性具有显著影响,而且不同金属的作用行为与其浓度有关。
[1]Costa D L,Dresher K L.Bioavailable transition metals in Partieu late matter mediate cardiopulmonary injury in healthy and eomopromised animal models[J].Environmental Health Pers Pectives, 1997, 105(s5): 1053-1060.
[2]Kodavanti U P, Hauser R, Christiani D C.Pulmonary response to oil fly ash particles in rat differ by virtue of their specific soluble metals[J].Toxicological Science, 1998, 43(2): 204-212.
[3]董永彭, 倪新伯, 张元勋, 等.气溶胶自由基毒理学机制的研究[J].环境科学学报, 2001, 21(6): 654-659.TONG Yong-peng, NI Xin-bo, ZHANG Yuan-xun, et al.The study on free radical toxicological mechanism of aerosols[J].Acta Scientiae Circumstantiae, 2001, 21(6): 654-659.
[4]Risom L, Møller P, Loft S, et al.Oxidative stress-induced DNA damage by particulate air pollution[J].Mutation Research, 2005,592: 119-137.
[5]Rossner P, Svecova V, Milcova A, et al.Seasonal variability of oxidative stress markers in city bus drivers Part Ⅱ.Oxidative damage to lipids and proteins[J].Mutation Research, 2008, 642:21-27.
[6]刘长林, 余四旺, 徐辉碧, 等.过渡金属配合物断裂双链DNA及其机理[J].无机化学学报, 2006, 16(3): 374-384.LIU Chang-lin, YU Si-wang, XU Hui-bi, et al.Progress on the mechanisms for double-stranded DNA seissio mediated by transition metal complexes[J].Chinese Journal of Inorganic Chemistry, 2006, 16(3): 374-384.
[7]Gilli G, Traversi D, Rovere R, et al.Chemical characteristics and mutagenic activity of PM10in Torino, a Northern Italian City[J].Science of the Total Environment, 2007, 385: 97-107.
[8]Donaldson K, Brown D W, Mitchell C.Free radical activity of PM10iron-mediated generation of hydroxyl radicals[J].Environmental Health Perspectives, 1997, 105(s5): 1285-1289.
[9]袭著革, 晁福寰, 孙咏梅, 等.金属离子介导活性氧引起DNA氧化损伤及机制研究[J].环境科学学报, 2003, 23(5):662-667.XI Zhu-ge, CHAO Fu-huan, SUN Yong-mei, et al.Study on the mechanism of oxidative damage of DNA induced by reactive oxygen species due to metal ions[J].Acta Scientia Circumstanitae, 2003, 23(5):662-667.
[10]袭著革, 晁福寰, 孙咏梅, 等.柴油废气成分分析及DNA生物氧化能力[J].中国公共卫生, 2004, 20(4):149-421.XI Zhu-ge, CHAO Fu-huan, SUN Yong-mei, et al.Analysis on diesel oil vehicle exhaust and its oxidative DNA damage[J].Chin J Public Health, 2004, 20(4): 149-421.
[11]Hsiao W L W, Mo Z Y, Fang M, et al.Cytotoxicity of PM2.5and PM2.5-10ambient air pollutants assessed by the MTT and the Comet assays[J].Mutation Research, 2000, 471(1/2): 45-55.
[12]Tsou T C, YANG Jia-ling.Formation of reactive oxygen species and DNA strand breakage during interaction of chromium(Ⅲ)and hydrogen peroxide in vitro: Evidence for a chromium(Ⅲ)-mediated Fenton-like reaction[J].Chemico-Biological Interactions, 1996, 102(3): 133-153.
[13]Gałazyn-Sidorczuk M, Brzóska M M, Jurczukm, et al.Oxidative damage to proteins and DNA in rats exposed to cadmiumand or ethanol[J].Chemico-Biological Interactions, 2009, 180(1):31-38.
[14]Kodavanti U P, Schladweiler M C, Gilmour P S, et al.The role of particulate matter-associated zinc in cardiac injury in rats[J].Environmental Health Perspectives, 2008, 116(1): 13-20.
[15]LIN Ai-jun, ZHANG Xu-hong, CHEN Mei-mei, et al.Oxidative stress and DNA damages induced by cadmium accumulation[J].Journal of Environmental Sciences, 2007, 19(5): 596-602.
[16]Grigg J.Effect of biomass smoke on pulmonary host defence mechanisms[J].Paediatric Respiratory Reviews, 2007, 8(4):287-291.
[17]Rudolf E, Ĉervinka M.The role of intracellular zinc in chromium(Ⅵ)-induced oxidative stress, DNA damage and apoptosis[J].Chemico-Biological Interactions, 2006, 162(3):212-227.
[18]SHAO Long-yi, SHI Zong-bo, Jones T P, et al.Bioreactivity of particulate matter in Beijing air: Results from plasmid DNA assay[J].Science of the Total Environment, 2006, 367(1):261-272.
[19]朱兵, 李新民, 吴亦洁, 等.稀土元素对3/-腺嘌呤及3/-鸟嘌呤核酣酸的水解断裂作用[J].化学学报, 1998, 56(1): 47-51.ZHU Bing, LI Xin-min, WU Yi-jie, et al.Hydrolytic cleavage of adenosine-monophosphate and guanosine-3′-monopho-sphate by lanthanides[J].Acta Chimica Sinica, 1998, 56(1): 47-51.
[20]Mckenzie E R, Wong C M, Green P G, et al.Size dependent elemental composition of road-associated particles[J].Science of the Total Environment, 2008, 398(1/2/3): 145-153.
[21]Ragosta M, Caggiano R, Macchiato M, et al.Trace elements in daily collected aerosol: Level characterization and source identification in a four-year study[J].Atmospheric Research,2008, 89(1/2): 206-217.
[22]LU Sen-lin, YAO Zhen-kun, CHEN Xiao-hui, et al.The relationship between physicochemical characterization and the potential toxicity of fine particulates (PM2.5)in Shanghai atmosphere[J].Atmospheric Environment, 2008, 42(31):7205-7214.
[23]Poulsen H.Comparative study of the formation of oxidative damage marker 8-hydroxy-2'-deoxyguanosine (8-OHdG)adduct from the nucleoside 8-hydroxy-2'-deoxyguanosine by transition metals and suspensions of particulate matter in relation to metal content and redox reactivity[J].Free Radical Research, 2005,39(10): 1071-1081.
[24]Vaidyanathan V G, Nair B U.Photooxidation of DNA byaeoba(Ⅱ)tridentate complex[J].J Inorg Biochem, 2003, 94:121-126.
[25]Morishita M, Keeler G J, Mcdonald J D, et al.Source-to-receptor pathways of anthropogenic PM2.5in Detroit, Michigan:Comparison of two inhalation exposure studies[J].Atmospheric Environment, 2009, 43(10): 1805-1813.
[26]LIU Yong-chun, YANG Zheng-yin.Synthesis, crystal structure,antioxidation and DNA binding properties of binuclear Ho(Ⅲ)complexes of Schiff-base ligands derived from 8-hydroxyquinoline-2-carboxyaldehyde and four aroylhydrazines[J].Journal of Organometallic Chemistry, 2009,694(19): 3091-3101.
[27]LI Xiang, GE Zhi-qiang.Effects of different valences of ceriumion on conformation of Horseradish Peroxi-dase[J].Journal of Rare Earths, 2008, 26(6): 857-863.
[28]刘湘陶, 李榕, 陈景云, 等.镧、铈、钇、铽离子对人体红细胞膜自由基氧化的影响[J].中国稀土学报, 2000, 18(1): 88-90.LIU Xiang-tao, LI Rong, CHEN Jing-yu, et al.Effects of La, Ce,Y, Tb on oxidation of ghost of human erythrocyte[J].Journal of Chinese Rare Earths Society, 2000, 18(1): 88-90.
[29]杨辉, 嵇庆, 张锡然.氯化钇和氯化镨引起的人淋巴细胞DNA分子损伤的研究[J].遗传, 1998, 20(2): 16-18.YANG Hui, JI Qing, ZHANG Xi-ran, et al.A study of DNA damage in Human lymphocytes induced by Yttrium Chloride and Praseodymium Chloride[J].Hereditas of China, 1998, 20(2):16-18.
[30]YANG Wei-dong, ZHANG Ping, LIU Jie-sheng, et al.Effect of long-term intake of Y3+in drinking water on gene expression in brains of rats[J].Journal of Rare Earths, 2006, 24(3): 369-373.
[31]薛艳芳, 杨维东, 刘洁生, 等.钇对大鼠外周血淋巴细胞DNA损伤作用[J].中国公共卫生, 2008, 24(3): 348-349.XUE Yan-fang, YANG Wei-dong, LIU Jie-sheng.Effects of Y3+on DNA damage in peripheral blood lymphocyte cells of rats[J].Chin J Public Health, 2008, 24(3): 348-349.
[32]杨维东, 刘洁生, 申治国, 等.稀土元素钇对子代小鼠体内痕量元素的影响[J].卫生研究, 2003, 32(5): 427-428.YANG Wei-dong, LIU Jie-sheng, SHEN Zhi-guo, et al.Effect of the long-term intake of yttrium in drinking water on trace elements in F1 generation mice[J].Journal of Hygiene Research of China, 2003, 32(5): 427-428.
[33]杨维东, 罗琛, 田雪梅, 等.Ce(NO3)3对不同细胞DNA的损伤作用研究[J].中山大学学报: 自然科学版, 1999, 38(5): 50-53.YANG Wei-dong, LUO Chen, TIAN Xue-mei, et al.DNA damage of 3T3 and lovo induced by Cerous Nitrate[J].Acta Scientiarum Naturalium Universitatis Sunyatseni of China, 1999,38(5): 50-53.
[34]汪承润, 闵莉, 吴薇, 等.钬元素对小鼠肝脏细胞损伤的影响[J].癌变·畸变·突变, 2004, 16(4): 226-228.WANG Cheng-run, MIN Li, WU Wei, et al.Effects of holmium element on DNA lesion of mice liver cells in vivo[J].Carcinogenesis, Teratogenesis and Mutagenesis of China, 2004,16(4): 226-228.
[35]戚大煜, 蔡原, 巫生文.哺乳期母鼠镧暴露对子代脑组织氧化损伤影响[J].中国公共卫生, 2006, 25(6): 704-705.QI Da-yu, CAI Yuan, W
[36]U Sheng-wen.Oxidative injury effect of lanthanum exposure during lactation on brain tissue of offspring rat[J].Chin J Public Health, 2006, 25(6): 704-705.
[37]LIU Jie, LI Na, MA Ling-lan, et al.Oxidative injury in the mouse spleen caused by lanthanides[J].Journal of Alloys and Compounds, 2010, 489(2): 708-713.
