石菖蒲不同药效部位改善阿尔茨海默病模型小鼠的认知功能*
2012-07-31田素民马宇昕孙灵芝李国营
田素民,马宇昕,孙灵芝,谭 亮,刘 靖,李国营△
(广东药学院基础学院1生理学教研室,2人体解剖学教研室,广东 广州 510006)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的神经系统退行性疾病,其典型的病理学特征包括淀粉样β蛋白(amyloid β -protein,Aβ)沉积形成老年斑,神经元细胞内神经纤维缠结,病因和发病机制目前仍不明确。Aβ的异常沉积被公认为导致AD的最后共同途径[1],Aβ持续损伤神经细胞将导致认知障碍和行为障碍[2]。近年来,一氧化氮(nitricoxide,NO)作为气体信号分子参与学习记忆的生理和病理过程,引起了研究者们的高度重视。研究表明NO可诱发长时程增强作用(lone-term potentiation,LTP)这一突触可塑性及学习记忆的主要机制。一氧化氮合酶(nitricoxide synthase,NOS)是体内催化生成NO的关键性酶,它的变化即意味着NO的改变。石菖蒲为天南星科多年生草本植物石菖蒲的干燥根茎,具有开窍豁痰、化湿开胃、醒神益智之功效,有研究表明石菖蒲还具有抗痴呆、改善学习记忆的功效,是临床所有抗痴呆、改善记忆的中药复方中最常用的单味中药[3-5]。为研究石菖蒲的抗痴呆、改善学习记忆功效的有效部位,及改善Aβ致小鼠认知功能损伤的机制,拟采用海马内注射Aβ1-42建立认知障碍小鼠模型,观察石菖蒲不同药效部位对认知功能障碍小鼠大脑匀浆和海马组织中NOS活性的影响,探讨石菖蒲不同提取部位改善Aβ致小鼠认知功能障碍是否与NOS机制相关,为揭示临床应用石菖蒲治疗抗老年性痴呆、改善记忆功能的机制提供理论依据。
材料和方法
1 材料
Aβ1-42(Anaspec),石菖蒲 (粤Y20060076,批号20100801,产地山西,广州市天河宝润堂中药饮片厂),改良型Bradford法蛋白浓度测定试剂盒(上海生工生物工程技术服务有限公司),NOS测定试剂盒(南京建成生物工程研究所),万能粉碎机(FZ-220型,温岭市牧屿百乐机床厂),循环水式真空泵(SHZ-DCⅢ,河南省巩义市英屿予华仪器厂),小鼠脑立体定位仪(ST-3ND,成都仪器厂),Morris水迷宫(淮北正华生物仪器设备有限公司),石蜡切片机(金华市益迪医疗设备)。
2 方法
2.1 AD动物模型制备及动物分组 健康成年雄性NIH小鼠(9周龄)、体重18~20 g,由广东省实验动物中心提供,许可证号SCXK(粤)2008-0002。AD动物模型按如下方法制备:Aβ1-42干粉(500 μg)溶解在含有1%NH4OH 250 μL 的生理盐水中,混匀,即Aβ1-42溶液浓度稀释至2 g/L,37℃恒温箱孵育1周左右,使其转变为聚集态。小鼠称重后,用戊巴比妥钠进行麻醉(50 mg/kg,50 g/L,ip)。用脑立体定位仪取平颅头位固定小鼠,剪开头皮,暴露前囟,按小鼠脑立体定位图谱进行定位[6-7],在前囟后 2 mm,正中线旁 1.5 mm,颅骨表面下1.9 mm为双侧海马CA1注射点。用微量注射器缓慢注入 Aβ1-42,每侧2 μL,进样速度为 0.8 μL/min。注射完毕,留针5 min后,缓慢退针以防拔针时药物溢出。术后骨蜡封口,缝合伤口[8],连续3 d肌注青霉素G 8×105U以防感染。
AD模型组动物首先从制备过程顺利、出血少、术后恢复良好的小鼠中选取。然后,通过水迷宫测试,以生理盐水模拟注射小鼠和正常小鼠为对照,将认知功能有显著差异的Aβ1-42注射小鼠留作实验(该模型成功率85.71%)。随机分为4组:生理盐水灌胃组、水煎液灌胃组、去油水煎液灌胃组和挥发油灌胃组,每组6只。
2.2 石菖蒲不同药效部位的提取[9]药材经鉴定为正品天南星科植物石菖蒲的干燥根茎,药材打粗粉,过2号筛(20目)。
2.2.1 挥发油部位 称取石菖蒲粗粉200 g,加10倍量水,浸泡1 h,加沸石几粒,水蒸气蒸馏法提取,至挥发油不再增多时,停止加热。测得挥发油含量1.56% >1.0%,符合药典标准。灌胃前取挥发油适量,用1% 吐温-80稀释100倍备用。
2.2.2 去油水煎液部位 收集提取挥发油后的石菖蒲残渣,经真空泵过滤,滤液浓缩至200 mL(1∶1)。
2.2.3 水煎液部位 石菖蒲粗粉200 g,加10倍量的水,浸泡1 h,回流提取1 h,残渣用1000 mL水进行煎煮。合并2次滤液,低温浓缩至200 mL,即为石菖蒲水煎液(1∶1)。
2.3 AD模型小鼠灌胃给药 生理盐水灌胃组(作为石菖蒲灌胃的对照组,0.25 mL/10 g BW)、水煎液灌胃组(0.2 mL/10 g BW)、去油水煎液灌胃组(0.2 mL/10 g BW)和挥发油灌胃组(0.2mL/10 g BW),连续灌胃3周。
2.4 水迷宫测验 Morris水迷宫包括小鼠行为学测试系统、图像自动监视处理系统及数据处理分析系统。水池直径120 cm,高60 cm,平台直径12 cm,水温(25±2)℃。(1)定位航行实验:所有小鼠进行隐藏平台实验,历时5 d,每天定时训练4次,将小鼠依次从4个指定的标记点,面向池壁放入水中[10],记录小鼠在1 min内寻找平台所需时间 (逃避潜伏期)。在每个时间段的训练中,如小鼠在1 min内成功爬上平台,记录下其所需的时间,并允许它们在平台上呆30 s,然后结束该次训练。如果小鼠在1 min内未能找到平台,将其引导到平台上,并停留30 s,逃避潜伏期记录为1 min。逃避潜伏期越长,代表小鼠的学习记忆能力越差。(2)空间探索室验:第6 d撤出平台,任选1个入水点将小鼠面向池壁放入水中,记录小鼠在1 min内进入原平台象限的时间。
2.5 组织样品处理及检测 小鼠经戊巴比妥钠腹腔注射麻醉(50 mg/kg,50 g/L,ip),断头处死,迅速于冰盒上取大脑或剥出完整的海马,将组织置于冰冷的生理盐水中漂洗,滤纸吸干,称重,制成10%大脑匀浆和10%海马匀浆。3000 r/min离心15 min,取上清液。采用考马斯亮蓝测定法测定组织中蛋白含量,分光光度法测定组织中NOS含量。具体操作均按照试剂盒说明书进行。
2.6 免疫组织化学方法检测脑组织中NOS的表达 小鼠经戊巴比妥钠腹腔注射麻醉(50 mg/kg,50 g/L,ip),施行左心室-主动脉灌注,先用0.9%生理盐水快速冲洗血液,继之,用含4%多聚甲醛的0.1 mol/L的磷酸缓冲液(PBS,pH 7.4,4℃)继续灌注,待充分固定后,迅速取材脑组织,并置于上述相同固定液中4℃后固定过夜。NOS免疫组化染色具体步骤如下:切片常规脱蜡至水,浸入0.01 mol/L的柠檬酸盐缓冲液(pH 6.0)微波修复20 min。冷却后用3%过氧化氢室温孵育30 min以灭活内源性酶。5%BSA室温30 min。每张切片加1∶100 NOS抗体,4℃过夜。生物素化山羊抗兔IgG室温孵育40 min。SABC室温孵育30 min。DAB显色,阳性显色为棕黄色。各步骤间PBS(pH 7.4)洗涤3次。苏木素轻度复染,脱水、透明、封片后光学显微镜进行观察。
3 统计学处理
数据用SPSS 16.0统计软件进行统计分析。数据以均数±标准差()表示。组间比较采用单因素方差分析ANOVA,以P<0.05为差异有统计学意义。
结 果
1 水迷宫测验
4组AD模型小鼠(生理盐水灌胃组、水煎液灌胃组、去油水煎液灌胃组和挥发油灌胃组)空间探索实验结果显示,与生理盐水灌胃组相比,灌服石菖蒲不同药效部位(水煎液和挥发油)的2个组60 s内跨越平台的次数和在目标象限的探索时间都明显增加,差异显著(P<0.05),去油水煎液灌胃组有改善但无显著差异,见表1。
表1 4组小鼠空间探索比较Table 1.Comparison of spatial performance of mice in the four groups(.n=6)

表1 4组小鼠空间探索比较Table 1.Comparison of spatial performance of mice in the four groups(.n=6)
*P <0.05 vs AD plus saline group.
Group Frequencies of across platform in 60 s Swimming time in target quadrant(s)AD plus saline 2.250 ±0.510 16.705 ±0.771 AD plus decoctum 4.011 ±1.414* 26.145 ±0.770*AD plus decoctum without oil 3.018 ±1.414 20.085 ±0.516 AD plus essential oil 5.015 ±0.021* 22.110 ±0.665*
2 石菖蒲不同药效部位对AD模型小鼠大脑组织NOS活性的影响
与生理盐水灌胃模型组相比,灌服石菖蒲不同药效部位的3组AD模型小鼠大脑组织NOS活性均有降低。其中,挥发油灌胃组与生理盐水灌胃组相比小鼠大脑NOS活性有显著差异(P<0.05),见表2。
3 石菖蒲不同药效部位对AD模型小鼠海马组织NOS活性的影响
灌服石菖蒲不同药效部位的3组AD模型小鼠海马组织NOS活性均明显降低。与生理盐水灌胃相比,石菖蒲不同药效部位灌胃3组小鼠海马NOS活性均有显著差异(P<0.01),见表3。
表2 各组小鼠大脑NOS活性Table 2.NOS activity in the mouse cerebrum in each group(.n=6)

表2 各组小鼠大脑NOS活性Table 2.NOS activity in the mouse cerebrum in each group(.n=6)
*P <0.05 vs AD plus saline group.
AD plus saline 1.124 ±0.119 AD plus decoctum 1.106 ±0.455 AD plus decoctum without oil 0.933 ±0.066 AD plus essential oil 0.467 ±0.074*
表3 各组小鼠海马NOS活性Table 3.NOS activity in the hippocampus of mice in each group(.n=6)

表3 各组小鼠海马NOS活性Table 3.NOS activity in the hippocampus of mice in each group(.n=6)
**P <0.01 vs AD plus saline group.
AD plus saline 1.180 ±0.036 AD plus decoctum 0.750 ±0.021**AD plus decoctum without oil 0.755 ±0.163**AD plus essential oil 0.624 ±0.040**
4 免疫组织化学检测
棕黄色的阳性产物分布于胞膜和胞浆,胞核不着色。阳性细胞多分布在海马、齿状回和皮质,正常组海马NOS阳性神经元以锥体细胞为主,模型组则以圆形细胞为主。灌服石菖蒲不同药效部位的3组和生理盐水灌胃组相比,阳性神经元数量明显减少,染色程度变浅,尤其是挥发油组(P<0.05),见图1。免疫组织化学的定性和定量结果与上述NOS活性的检测结果基本一致,见图2。
讨 论
学习和记忆属于脑的高级功能,是认知活动的重要方面。评价动物认知功能的常用方法之一是学习记忆行为测试。Morris水迷宫可以检测与海马功能直接相关的空间学习记忆的形成和维持时间,被广泛应用于神经生物学研究领域。Morris水迷宫的空间探索实验用于检测动物保持记忆的能力。本研究Morris水迷宫实验结果显示,AD+石菖蒲不同药效部位灌胃组的小鼠和其对照组相比,前者在目标象限的探索时间和60 s内跨越平台的次数均有增加。其中水提液灌胃组和挥发油灌胃组对小鼠认知功能的改善最为明显,与对照组相比差异显著。这表明石菖蒲挥发油组和水煎液组对学习记忆的改善作用更佳,这就意味着在这2组提取液中含有对改善学习记忆功能更有效的药效成分,这为进一步研发抗老年性痴呆的药物提供了科学依据。
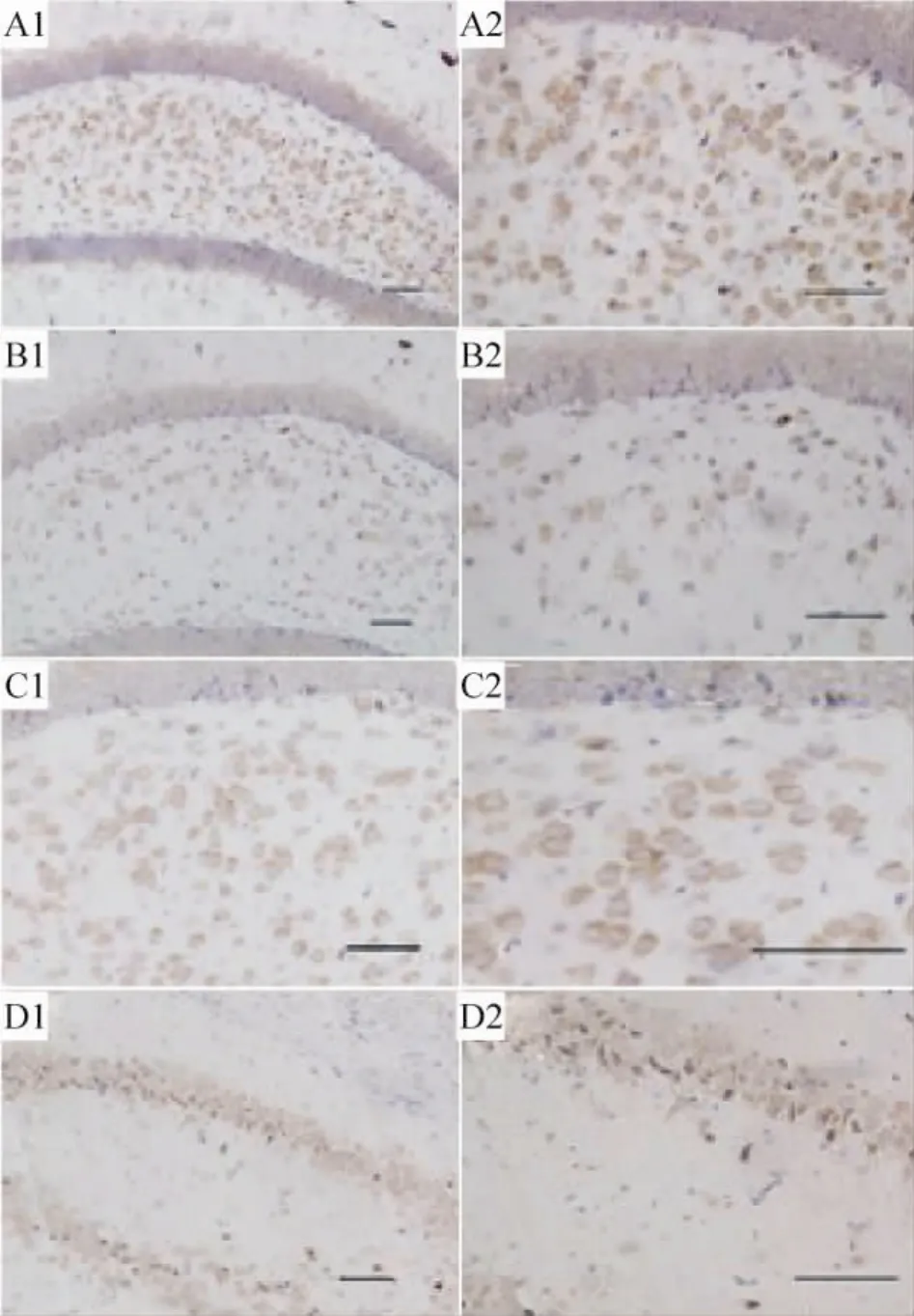
Figure 1.After mice were treated with different fractions of Acori graminei rhizome,NOS expression in the brain was shown.A1,A2:AD plus saline group;B1,B2:AD plus decoctum group;C1,C2:AD plus decoctum without oil group;D1,D2:AD plus essential oil group.Scale bar=100 μm.图1 各组小鼠灌服石菖蒲不同药效部位后,NOS在脑组织中的表达
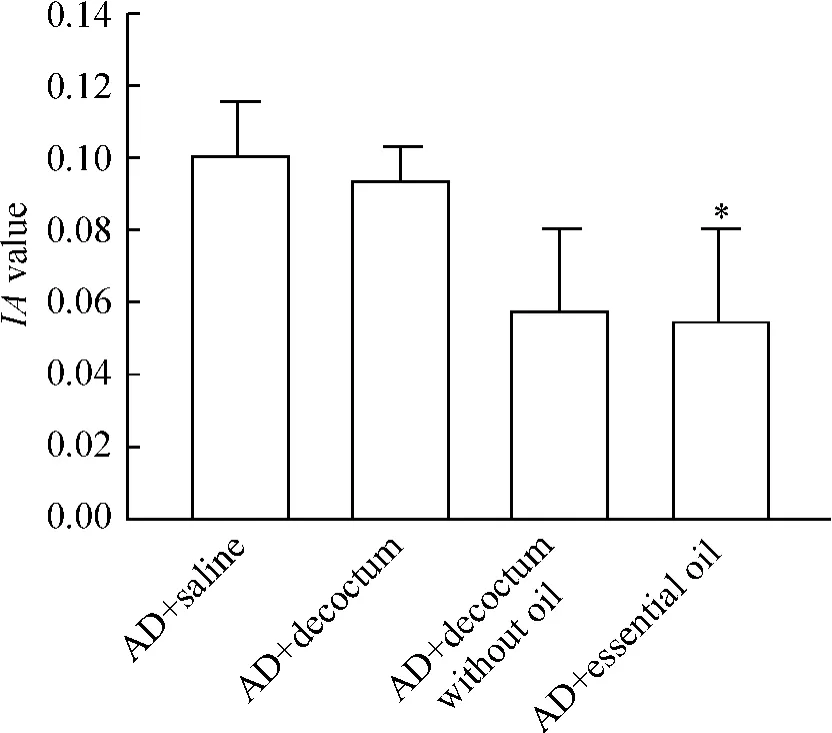
Figure 2.Comparison of IA of NOS positive cells in mouse brain tissues..n=6,*P<0.05 vs AD plus saline group.图2 各组小鼠脑组织内NOS阳性细胞IA的比较
NO是一种中枢神经系统细胞间的气体信号分子,与神经系统的发育、成熟、学习记忆等密切相关。海马LTP被认为是突触可塑性和学习记忆的主要机制[1,11]。NO从突触后释放,通过扩散作用于突触前神经末梢及胶质细胞,提高自发的小规模兴奋性突触后电位,诱发LTP[1]。NO对中枢神经系统疾病生理病理的关键作用已经明确,既具有潜在的保护作用,又有神经毒性作用[12]。正常情况下,神经元合成和释放适量的NO,参与导向轴突生长、促进递质释放、参与突触可塑性。但若NOS持续增加,NO释放过多,则会诱发细胞毒性作用,从而导致细胞受损,加速神经元凋亡或死亡[13]。也有研究表明过多NO的毒性作用会导致学习记忆障碍[14]。目前普遍认为NO对AD的神经毒性作用已远远超过了其保护作用[1]。从本实验对石菖蒲不同部位灌服后,其生化检测和免疫组织化学检测的结果来看,石菖蒲不同药效部位对大脑和海马内NOS总的影响是降低NOS活性。但结果也表明石菖蒲不同药效部位灌胃后,对记忆功能和NOS活性的影响是不同的。其中挥发油和水提液灌胃组对AD模型小鼠认知功能的改善、NOS活性的降低效果最为显著。这和以往研究结果有所不同,以往认为,石菖蒲改善认知功能的药效部位主要在挥发油成分,而本研究的结果提示,在石菖蒲的水溶性成分中,含有同样重要的药效成分,或重要的药效协同成分,这和前述的Morris水迷宫实验结果是一致的。就石菖蒲改善学习记忆能力的NOS机制来看,可能是由于水提液灌胃组、挥发油活性和去油水煎液灌胃后抑制了NOS的合成,使大脑和海马内源性NO合成释放随之较少,可使神经元诱发和维持LTP,增强突触传递效应,通过这种机制改善学习记忆能力。也可能与石菖蒲能调节某些神经递质的释放去影响NO的合成释放,从而促进学习记忆能力的恢复有关。石菖蒲不同药效部位在体内的作用很可能存在复杂过程和机制。本研究仅从NOS角度做了初步探讨,更深入和确切的机制还需进一步研究。
[1]沈 峰,孙国杰,王 飞.电针对 Aβ25-35所致AD大鼠海马NOS活性的影响[J].湖北中医杂志,2009,31(3):10-12.
[2]王 锋,韩 柏,郭建红,等.脑内Aβ沉积与AD模型大鼠学习记忆能力关系的研究[J].中国病理生理杂志,2010,26(3):584-586.
[3]吴 宾,方永奇.石菖蒲益智作用的物质基础及其机理研究[J].中医药学刊,2004,22(9):1635-1636,1640-1641.
[4]Limon ID,Mendieta L,Diaz A,et al.Neuroprotective effect of alpha-asarone on spatial memory and nitric oxide levels in rats injected with amyloid - β25-35[J].Neurosci Lett,2009,453(2):98 -103.
[5]马艳喜,角建瓴,刘承宜,等.石菖蒲水提取液及挥发油对淀粉样β蛋白25-35二级结构的影响[J].中国病理生理杂志,2007,23(2):352-355.
[6]Inoue R,Hashimoto K,Harai T,et al.NMDA - and β-amyloid1-42-induced neurotoxicity is attenuated in serine racemase knock - out mice[J].J Neurosci,2008,28(53):14486-14491.
[7]Paxinos G,Franklin KB.The mouse brain in stereotaxic coordinates[M].2nd ed.New York:Academic Press,2001.
[8]Srivareerat M,Tran TT,Alzoubi KH,et al.Chronic psychosocial stress exacerbates impairment of cognition and long- term potentiation in β - amyloid rat model of Alzheimer's disease [J].Biol Psychiatry,2009,65(11):918-926.
[9]唐洪梅,席 苹.石菖蒲不同部位镇静抗致惊厥作用实验研究[J].中国实验方剂学杂志,2004,10(4):45-47.
[10]Takeda S,Sato N,Niisato K,et al.Validation of Aβ1-40 administration into mouse cerebroventricles as an animal model for Alzheimer disease[J].Brain Res,2009,1280:137-147.
[11]陈 玲,吕佩源.学习记忆的突触模型——长时程增强效应的研究进展[J].疑难病杂志,2006,5(3):313-314.
[12]Veltkamp R,Rajapakse N,Robins G,et al.Transient focal ischemia increases endothelial nitric oxide synthase in cerebral blood vessels[J].Stroke,2002,33(11):2704 -2710.
[13]张均田,张庆柱.神经药理学研究技术与方法[M].第1版.北京:人民卫生出版社,2005.122-123.
[14]韩太真,吴馥梅.学习与记忆的神经生物学[M].第1版.北京:北京医科大学中国协和医科大学联合出版社,1998.102.
