三氧化二砷对MRL/lpr狼疮鼠IFN-γ基因表达的调控*
2012-07-31朱晓芳王晓冰陈培荣朱小春
朱晓芳,王晓冰,陈培荣,嘉 婷,朱小春
(温州医学院附属第一医院风湿免疫科,浙江 温州 325000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因未明的累及多系统的慢性反复性自身免疫疾病。SLE病人与动物模型中干扰素γ(interferon-gamma,IFN-γ)的表达增加是导致疾病发展的重要机制之一[1-2]。三氧化二砷(arsenic trioxide,ATO)是中药砒霜的主要成分,已成功应用于急性早幼粒细胞白血病及一些实体肿瘤的临床治疗[3]。国外研究[4]及我们的前期研究[5-6]均证实ATO是一种治疗SLE很有前景的药物,但其具体机制尚待进一步研究。本文通过运用染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)方法研究ATO对狼疮鼠IFN-γ基因表达的调控,为ATO治疗SLE的作用机制提供重要的实验依据。
材料和方法
1 材料
1.1 主要试剂和器材 ATO、植物血凝素P(phytohemagglutinin-P,PHA-P)和37%的甲醛(252549)购自Sigma;抗RNA聚合酶Ⅱ(RNA polymeraseⅡ,RNAP II)抗体、ChIP试剂盒(#17-371)购自Millipore;乙酰化组蛋白H4(acH4)抗体(ab15823)和乙酰化组蛋白H3(acH3)抗体(ab10812)购自Abcam;重组人白细胞介素-2(interleukin-2,IL-2)购自上海华新生物高技术有限公司;RPMI-1640和胎牛血清(FCS)购自Gibco;小鼠淋巴细胞分离液(北京索莱宝);Trizol购自 Invitrogen;RT-PCR试剂盒、SYBR Green real-time PCR试剂盒购自Toyobo;小鼠IFN-γ ELISA试剂盒购自深圳晶美生物工程有限公司;超声波细胞破碎仪JY92-Ⅱ购自宁波新芝;荧光定量PCR仪采用ABI的StepOne Plus Real-Time PCR System。实验中所用引物由Invitrogen合成。
1.2 动物 20周龄 MRL/lpr狼疮鼠15只,体重36~38 g;20周龄 C57BL/6J小鼠 28只,体重20~22 g,购自中国科学院上海实验动物中心,饲养在温州医学院动物实验中心SPF级动物房。
2 方法
2.1 细胞培养与实验分组 颈椎脱臼法处死小鼠后,无菌条件下取脾脏,用200目筛网轻轻研磨脾脏过滤成单细胞悬液,采用密度梯度离心法自脾脏单细胞悬液中分离小鼠淋巴细胞,用10%FCS-RPMI-1640重悬,调整细胞浓度为2×109/L,37℃、5%CO2孵箱培养1~2 h后观察细胞生长情况,排除细菌生长,台盼蓝染色法测定细胞存活率>98%。加入PHA-P(终浓度20 mg/L)和IL-2(终浓度106IU/L),孵箱继续培养48 h后随机分为2组:(1)PBS组:为空白对照组;(2)ATO 组:1.0 μmol/L ATO 作为实验组,共同培养24 h。
2.2 ELISA法测定各组培养上清液IFN-γ的浓度 收集细胞悬液于Eppendorf管,离心后吸取细胞上清液置于-80℃冰箱保存待测。严格按试剂说明书操作,显色后在全自动酶标仪上450 nm波长处读取A值,通过绘制标准曲线求出指标含量。
2.3 实时荧光定量PCR法检测各组细胞IFN-γ mRNA的表达 用Trizol法抽提RNA,测RNA浓度后取2 μg的RNA,采用日本东洋纺(Toyobo)的 RT-PCR试剂盒,依照说明书进行逆转录反应。以β-actin为内参照,采用实时荧光定量PCR进行IFN-γ和β-actin产物扩增及结果分析。IFN-γ引物序列:上游为5'-ggaaccctctcccttcaatgt-3';下游为5'-ctccacaatagccttcagtgc-3'。β-actin引物序列:上游为5'-gagaccttcaacaccccagc-3';下游为 5'-atgtcacgcacgatttccc-3'。反应体系:SYBR-Green Master Mix 10 μL,Plus 2 μL,上、下游引物(10 μmol/L)各1.5 μL,DNA 模板 2 μL,加灭菌双蒸水补至总体积20 μL。PCR循环条件设置:94℃变性10 min后,94℃ 20 s,60℃ 1 min,扩增50个循环,反应完成后再于95℃ 15 s,60℃ 1 min,95℃ 15 s绘制熔解曲线。根据Livak和Schmittgen设计的阈值法测定目的基因的相对表达水平,目的基因量 =2-ΔΔCt,将 C57BL/6J小鼠PBS组(C57 PBS)作为样本校正,其表达水平设置为1,ΔΔCt = [Ct目的基因(其它实验组)-Ct内参照(其它实验组)]-[Ct目的基因(C57 PBS)- Ct内参照(C57 PBS)]。
2.4 ChIP 主要步骤:(1)蛋白-DNA交联和裂解细胞:取10 mL细胞悬液(约2×107个细胞),加入37%甲醛使之终浓度为1%,37℃孵育10 min。加入甘氨酸终止交联反应,洗涤2次。离心去上清后加入1 mL含蛋白酶抑制剂的SDS裂解液重悬细胞沉淀,冰上孵育10 min。(2)超声断裂染色质:按优化好的条件(200 W,每次超声15 s,间隔30 s,共10次)断裂细胞裂解液中的染色质,使DNA的长度主要分布在200~1000 bp,4℃离心保留上清。(3)免疫共沉淀:超声处理后的溶液中加入含蛋白酶体抑制剂的ChIP稀释缓冲液,用蛋白G-琼脂糖小珠进行预清除,离心后吸取1%上清留作input溶液,将剩余的上清分装,每管1.0 mL,分别加入特异性抗体(抗 RNAPⅡ抗体每管 5.0 μg,抗 acH3 抗体每管 3 μg,抗 acH4 抗体每管 2.5 μg)及阴性对照抗体(正常小鼠IgG每管1.0μg),4℃摇床上孵育过夜。第2 d溶液中加入蛋白G-琼脂糖小珠吸附免疫沉淀复合物,离心去上清,依次用低盐、高盐、氯化锂和TE缓冲液清洗蛋白G-琼脂糖小珠。(4)洗脱免疫沉淀复合物:配制新鲜洗脱液用于洗脱免疫沉淀复合物,同时在装有Input溶液的管中加入相同体积的洗脱缓冲液。(5)蛋白-DNA复合物解交联:加入5 mol/L NaCl使之终浓度为0.02 mol/L,65℃水浴孵育过夜。(6)用DNA纯化柱回收DNA。
2.5 半定量PCR分析ChIP产物 半定量PCR分析ChIP产物,用于扩增IFN-γ基因启动子的引物如下:上游引物为5'-tcagctgatcctttggaccc-3',下游引物为5'-ctcagagctaggcgcagg-3'。反应体系:10×PCR buffer 2 μL、2 mmol/L dNTP 2 μL、25 mmol/L MgSO40.8 μL、上下游引物(10 μmol/L)各 1 μL、KOD Plus 0.4 μL、DNA 模板 2 μL,加灭菌双蒸水补至总体积 20 μL。PCR循环条件设置:94℃变性3 min后,94℃ 20 s,59℃ 30 s,72℃ 30 s,扩增32个循环,然后行72℃ 2 min。最后将PCR产物行2%琼脂糖凝胶电泳。
2.6 实时荧光定量PCR分析ChIP产物 实时荧光定量PCR分析ChIP产物,用于扩增的IFN-γ基因启动子引物如下:上游为 5'-tttcagagaatcccacaagaatg-3',下游为5'-tcgggattacgtattttcacaag-3'。采用ABI公司的StepOne Plus Real-Time PCR System对CHIP产物分析,反应体系:SYBR-green master mix 10 μL、Plus 2 μL、上下游引物(10μmol/L)各 1 μL、DNA模板 2 μL,加灭菌双蒸水补至总体积20 μL。PCR循环条件设置:94℃变性10 min后,94℃20 s,60℃ 1 min,扩增50个循环,反应完成后再于95℃ 15 s,60℃ 1 min,95℃ 15 s绘制熔解曲线,分析方法参考文献[7]和ChampionChIP qPCR Primers说明书介绍的方法,用ΔΔCt值进行相对定量,各实验组均以C57BL/6J小鼠PBS组(C57 PBS)为对照组,其表达水平设置为1,计算其它实验组较对照组C57 PBS组的倍数改变。
3 统计学处理
以SPSS 17.0统计学软件进行分析。数据以均数±标准()表示,进行方差齐性检验,根据样本的性质采用单因素方差分析、Dunnet's T3检验。以P<0.05为有统计学意义。
结 果
1 ELISA法测定上清液中IFN-γ浓度的结果
(1)MRL/lpr狼疮鼠PBS组IFN-γ的分泌高于C57BL/6J小鼠PBS组(P<0.01);(2)在 MRL/lpr狼疮鼠中,与PBS组相比,ATO组IFN-γ的分泌下降(P<0.01);(3)在 C57BL/6J小鼠中,PBS组和ATO组之间IFN-γ的浓度无差异,见表1。
表1 MRL/lpr小鼠和C57BL/6J小鼠细胞上清液中IFN-γ的浓度Table 1.The expression of IFN - γ in the supernatants of the cells from MRL/lpr mice and C57BL/6J mice(ng/L..n=6)

表1 MRL/lpr小鼠和C57BL/6J小鼠细胞上清液中IFN-γ的浓度Table 1.The expression of IFN - γ in the supernatants of the cells from MRL/lpr mice and C57BL/6J mice(ng/L..n=6)
**P <0.01 vs MPL/lpr PBS group.
PBS 273.005 ±18.824 168.462 ±11.779**ATO 191.731 ±16.522** 160.914 ±14.526**
2 超声波断裂染色质
按优化好的条件(200 W,每次超声15 s,间隔30 s,共10次)断裂细胞裂解液中的染色质,切割后的DNA片段主要分布在200~1000 bp,基本符合ChIP的要求,见图1。
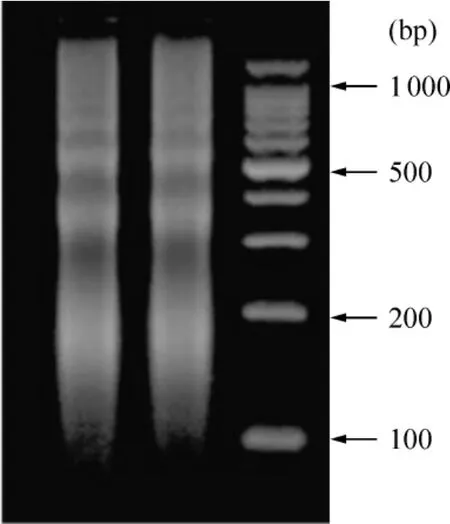
Figure 1.The segments of crosslinked DNA cut by ultrasound were mainly 200 ~1000 base pairs in size.图1 超声波切割染色质DNA琼脂糖凝胶电泳图
3 半定量PCR分析ChIP结果
半定量PCR分析各组细胞IFN-γ启动子区acH3、acH4及启动子区结合RNAPⅡ的水平。超声打断之后,以各组input DNA为模板,以IFN-γ为引物,通过调整模板量,重复验证以最后在各组的input DNA扩增出相同条带时的模板量作为最后抗体处理过的DNA样本做PCR所需的模板量,并且将PCR产物稀释2倍,琼脂糖凝胶电泳显示。与正常C57BL/6J小鼠相比,MRL/lpr狼疮鼠脾脏淋巴细胞IFN-γ启动子区acH3和acH4的水平升高,更多的RNAPⅡ被富集到IFN-γ启动子区域;ATO能降低MRL/lpr狼疮鼠脾脏淋巴细胞IFN-γ基因启动子区域acH3和acH4的水平,减弱RNAPⅡ与IFN-γ启动子区域的结合,而对正常C57BL/6J小鼠无明显影响,见图2。
4 实时荧光定量PCR分析ChIP结果及IFN-γ mRNA的表达情况:
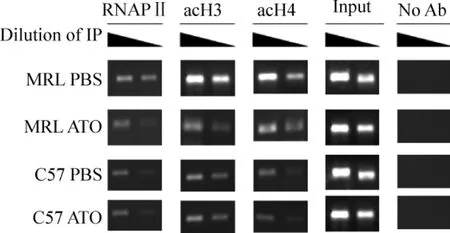
Figure 2.Identification of ChIP by semiquantitative PCR and agarose gel electrophoresis.图2 半定量PCR验证ChIP的琼脂糖凝胶电泳图
(1)MRL/lpr狼疮鼠PBS组IFN-γ mRNA的表达高于C57BL/6J小鼠PBS组(P<0.05),并且IFN-γ启动子区acH3、acH4的水平及启动子区域富集RNAPⅡ水平高于 C57BL/6J小鼠 PBS组(均 P<0.01);(2)在 MRL/lpr狼疮鼠中,与 PBS组相比,ATO组IFN-γ mRNA的表达下降(P<0.05),IFN-γ基因启动子区域acH3、acH4的水平及启动子区域富集RNAPⅡ水平也下降(均P<0.01);(3)在C57BL/6J小鼠中,PBS组和ATO组之间以上指标均无差异,见图3。
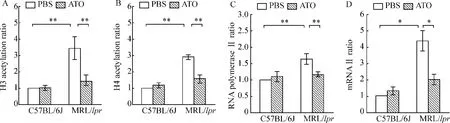
Figure 3.All samples were divided and analyzed by quantitative real-time PCR -based ChIP to measure the degree of histones H3(A)and H4(B)acetylation at IFN-γ promoter regions and the combination of RNA polymeraseⅡto IFN -γ promoter(C).Quantitative real-time PCR was also used to measure the levels of IFN-γ mRNA(D)..n=3.*P<0.05,**P<0.01 vs each other.图3 实时荧光定量PCR分析ChIP结果及IFN-γ mRNA的表达
讨 论
SLE是一种常见的自身免疫性疾病,其病因和发病机制尚未完全阐明。处于活动期的SLE病人全血细胞中IFN-γ的分泌量明显高于正常人,并且分泌水平与SLEDAI(SLE活动性指标)呈不同程度的正相关[1]。Hasegawa等[2]认为循环和组织 IFN - γ的表达增加是导致SLE疾病发展和肾脏损害的重要机制。越来越多的研究表明下调IFN-γ水平可作为治疗 SLE 的新靶点[8-9]。Bobe 等[4]提出:ATO 能下调 MRL/lpr狼疮鼠血清 IFN-γ的水平,减少MRL/lpr小鼠皮肤损害和肾小球免疫复合物的沉积,极大地延长生存时间。这与我们的前期体内研究[5-6]相一致。
我们的前期研究发现1.0 μmol/L ATO体外作用MRL/lpr狼疮鼠24 h是最佳作用时间和作用浓度。本研究发现,L/lpr狼疮鼠脾脏淋巴细胞IFN-γ的分泌水平及其mRNA的表达高于正常C57BL/6J小鼠;ATO能下调MRL/lpr狼疮鼠脾脏淋巴细胞IFN-γ的分泌水平及其 mRNA的表达,而对正常C57BL/6J小鼠无明显影响。ATO通过何种机制下调MRL/lpr狼疮鼠IFN-γ mRNA的表达,从而降低IFN-γ的分泌水平是本研究的重点。
组蛋白乙酰化修饰是基因转录调控的重要机制。当组蛋白乙酰化水平升高时,染色质处于活化或开放状态,此时核小体之间的致密度很低,允许了转录复合体的进入,从而导致基因的转录,反之,则阻止了基因的转录[10-11]。Long 等[12]发现组蛋白的高乙酰化是导致IFN-γ基因转录表达量增加的主要机制,而组蛋白的乙酰化水平下降时,IFN-γ基因转录表达量也下调。ChIP是一种能真实反映细胞内DNA结合蛋白与基因组DNA相互作用的实验技术,目前常用于研究组蛋白修饰,转录因子和染色质调控复合物与 DNA的相互作用[13]。本研究运用ChIP技术发现MRL/lpr狼疮鼠脾脏淋巴细IFN-γ启动子区acH3、acH4的水平较正常C57BL/6J小鼠升高,ATO能降低MRL/lpr狼疮鼠脾脏淋巴细胞IFN-γ基因启动子区域acH3和acH4的水平,而对正常C57BL/6J小鼠无明显影响。我们由此推测,MRL/lpr狼疮鼠脾脏淋巴细胞高表达IFN-γ mRNA可能与其基因启动子区域acH3、acH4的水平升高有关,而ATO可能通过下调IFN-γ启动子区域acH3、acH4的水平,阻碍了转录复合体的进入,从而阻止IFN-γ基因的转录,减少IFN-γ mRNA的表达。
RNAPⅡ与相应转录因子组成mRNA的转录复合体在基因的转录中起着重要的作用[14]。在ChIP应用抗RNAPⅡ抗体,了解RNAPⅡ与基因启动子区结合情况,能较好地反映mRNA的转录情况:转录激活时RNAPⅡ与基因启动子区域的结合水平升高,反之,二者结合水平下降[15]。本研究发现与正常C57BL/6J小鼠相比,更多的RNAPⅡ被富集到MRL/lpr狼疮鼠脾脏淋巴细胞IFN-γ的启动子区域,ATO能减弱MRL/lpr狼疮鼠RNAPⅡ与IFN-γ启动子区域的结合,而对正常C57BL/6J小鼠无明显影响。因此,ATO可能通过减弱MRL/lpr狼疮鼠RNAPⅡ与IFN-γ启动子区域的结合而阻止IFN-γ基因的转录。
综上所述,通过MRL/lpr狼疮鼠这个模型我们可以推测ATO可能通过下调MRL/lpr狼疮鼠IFN-γ基因启动子区域acH3和acH4的水平,减弱RNAPⅡ依赖的转录,从而降低IFN-γ mRNA的表达,下调IFN-γ的分泌水平。但ATO对转录因子如STAT4、T-bet以及组蛋白的其它修饰仍待进一步研究。
[1]Lit LC,Wong CK,Tam LS,et al.Raised plasma concentration and ex vivo production of inflammatory chemokines in patients with systemic lupus erythematosus[J].Ann Rheum Dis,2006,65(2):209 -215.
[2]Hasegawa K,Hayashi T,Maeda K.Promotion of lupus in NZB×NZWF1mice by plasmids encoding interferon(IFN)-γ but not by those encoding interleukin(IL)-4[J].Comp Pathol,2002,127(1):1 -6.
[3]任玮玮,李 弘,张 洹.三氧化二砷对肝癌细胞生长抑制作用差异性探讨[J].中国病理生理杂志,2004,20(7):1179 -1182.
[4]Bobé P,Bonardelle D,Benihoud K,et al.Arsenic tri oxide:a promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice[J].Blood,2006,108(13):3967 -3975.
[5]王晓冰,陈培荣,张 挺,等.三氧化二砷对MRL/lpr狼疮鼠IFN-γ、IL-4表达和Th1/Th2平衡的影响[J].细胞生物学杂志,2008,30(4):509 -514.
[6]Xia XR,Xu H,Zhu XC.Effects of arsenic trioxide on survival rate and autoimmune responses of lupus mice[J].Chin J Pharmacol Toxicol,2007,21(6):482 -486.
[7]Pace BS,Qian XH,Sangerman J,et al.p38 MAP kinase activation mediates γ-globin gene induction in erythroid progenitors[J].Exp Hematol,2003,31(11):1089 -1096.
[8]Lawson BR,Prud'homme GJ,Chang Y,et al.Treatment of murine lupus with cDNA encoding IFN - γR/Fc[J].J Clin Invest,2000,106(2):207 -215.
[9]Shirota H,Gursel M,Klinman DM.Suppressive oligodeoxynucleotides inhibit Th1 differentiation by blocking IFN- γ and IL -12 - mediated signaling[J].J Immunol,2004,173(8):5002 -5007.
[10]Backs J,Olson EN.Control of cardiac growth by histone acetylation/deacetylation[J].Circ Res,2006,98(1):15-24.
[11]Urnov FD,Wolffe AP.Chromatin remodeling and transcriptional activation:the cast(in order of appearance)[J].Oncogene,2001,20(24):2991 -3006.
[12]Long M,Slaiby AM,Wu S,et al.Histone acetylation at the Ifng promoter in tolerized CD4 cells is associated with increased IFN-γ expression during subsequent immunization to the same antigen[J].J Immunol,2007,179(9):5669-5677.
[13]李敏俐,王 薇,陆祖宏.ChIP技术及其在基因组水平上分析DNA与蛋白质相互作用[J].遗传,2010,32(3):219-228.
[14]Sims RJ3rd,Belotserkovskaya R,Reinberg D.Elongation by RNA polymerase II:the short and long of it[J].Genes Dev,2004,18(20):2437 -2468.
[15]Sandoval J,Rodríguez JL,Tur G,et al.RNAPol- ChIP:a novel application of chromatin immunoprecipitation to the analysis of real-time gene transcription[J].Nucleic Acids Res,2004,32(11):e88.
