血管紧张素Ⅱ刺激血管平滑肌细胞表达TSLP及信号通路研究①
2012-07-30何少林马旭明李大主
赵 卉 何少林 林 静 马旭明 李大主
(华中科技大学同济医学院协和医院心内科,武汉430022)
动脉粥样硬化(AS)是一种慢性免疫炎症性疾病[1]。AngⅡ作为肾素-血管紧张素系统(RAS)的主要成分,能够刺激血管细胞产生细胞因子和生长因子通过受体介导方式及复杂的胞内信号通路参与AS的炎症反应[2],但具体机制尚不十分清楚。我们的研究发现树突状细胞(DC)的激活在AS形成发展过程中起着重要作用[3]。最近研究表明胸腺基质淋巴细胞生成素(TSLP)是DC成熟活化的重要刺激因子[4,5]。支气管平滑肌细胞在多种炎症因子刺激下可表达 TSLP,并介导支气管炎症反应[6]。AngⅡ是否通过刺激血管平滑肌细胞(VSMC)表达TSLP而引发AS炎症反应尚无报道,本文就此进行探讨。
1 材料与方法
1.1 主要试剂 DMEM高糖培养基(无碳酸氢钠)及新生牛血清购于Gibco公司,培养基按说明书配制,4℃保存,血清使用前56℃水浴30分钟灭活补体后分装,-20℃保存;AngⅡ、PDTC购于Sigma公司;DMSO购于上海华美生物工程公司;胰蛋白酶购于Amersco公司;TSLP ELISA试剂盒购于R&D公司;TSLP免疫组化试剂的一抗购于ProSci公司;两步法抗兔/鼠通用型免疫组化试剂盒购于基因科技(上海)公司;EMSA试剂盒购于美国Pierce公司。
1.2 方法
1.2.1 VSMC培养 取 Sprague-Dawley雄性大鼠(150~180克,购自华中科技大学同济医学院实验动物中心)胸主动脉,去除血管内膜和外膜,将中膜剪成1 mm2大小的组织块,贴片于培养皿底部,用含20%新生牛血清的DMEM培养基,置37℃、5%CO2孵育箱中培养细胞。细胞生长融合后,用0.125%胰蛋白酶消化传代。实验选用第4~10代培养细胞。倒置显微镜下见传代细胞呈典型的“峰-谷”样生长,免疫细胞化学染色见细胞内α2肌动蛋白呈阳性,确定为平滑肌细胞。
1.2.2 分组及处理 本实验共分3组:(1)对照组:正常培养的VSMC。(2)AngⅡ刺激组:①以不同浓度梯度(0.01、0.1、1 μmol/L)的 Ang Ⅱ刺激VSMC 6小时;②用 AngⅡ(0.1μmol/L)分别刺激VSMC 3、6、12、24小时。(3)Ang Ⅱ +PDTC 组:先用PDTC 10μmol/L预处理VSMC 30分钟后给予Ang Ⅱ(0.1 μmol/L)孵育3、6、12、24 小时。
1.2.3 免疫组织化学染色检测细胞中TSLP的表达 在6孔板内预置一盖玻片,接种VSMC(1×104/孔),用AngⅡ和PDTC按上述方法对细胞加以刺激。将含有贴壁细胞的盖玻片用0.01 mol/L PBS(pH=7.2~7.4)浸洗3次,4%多聚甲醛固定1小时,取出盖玻片固定于载玻片上,PBS洗3次;0.1%Triton X-100反应15分钟;PBS洗3次;3%H2O2-甲醇封闭15分钟,以阻断内源性过氧化物酶;PBS洗3次;甩去PBS液,滴加第一抗体;每张切片加入50 μl稀释液,4℃过夜;PBS洗3次;甩去PBS液,每张切片加50~100μl A液,室温下孵育45分钟;PBS洗3次;每张切片加50~100μl新鲜配制的DAB溶液,显微镜控制显色。常规脱水、透明、封片。阴性对照采用PBS代替一抗,其余步骤相同。用IPP对免疫组化结果进行图像分析,每张切片取5个不同视野,TSLP阳性表达用平均光密度(累计光密度IOD/细胞个数n)表示。
1.2.4 ELISA检测上清液中TSLP浓度 操作按试剂盒说明进行。
1.2.5 EMSA检测VSMC NF-κB的结合活性 ①细胞核蛋白提取和探针标记:收集上述各组VSMC,按文献[7]的方法加以改良后提取核蛋白,用BCA法测定蛋白浓度,-70℃保存备用。含NF-κB结合位点的双链寡核苷酸探针序列为:5'-AGT TGA GGG GAC TTT CCC AGG C-3',5'-GCC TGG GAA AGT CCC CTC AAC T-3'。在其3'末端进行生物素标记。②反应体系:取等量核蛋白30μg,每组加入10×Binding Buffer 2 μl、1 μg/μl Poly(dI·dC)1 μl、50%Glycerol 1 μl、100 mmol/L MgCl21 μl、1%NP-40 1 μl、生物素标记的探针1 μl,总体积20 μl,不足的用双蒸水补齐。对于竞争性反应,在此反应体系中加入100倍浓度的非标记探针1μl。加入非标记探针后37℃一同孵育30分钟,后各管加入标记探针,37℃孵育15分钟。各管加入5×Loading Buffer 5μl,混匀后上样。用6%的非变性聚丙烯酰胺凝胶进行电泳,电压为100 V/cm。380 mA恒流30分钟,将DNA-蛋白质复合物转移至尼龙膜上,紫外灯下交联15分钟。按试剂盒说明先后进行封闭、孵育、洗膜,暗室中自显影,使用美国UVP凝胶成像系统进行摄像,IPP软件对条带进行灰度测定。
1.3 统计学处理 以上各组实验至少独立重复3次,数值用±s表示,结果用SPSS17.0统计软件进行统计学处理。组间数据根据方差齐性检验结果,进一步使用S-N-K检验进行组间差异比较。以P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ及PDTC对VSMC胞浆中TSLP表达的影响 对照组VSMC胞浆淡染,几乎无TSLP表达,AngⅡ刺激组胞质内均有不同程度的TSLP表达,呈棕黄色或黄色颗粒状染色,且有浓度(0.01、0.1、1 μmol/L)和时间(3、6、12、24 小时)依赖性。其中 1 μmol/L组及24小时组阳性细胞的数量最多,染色最深。AngⅡ +PDTC组,较AngⅡ组阳性细胞数量明显减少,染色程度降低,但较对照组仍有明显增强。选取对照组;AngⅡ(0.1μmol/L)刺激12小时;AngⅡ(0.1μmol/L)+PDTC(10 μmol/L)刺激12小时三组,如图1:各组平均光密度依次为15.17±2.26、1 390.39 ±28.24、256.32 ±15.92。(三组之间两两比较差异均有统计学意义,均P<0.001)。
2.2 AngⅡ及PDTC对VSMC分泌TSLP的影响 Ang Ⅱ(0.01、0.1、1 μmol/L)刺激 VSMC 6 小时检测上清中的TSLP浓度(图2):AngⅡ各浓度刺激组上清液中的TSLP浓度显著高于对照组(0μmol/L)(均 P <0.01),0.01、0.1、1 μmol/L 三组相比,随着AngⅡ浓度的升高上清中的TSLP浓度明显增加[依次为(23.90 ±3.84)pg/ml、(51.05 ±6.77)pg/ml、(62.17 ±6.08)pg/ml,均 P <0.05]。

图1 免疫组织化学检测VSMC中的TSLP表达Fig.1 Immunohistochemical staining analysis of the expression of TSLP in rat VSMC

图2 不同浓度的AngⅡ刺激组上清液中的TSLP浓度Fig.2 Release of TSLP protein by VSMC exposed to AngⅡfor different concentrations
分别以 AngⅡ(0.1μmol/L)及 AngⅡ(0.1 μmol/L)+PDTC(10 μmol/L)刺激 VSMC 3 、6、12、24小时后检测上清中TSLP浓度比较(图3):AngⅡ(0.1μmol/L)各处理组与对照组(0小时)相比,TSLP的浓度明显增加(均P<0.001),并随着刺激时间的延长浓度增大(均 P<0.01);AngⅡ与 AngⅡ +PDTC两种处理比较:3小时组差异无统计学意义(P >0.05)。6、12、24 小时组:AngⅡ+PDTC 组 TSLP的浓度明显低于AngⅡ处理组(均P<0.001)。
2.3 AngⅡ刺激VSMC产生TSLP的同时上调NF-κB的结合活性 用AngⅡ(0.1μmol/L)及AngⅡ(0.1 μmol/L)+PDTC(10 μmol/L)刺激 VSMC 12小时,收集细胞,提取核蛋白,做EMSA结果(图4):正常未经处理的VSMC(图4:Control)有基础性的NF-κB活化,AngⅡ可以显著增加NF-κB的结合活性,PDTC可明显抑制这一作用。灰度值比较(图4B):各组差异有统计学意义(P<0.01)。
3 讨论
AS是一种慢性免疫炎症性疾病[1]。从早期各种危险因素所致的内皮细胞损伤到纤维斑块的破裂,炎症贯穿AS始终。近年来的基础和临床研究从AngⅡ、AT1受体拮抗剂、ACEI等多方面阐述了RAS系统尤其是 AngⅡ在AS炎症中的作用机制[8]。AngⅡ可以上调粘附分子,炎症趋化因子和细胞因子的表达,诱导内皮细胞功能紊乱,LDL的氧化摄取,平滑肌细胞增殖,在AS的发生发展中起重要作用[9]。目前研究认为作为专职的抗原提呈细胞DC所介导的特异性免疫在AS进展中也发挥着重要作用[3,10]。我们发现 DC在AS患者中高度活化,并且在AS斑块中大量聚集,与斑块的不稳定有关[3]。然而AngⅡ所介导的炎症激活作用是否通过DC途径产生目前还不清楚。

图3 不同时间梯度的各刺激组上清液中TSLP的浓度Fig.3 Release of TSLP protein by VSMC exposed to AngⅡwith or without PDTC for different durations
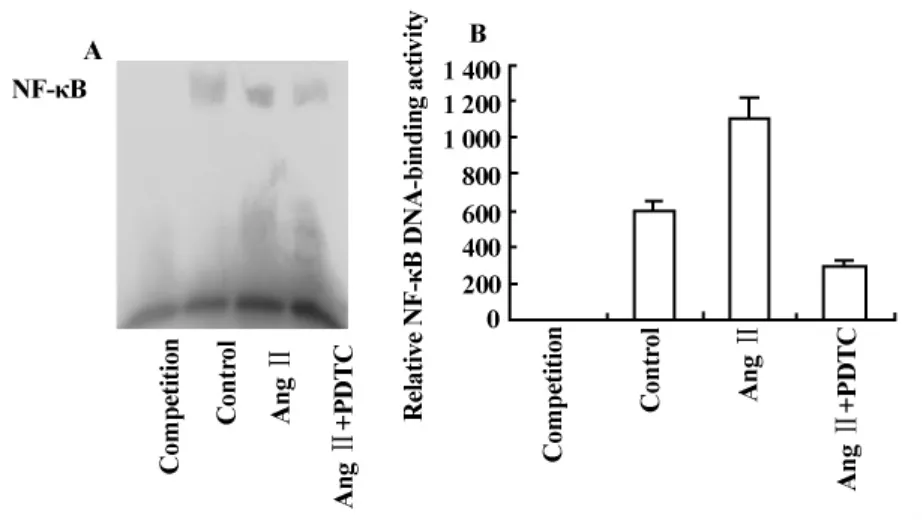
图4 EMSA检测VSMC NF-κB结合活性Fig.4 The activation of NF-κB in primary rat VSMC exposed to AngⅡ
TSLP是一种结构类似IL-7的新型细胞因子,主要表达于胸腺基质细胞、上皮细胞。在免疫细胞(DC、T细胞、单核细胞等)及心脏,骨骼肌等组织中可检测到TSLPR mRNA。该因子在DC的成熟活化及Th2和Treg的分化成熟中起着重要的调控作用,参与支气管哮喘、特应性皮炎、炎症性肠病等免疫炎症性疾病的进展过程[5]。Zhang 等[6]证实 IL-1β 和TNF-α可诱导HASMC TSLP的表达,在气道炎症反应起重要作用。AngⅡ是否通过刺激VSMC产生TSLP,从而激活DC导致AS炎症反应尚无研究。本研究证实正常未经处理的大鼠VSMC几乎不表达TSLP,经AngⅡ刺激后TSLP的表达及分泌量显著升高,并有剂量和时间依赖性,说明AngⅡ可以刺激VSMC产生TSLP,有可能通过激活DC在AS的炎症反应中起作用。作为细胞内主要的炎症反应信号通路NF-κB系统在AngⅡ介导的炎症反应中发挥关键作用。AngⅡ通过激活NF-κB刺激VSMC表达细胞粘附分子(如 VCAM-1、ICAM-1、E-选择素),炎症趋化因子(如MCP-1),细胞因子(如IL-6、IL-8)等介导血管炎症,参与AS的形成和发展。本实验发现相同条件下,AngⅡ可激活VSMC的NF-κB信号通路,可以提示我们AngⅡ很可能通过活化VSMC NF-κB,诱导TSLP表达。
肾素-血管紧张素系统和DC在AS免疫炎症反应中均起着重要作用。本实验表明AngⅡ可以刺激VSMC产生TSLP,其机制可能与上调NF-κB的结合活性有关。
1 Galkina E,Ley K.Immune and inflammatory mechanisms of atherosclerosis[J].Annu Rev Immunol,2009;27:165-197.
2 Ji Y,Liu J,Wang Z et al.Angiotensin Ⅱ induces inflammatory response partly via Toll-like receptor 4-dependent signaling pathway in vascular smooth muscle cells[J].Cell Physiol Biochem,2009;23(4-6):265-276.
3 Ranjit S,Dazhu L.Potential role of dendritic cells for progression of atherosclerotic lesions[J].Postgrad Med J,2006;82(971):573-575.4 Wang J,Xing F.Human TSLP-educated DCs[J].Cell Mol Immunol,2008;5(2):99-106.
5 He R,Geha R S.Thymic stromal lymphopoietin[J].Ann N Y Acad Sci,2010;1183:13-24.
6 Zhang K,Shan L,Unruh H et al.Constitutive and inducible thymic stromal lymphopoietin expression in human airway smooth muscle cells:role in chronic obstructive pulmonary disease[J].Am J Physiol Lung Cell Mol Physiol,2007;293(2):375-382.
7 De Plaen I G,Han Xin-Bing,Liu X et al.Lipopolysaccharide induces CXCL2/macro-phage inflammatory protein-2 gene expression in enterocytes via NF-κB activation:independence from endogenous TNF-α and platelet-activating factor[J].Immunology,2006;118(2):153-163.
8 Fukuda D,Enomoto S,Nagai R et al.Inhibition of renin-angiotensin system attenuates periadventitial inflammation and reduces atherosclerotic lesion formation[J].Biomed Pharmacother,2009;63(10):754-761.
9 Sata M,Fukuda D.Crucial role of renin-angiotensin system in the pathogenesis of atherosclerosis[J].JMed Invest,2010;57(1-2):12-25.
10 Bobryshev Y V.Dendritic cells and their role in atherogenesis[J].Lab Invest,2010;90(7):970-984.
